что означает пороговая доза для биологических объектов
Пороговая доза
Биотестами для определения пороговой дозы и других показателей токсичности являются мыши и крысы. Эффект действия токсических веществ для исследуемых организмов определяется по наиболее характерным признакам Отравление пестицидами – это любое, даже самое незначительное отклонение от нормальной жизнедеятельности организма под действием их поступления в организм.
Подробнее при переходе по ссылке
«>отравления (снижение массы, роста, реакции организма, изменение активности отдельных его систем и т.п.).
При различных путях поступления в организм пороговая доза одного и того же отравляющего вещества, промышленного яда или пестицида может быть различной. Как правило, те вещества, которые поступают через пищеварительный тракт или ингаляционно (фумиганты, аэрозоли), имеют меньшую пороговую дозу, нежели всасывающиеся с поверхности кожи, то есть, упрощенно говоря, первые действуют при меньшей исходной концентрации, нежели вторые. Это объясняется различной биодоступностью: в желудочно-кишечном тракте и со слизистой бронхов всасывание, как правило, происходит быстрее и полнее, чем с кожи. Для большинства промышленных ядов учитывается пороговая доза при пероральном приеме.
Подробнее при переходе по ссылке
«>отравления требуется более значительное количество токсина, чем для формирования отдаленных последствий в результате хронической интоксикации.
В целом, пороговая доза позиционируется как понятие, характерное для представителей в масштабах вида. Говоря о пороговой дозе какого-то пестицида, подразумевается то минимальное его количество, которое вызовет эффект (патологические изменения процесса жизнедеятельности) у вредных организмов. Однако, воздействуя пороговой дозой отравляющего вещества на вредителя, можно и не добиться результата. Следует учитывать такой фактор, как индивидуальные различия в переносимости токсического воздействия: у отдельных организмов восприимчивость к яду может быть выше или ниже, чем у большинства.
Пороговая доза
Пороговая доза (или минимально действующая доза, порог вредного воздействия) – наименьшее количество вещества, которое вызывает в организме изменения, определяемые наиболее чувствительными физиологическими и биохимическими тестами; доза, ниже которой отсутствуют внешние признаки отравления животного; наименьшая доза вещества, способная дать определенный биологический эффект. [4] [2] [1]
Биотестами для определения пороговой дозы и других показателей токсичности являются мыши и крысы. [3] Эффект действия токсических веществ для исследуемых организмов определяется по наиболее характерным признакам отравления (снижение массы, роста, реакции организма, изменение активности отдельных его систем и т.п.). [2]
При различных путях поступления в организм пороговая доза одного и того же отравляющего вещества, промышленного яда или пестицида может быть различной. Как правило, те вещества, которые поступают через пищеварительный тракт или ингаляционно (фумиганты, аэрозоли), имеют меньшую пороговую дозу, нежели всасывающиеся с поверхности кожи, то есть, упрощенно говоря, первые действуют при меньшей исходной концентрации, нежели вторые. Это объясняется различной биодоступностью: в желудочно-кишечном тракте и со слизистой бронхов всасывание, как правило, происходит быстрее и полнее, чем с кожи. Для большинства промышленных ядов учитывается пороговая доза при пероральном приеме.
Величина пороговой дозы зависит от длительности воздействия отравляющего вещества на организм. Для проявления симптомов острого отравления требуется более значительное количество токсина, чем для формирования отдаленных последствий в результате хронической интоксикации.
В целом, пороговая доза позиционируется как понятие, характерное для представителей в масштабах вида. Говоря о пороговой дозе какого-то пестицида, подразумевается то минимальное его количество, которое вызовет эффект (патологические изменения процесса жизнедеятельности) у вредных организмов. Однако, воздействуя пороговой дозой отравляющего вещества на вредителя, можно и не добиться результата. Следует учитывать такой фактор, как индивидуальные различия в переносимости токсического воздействия: у отдельных организмов восприимчивость к яду может быть выше или ниже, чем у большинства.
Расчет риска угрозы здоровью, вызванной загрязнением
Расчет риска угрозы здоровью, вызванной загрязнением
Загрязнение гидросферы приводит к попаданию вредных веществ в пищевые цепи, в том числе и те, в которых конечным потребителем (консументом) является человек.
Типичный путь загрязнителей:
выброс в поверхностные воды (реки, озера) → водная флора и фауна → рыба → человек.
Как оценить угрозу здоровью, вызванную загрязнением среды обитания? Теория риска позволяет рассчитать вероятность вреда, вызванного попаданием ядовитых веществ в организм человека. Такой расчет может послужить основой для принятия тех или иных профилактических мер.
Что означает рассчитать риск угрозы здоровью? Представим, что в питьевой воде (например, в колодце) обнаружено некоторое количество какого-то тяжелого металла (или пестицида, или нефтепродукта, или радиоактивного вещества). Предположим, что концентрация выявленного загрязнителя оказалась равной его предельно допустимой концентрации (ПДК). Насколько, в среднем, может сократиться жизнь человека, пьющего такую воду на протяжении, скажем, двух лет? Теория риска способна дать ответ на поставленный вопрос, который может быть, например, таким: опасность невелика, но риск не является нулевым, среднее сокращение жизни человека может составить, к примеру, 5 дней.
Теперь представим, что в воде колодца соседней местности обнаружен какой-то другой загрязнитель, концентрация которого также оказалась равной его ПДК в воде. Какова угроза здоровью в этом случае? С помощью теории риска можно получить такой ответ: если человек будет пить эту воду в течение двух лет (как и в первом случае), то продолжительность его жизни сократится, но уже, например, на 25 дней. Следовательно, очистке воды второго колодца следует отдать предпочтение, именно туда надо направить имеющиеся силы и средства.
Таким образом, использование концепции риска позволяет делать количественный прогноз последствий загрязнения окружающей среды, в том числе и гидросферы.
Об экологическом нормировании
Под экологическим нормированием понимается совокупность требований к качеству окружающей среды. Целью таких требований является ограничение степени загрязнения компонетов среды обитания. Возможны разные подходы к экологическому нормированию.
Санитарно-гигиеническое нормирование основано на концепции предельно допустимых концентраций (ПДК) вредных веществ в почвах, воздухе, поверхностных и подземных водах, в продуктах питания. Термин ПДК подразумевает такую концентрацию химического элемента и/или его соединений в компонетах среды обитания, которая при повседневном влиянии на организм человека в течение длительного времени не вызывает паталогических изменений или заболеваний, устанавливаемых современными методами исследований в любые периоды жизни настоящего и последующего поколений [1].
Другой подход к экологическому нормированию основан на введении ограничений не на уровень вредных веществ в отдельных средах, а на общий объем выбросов, определяющий их поступление в среду обитания. Дело в том, что ориентация только на ПДК привела к тому, что задачи по достижению их уровней все чаще стали решать путем более эффективного рассеивания загрязнителей. Для этого стоки промышленных предприятий разбавлялись чистой водой, а выбросы газов и аэрозолей производились через дымовые трубы большой высоты. В английском языке появилась «экологическая» пословица: «The best solution for pollution is dilution» («Наилучшее решение проблемы загрязнения – разбавление»).
Но рассеяние далеко не всегда снижает уровень загрязнения среды обитания. Экологические исследования показали, что в районах крупных промышленных центров при концентрациях токсикантов в атмосфере на уровне ПДК неизбежно происходит накопление одного или нескольких таких токсикантов в каком-либо компоненте окружающей среды. Например, было показано, что при содержании ртути в воздухе, расной ПДК, за счет атмосферных осаждений на почвы и последующего смыва концентрация этого элемента в водоемах может в десятки раз превысить ПДК в воде [2].
Таким образом, подход к экологическому нормированию, ориентированный на общий объем выбросов, должен определить значения предельно допустимых выбросов (ПДВ) и сбросов (ПДС) загрязняющих веществ в окружающую среду. Эти значения должны соответствовать установленным предельным нагрузкам на экосистемы и тем самым сохранять их стабильность.
В документе «Питьевая вода. Гигиенические требования к качеству воды центральных систем питьевого водоснабжения. Контроль качества» (СанПиН 2.1.4.1074-01) приведены значения ПДК загрязнителей питьевой воды, действующие в России [3]. Данные по ПДК некоторых неорганических и органических веществ в питьевой воде приведены соответственно в табл. 1 и 2.
Оценка риска действия токсиканта
Человек подвержен действию огромного количества вредных химикатов, следовательно, всегда имеется риск возможного вреда, причиняемого ими. Очень часто общество нуждаются в разумных, обоснованных предложениях о путях снижения риска. Такие предложения могут быть сделаны только на основе информации о вероятности и характере вредного действия. Это и послужило поводом для разработки методологии оценки риска, которая предназначена для его идентификации, характеристики и измерения.
2. Что такое оценка риска?
Таблица 1. Токсикологическая характеристика вещества, привлекаемая для оценки риска его воздействия
1. Химические и физические свойства
2. Судьба в окружающей среде и способы воздействия на биологические системы (организм)
Б. Стойкость на местности
В. Пути превращения в окружающей среде
Г. Возможности биоаккумуляция и биомагнификации в организмах живых существ:
А. Оценка острой токсичности:
-величины ЛД 50 и ЛК 50
Б. Подострое воздействие:
-токсичность при 90-суточном скармливании токсиканта
В. Хроническое действие:
— токсичность при пожизненном введении
Г. Специальные виды токсичности:
-способность сенситизации кожных покровов
Д. Избирательная токсичность:
-нефротоксичность и т.д.
-мутагенность (исследования на прокариотах, эукариотах)
-способность вызывать хромосомные аберрации
-оценка экологического ущерба
Как указывалось ранее, токсические процессы можно отнести к одной из следующих групп:
— формирующиеся по пороговому принципу;
— формирующиеся по беспороговому принципу.
В первом случае причинно-следственная связь между фактом действия вещества и развитием процесса носит безусловный характер. Зависимость «доза-эффект» прослеживается на уровне каждого, подвергающегося воздействию организма, при этом, чем больше доза, тем выраженнее реакция. Вместе с тем при действии веществ в дозах ниже определенных уровней (порогов) токсический процесс не развивается вовсе (интоксикации, транзиторные токсические реакции).
Во втором случае причинно-следственные связи между фактом действия вещества и развитием процесса носят вероятностный характер. Зависимость «доза-эффект» прослеживается только на уровне популяции: чем больше доза, тем у большей части особей испытуемой популяции регистрируется эффект. При этом вероятность формирования токсического процесса сохраняется при действии на биосистему даже одной молекулы токсиканта (беспороговый эффект), хотя у отдельных организмов эффект может не развиться даже при очень интенсивных (смертельных) воздействиях (мутагенез, канцерогенез, тератогенез).
В этой связи и количественные характеристики риска определяются в соответствии с двумя операционными схемами.
Для химических веществ с определенным порогом токсического действия оценка риска сводится к определению отношения ЭД к РД и т.д. Эти соотношения и называются «индекс опасности».
Порядок расчета индекса опасности, связанной с действием вещества, осуществляется следующим образом:
Индекс опасности = ЭД/РД,
Если индекс опасности выше 1, имеется риск связанный с действием токсиканта.
За рубежом, для веществ, вызывающих беспороговые эффекты (канцерогенез и др.), риск выражают как вероятностную величину. В частности для оценки риска канцерогенеза используют «фактор канцерогенной активности вещества». Эта величина определяется с помощью расчетных методик на основе экспериментального материала и представляет собой угол наклона зависимости между величинами вероятности развития новообразования и действующей дозы токсиканта (q). Результат умножения величины ХЕП (см. выше) на q дает безразмерную величину риска развития новообразования. Если эта величина превышает установленный уровень, воздействие признается опасным.
Порядок расчета опасности воздействия веществ, связанной с развитием беспороговых эффектов, осуществляется следующим образом:
Методика оценки опасности может быть упрощена, при условии, что безопасные концентрации вещества уже известны. В этом случае величину ХЕП просто сравнивают с величиной ВБД. Если ХЕП больше, это свидетельствует о превышении допустимого содержания вещества, установленного законодательством.
Целью определения риска иногда являются числовые характеристики вероятности развития определенных неблагоприятных эффектов, например фиброза легких, хронической печеночной недостаточности, новообразования, смерти и т.д.
3. Процесс оценки риска
Из-за большого разнообразия условий и свойств токсикантов не возможно создать единый сценарий, позволяющий оценивать риск всех химических веществ во всех возможных ситуациях. Существует методология поэтапного решения задачи, в соответствии с которой можно провести полный анализ различных случаев. Она включает четыре элемента:
Каждый из этих элементов имеет непосредственное отношение к важнейшим характеристикам, определяющим риск от воздействия токсикантов:
— наличия опасных токсикантов в окружающей среде;
— судьбы токсиканта в окружающей среде;
— способа воздействия на организм;
— токсикологических свойств вещества;
— характеристики популяции, на которую действует токсикант;
— вероятности ожидаемого риска для здоровья.
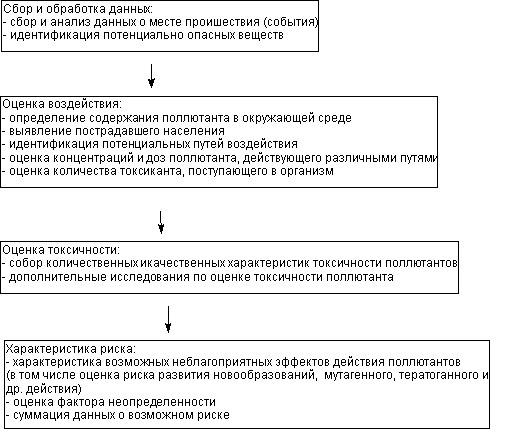
Общая схема алгоритма оценки риска представлена на рисунке 1.
Рисунок 1. Алгоритм оценки риска действия токсиканта
В ходе этого этапа определяют, какие вещества оказывают воздействие на организм, пути их поступления в окружающую среду, обладают ли они потенциальной способностью вызывать неблагоприятные эффекты в организме (в том числе канцерогенное, мутагенное и иные), изменять среду обитания.
Все доступные данные по токсикантам собираются, систематизируются и используются для оценки токсического потенциала веществ. Если в среде присутствует большое количество токсикантов возможно выбрать для анализа некое вещество-индикатор загрязненности.
В ходе работы желательно выявить часть населения с повышенной чувствительностью к ксенобиотику. Необходимо тщательно проанализировать пути поступления токсиканта в организм.
В результате получают данные, позволяющие оценить количество вещества, поступающего в организм в течение длительного и пожизненного воздействия:
Третий этап исследования состоит в установлении зависимости «доза-эффект» для изучаемых веществ. Конечная цель этого этапа работы заключается в установлении уровня доз, при которых появляются неблагоприятные эффекты от действия токсиканта на организм. Если эти характеристики уже найдены, но не утверждены законодательно, исследования могут быть продолжены в требуемом объеме. Если данных нет, можно попытаться получить ориентировочные значения токсичности веществ, прибегая даже к расчетным методам. Наконец, рекомендуемая доза может быть определена путем деления установленной в иных исследованиях пороговой дозы на фактор безопасности.
Фактор безопасности является своеобразным допущением, учитывающим неполноту или недостаточность наших знаний о токсичности вещества. Фактор безопасности иногда устанавливается на основе данных, доступных для анализа (таблица 2).
Таблица 2. Величины фактора безопасности, используемые при оценке риска и установлении допустимого уровня воздействия токсиканта
Фактор безопасности
Критерии выбора величины
Экстраполяция доз, полученных в результате анализа эффектов, развивающихся при длительном воздействии токсиканта на ограниченную группу лиц; позволяет обезопасить часть населения, с повышенной чувствительностью к химическим веществам
Дополнительное десятикратное снижение допустимого уровня действующих доз, если осуществляется экстраполяция данных, полученных в хроническом опыте на экспериментальных животных
Дополнительное снижение величины, если экстраполируемые данные получены в остром и подостром опыте на экспериментальных животных
Суждение научной общественности может быть использовано для дополнительного снижения допустимого уровня действующих доз с целью коррекции неопределенности, обусловленной другими факторами, не указанными в предыдущих графах
Если вещество проявляет свойства канцерогена в документе должно быть представлено значение риска развития новообразований в конкретных условиях, т.е. указано, какое количество дополнительных случаев новообразований возникнет в популяции, на которую действует (или действовал) токсикант, в сравнении с контрольной группой.
4. Недостатки методологии оценки риска
Методология оценки риска была разработана как инструмент принятия решения административными органами, на основе данных о возможном ущербе здоровью, наносимом оцениваемым фактором. Определенная надежность получаемых результатов обусловлена использованием экспертами научно обоснованных данных. Однако, поскольку значительная часть информации, необходимой для анализа, остается неоцененной и используемые модели не всегда верифицированы, достоверность результатов страдает, т.е. процесс оценки риска всегда сопряжен с некоторыми неопределенностями, связанными с неполнотой наших знаний о механизмах и характере токсического действия веществ.
Каждый этап оценки риска предполагает формирование определенных выводов при отсутствии исчерпывающей информации, необходимой для этого. В этой связи основные недостатки методологии оценки риска связаны с необходимостью принятия большого числа допущений (экстраполяции данных, моделирования ситуации и т.д.), что сказывается на точности формулируемых выводов.
Существует четыре основных источника появления неопределенности в методологии оценки риска:
— влияние свойств и особенностей окружающей среды на эффекты, вызываемые токсикантами;
— допущения в процессе установления зависимости «доза-эффект»;
— допущения при определении токсикокинетических параметров ксенобиотика;
— неопределенность, обусловленная переходами от одного этапа исследования к другому.
Для правильного отношения к результатам исследования необходимо иметь представление о причинах и механизмах появления неопределенности в процессе оценки риска.
Необходимость экстраполяции диктуется объективными причинами. Так, оценка токсичности осуществляется в опытах на лабораторных животных. Вместе с тем хорошо известны видовые различия чувствительности к токсикантам (таблица 3).
Для достоверного выявления «слабых» токсических эффектов вещества, действующего в малых дозах, порой необходимо проведение эксперимента на тысячах лабораторных животных. Ни физически, ни экономически это не осуществимо. Поэтому обычно исследование проводится с использованием высоких доз токсикантов, что позволяет получить статистически значимые результаты. Однако затем необходим этап обратной экстраполяции. Существует несколько математических моделей экстраполяции данных, полученных в опытах с высокими дозами веществ на малые, но отсутствует информация, какая из этих моделей адекватно характеризует процесс, или даже на сколько реальны они все. Эти модели хорошо (и главное практически одинаково) описывают зависимость «доза-эффект» при относительно высоких уровнях воздействия, но при слабых воздействиях, выявляются существенные различия между ними. Причем, чем к более малым дозам экстраполируются результаты, тем больше вероятность расхождений. В рамках существующего знания отсутствует возможность экспериментальной верификации этих моделей.
Неопределенности, возникающие при использовании для оценки риска данных, полученных в ходе эпидемиологических исследований, рассмотрены в соответствующем разделе книги.
Многие данные, полученные в эксперименте, не могут быть надежно использованы в процессе оценки риска. Так, целый ряд характеристик токсичности веществ получен в условиях, совершенно не соответствующих тем, для которых оценивается риск. Вместе с тем проявления токсического действия, как правило, существенно зависят от условий проведения эксперимента. Дозы, примененные экспериментатором для оценки токсических свойств ксенобиотика, могут существенно отличаться от тех, в которых токсикант действует на организм в реальных условиях. Естественно и последствия этого воздействия могут быть совершенно иными.
4.3. Различия в механизмах токсического действия
Особенности механизмов токсического действия веществ могут иметь решающее значение для выбора методологии оценки риска действия ксенобиотиков. Так, принято выделять две группы канцерогенов: взаимодействующие с ДНК (генотоксическое действие) и не взаимодействующие с ДНК (эпигенетическое действие). Современные теории, описывающие химический канцерогенез, выделяют три этапа развития опухоли: инициацию, промоцию, экспрессию. Инициаторы и промоторы с известными допущениями могут быть охарактеризованы соответственно как генотоксиканты и эпигенотоксиканты. Вещества, относящиеся к первой группе действуют по беспороговому принципу, в то время, как эпигенотоксиканты могут быть охарактеризованы соответствующим пороговым значением доз. Методология оценки риска для таких веществ, принципиально различна (см. выше). Однако далеко не для всех канцерогенов установлен механизм их действия. Существующая методика оценки риска действия канцерогенов не учитывает различий механизмов их действия.
Методология расчета риска имеет дело с «типичным» человеком, но хорошо известно, на сколько реальные люди отличаются от воображаемого стандарта. Определяемые значения коэффициентов риска рассчитаны на применение в популяции. Однако выраженность ответных реакций индивидов, составляющих популяцию, на токсикант, как ожидается, должна подчиняться закону нормального распределения. В этой связи установление единого индекса опасности для всей популяции приводит к «ущемлению интересов» лиц, чувствительность которых к ксенобиотику выходит за рамки «обычной» с позиции современной статистики (группа лиц с высокой чувствительностью). Таким образом, усреднение коэффициентов риска, использование наиболее вероятных значений этой величины приложимы только к популяции в целом и представляют собой значительные допущения, рождающие неопределенность, при использовании их применительно к конкретному человеку.
В последнее время в токсикологических лабораториях часто используют инбредных животных. Получаемые в этом случае результаты варьируют не в столь широких пределах, как в реальной генетически гетерогенной популяции, каковой, в частности, является популяция людей. Используя такие данные, исследователь может допустить ошибку в отношении возможного риска для тех подгрупп населения, чувствительность которых к токсиканту особенно велика.
4.5. Неопределенность при оценке воздействия
4.6. Неопределенность, связанная с комбинированным действием токсикантов
В реальных условиях люди не подвергаются изолированному воздействию какого либо одного химического вещества. Как правило, действуют смеси соединений самого различного состава. Естественно, в лабораторных условиях, с целью получения количественных характеристик токсичности, никогда не удастся воспроизвести все эти бесконечные смеси. А вместе с тем вопрос о том, каков эффект данной комбинации ксенобиотиков, каковы характеристики коергизма компонентов смеси (синергизм или антагонизм) является чрезвычайно важным. В настоящее время существующая методология оценки риска не позволяет решить эту проблему, основываясь на научных представлениях. Существующие методы оценки путем простого суммирования действующих доз ксенобиотиков, составляющих смесь, имеют отчетливый механистический характер.
ОЦЕНКА РИСКА УГРОЗЫ ЗДОРОВЬЮ ПРИ ВОЗДЕЙСТВИИ ПОРОГОВЫХ ТОКСИКАНТОВ
Все четыре величины измеряются количеством загрязнителя, поступающего в единицу времени в организм человека или животного и нормированного на единицу массы тела. Обычно количество токсиканта измеряется в миллиграммах, единицей времени служит день (сутки), а единицей массы тела — килограмм; следовательно, размерность перечисленных величин — мг/(кг • сут).
Оптимальное согласование экспериментальных данных и результатов наблюдений над группами риска означает, что имеется достаточная информация по всем перечисленным выше факторам. Однако на практике такое согласование обеспечить не удается. Поэтому приходится вводить коэффициенты неопределенности, которые играют роль своеобразного «запаса надежности» в процессе вычисления мощности дозы. Обычно
используют три коэффициента: Fv /•’, и F3, на их произведение делят величину пороговой мощности дозы:

где //Л|,() — любое из представленных выше значений пороговой мощности дозы, a HD — ее скорректированное значение.
Коэффициент Fj используется для учета возможных межвидовых вариаций в проявлении эффектов от одной и той же мощности дозы, т. е. он характеризует межвидовые различия в чувствительности к токсиканту. Если биокинетические особенности токсиканта и механизмы его токсичности у экспериментальных животных и людей различаются сильно, то коэффициенту F, приписывают максимальное значение, равное 10. Если биокинетика и механизмы токсичности у экспериментальных животных и людей схожи, то /у
Коэффициент F2 ответствен за внутривидовые различия в действии токсиканта, которые обусловлены индивидуальной чувствительностью. Его значения могут меняться от 1 до 10; также обычно полагают F2 = 1 (если существенные индивидуальные различия в чувствительности к данному токсиканту не выявлены).
Коэффициент F3 повышает надежность расчетов, связанных с переходом от сравнительно кратковременных наблюдений к оценкам эффектов на значительно больший период времени. Значение этого коэффициента может варьировать от 10 до 100. Когда требуется оценить j
данные только по кратковременным экспериментам, то полагают F3 = 10.
симальное значение f3=iuu.
Таким образом, введение коэффициентов неопределенности Fv Г’2 и F3 существенно снижает значение пороговой мощности дозы, что обусловлено влиянием ряда неопределенностей. Максимальное значение произведения коэффициентов F< ¦ F, • F3 = 10 • 100 • 10- 104.
Можно сказать, что эти коэффициенты выполняют роль факторов перестраховки, так как в расчеты риска будут входить намеренно заниженные значения пороговой мощности дозы. Например, для тетраэтилсвинца в результате опытов с животными было получено значение.
0,0012 мг/кг-сут. Но из-за несовершенства условий экспериментов коэффициентам неопределенности пришлось приписать наибольшие значения, поэтому скорректированное значение пороговой мощности дозы Нп при поступлении этого токсиканта с водой или пищей составило
В случае другого токсиканта — фенола—выполненные эксперименты характеризовались существенно меньшей неопределенностью, произведение ¦ F\ ¦ 1’\ оказалось равным 100. Поскольку значение HN0AEL было при поступлении фенола с водой или пищей равно 60 мг/кг ¦ сут, скорректированное значение пороговой мощности дозы HD составило 60:100 = 0,6 мг/кг ¦ сут.
Единица мощности пороговой дозы — мг/кг • сут—связана с зависимостью воздействия поступающего в организм токсиканта от массы тела. Перед тем, как зафиксировать значение этой дозы для людей, проводятся опыты на животных, причем используются, как правило, несколько групп животных, для каждой из них принимается средняя величина массы тела. Часто объектами таких опытов становятся мыши, крысы, морские свинки и кролики.

Значения пороговой мощности дозы Нп при поступлении — некоторых токсикантов-неканцерогенов с воздухом, водой и пищей приведены (в порядке убывания пороговой мощности дозы) в табл. 4.10-4.12.