что означает пострегистрационное наблюдение
Значение проведения пострегистрационных клинических исследований
Пострегистрационные исследования лекарственных препаратов являются важным жизненным этапом любого медикамента даже несмотря на то, что регулятор не считает их обязательными. Главная цель проведения подобных испытаний — это обеспечение полноценного сбора дополнительной информации, связанное с выяснением эффективности и безопасности медицинского препарата на довольно большой популяции, в реальных условиях и на протяжении длительного времени. Для того чтобы обеспечить однородную выборку, клинические исследования проводятся на ограниченный популяции, исходя из довольно жестких критериев отбора, что в некоторых случаях не позволяет до регистрации качественно оценить поведение препарата у пациентов, имеющих различные сопутствующие заболевания или принимающих другие лекарства.
Учитывая ограниченное число людей, проходящих клинические исследования на этапе дорегистрационного изучения лекарственного средства, очень редко встречающиеся побочные эффекты могут оказаться незарегистрированными по причине того, что у конкретных добровольцев они не встретились, однако это не означает, что при более широком, массовом употребления, какие-либо противопоказания не проявятся. Увидеть их и идентифицировать по всем параметрам можно только тогда, когда препарат уже выйдет на рынок и будет использоваться большим количеством пациентов.
Как только лекарственное средство поступает на реализацию, за ним начинают тщательно следить специалисты в стремлении оценить и изучить самые важные параметры терапии медикамента, его взаимодействие с остальными препаратами и воздействие на организм пациента при длительном использовании либо наличии заболевания других систем и органов.
Дополнительно проводится анализ эффективности применения у людей различного возраста с выявлением редких побочных эффектов и др. Все перечисленные данные спустя некоторое время вносятся в инструкцию по применению медикамента в определенном порядке, который подробно обозначен на https://www.oct-clinicaltrials.com/ru/services/drug_registration_russia.php.
Кроме того, в пострегистрационном периоде могут обнаружиться и новые положительные качества препарата, которые далее потребуют дополнительных клинических испытаний и могут выступить в качестве основы для расширения показаний исследуемого лекарственного средства.
Если в препарате таким образом будут обнаружены ранее неизвестные, но являющиеся опасными побочные эффекты, то его использование может быть ограничено, а регистрация приостановлена или отозвана вовсе.
Пострегистрационные клинические исследования
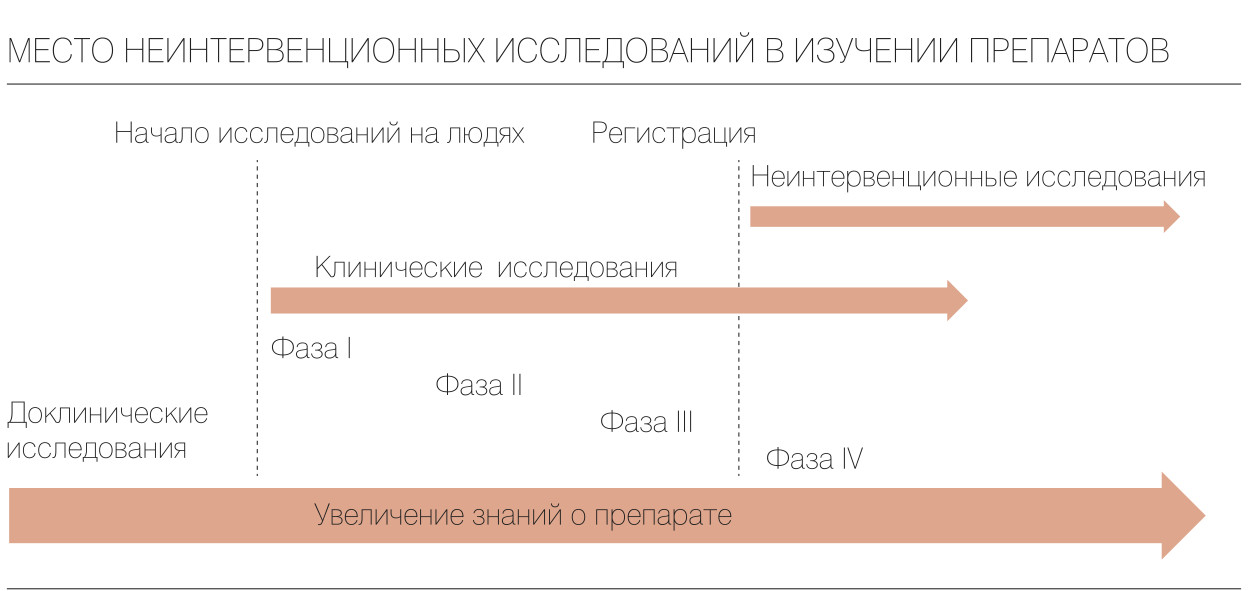
Пострегистрационное клиническое (интервенционное) исследование (post-authorization clinical trial) – это клиническое исследование лекарственного препарата для медицинского применения, проводимое производителем лекарственного препарата, гражданский оборот которого осуществляется после государственной регистрации, в целях дополнительного сбора данных о его безопасности и эффективности, расширения показаний к применению данного лекарственного препарата, а также выявления нежелательных реакций пациентов на его действие. Так же их иногда называют IV фазой клинических исследований.
Целями пострегистрационных исследований являются оценка безопасности и действенности (efficacy) лекарственного препарата.
Различие между III и IV фазой клинических исследований не всегда очевидно. Многие исследователи, проводящие клинические исследования сердечно-сосудистых, онкологических заболеваний или ВИЧ-инфекции, называют свои сравнительные исследования III фазой исследований, независимо от наличия регистрации препарата. Тяжёлые больные (например, СПИДом или поздними стадиями злокачественных новообразований) иногда могут получить препарат ещё до его регистрации. Такие процедуры должны использоваться для проведения клинических исследований, решающих научные проблемы. Несмотря на то, что они проводятся до регистрации нового препарата, имеют много общего с клиническими исследованиями IV фазы. Новые препараты для лечения угрожающих жизни заболеваний также могут регистрироваться по ускоренной процедуре регистрации, в которой разрешение на применение выдаётся на основании ограниченного количества данных при условии получения в дальнейшем дополнительных данных в рандомизированных контролируемых исследованиях. Эти последующие исследования, хотя и проводятся после регистрации нового препарата, имеют много общего с исследованиями в рамках III фазы испытаний. В действительности, этот процесс ускоренной регистрации по сути ближе к процедуре регистрации противоопухолевых препаратов, которая осуществляется на основании результатов II фазы исследований, а III фаза проводится для установления лучшей стандартной терапии после выхода препарата на фармацевтический рынок.
Цели IV фазы клинических исследований
Вообще говоря, клинические исследования IV фазы предназначены для расширения знаний о действенности лекарственного препарата и подтверждения его безопасности при применении после регистрации в более широкой популяции больных, получающих обычное медицинское лечение.
Изучение действенности. Хотя эффективность препарата устанавливается в I-III фазах испытаний с участием ограниченного количества больных, после поступления в продажу его действенность в более крупной популяции остаётся неизвестной. В таблице 1 кратко определяются понятия действия, активности, эффекта и эффективности препарата.
Таблица 1
Основные задачи разных типов исследований
Показатели
Задачи
Тип исследования
Биологическое влияние препарата на целевую систему
Доклинические и начальные клинические исследования (I-II фазы)
Клиническое действие препарата в строго определенной группе больных
Клинические исследования (II-III фазы)
Общая эффективность препарата в большой популяции
Поздние клинические исследования (IV фаза)
В III фазе клинических исследований, проводимых с целью регистрации препарата, обычно участвует тщательно отобранная группа больных, и их результаты не переносятся автоматически на население в целом. И наоборот, клинические исследования IV фазы включают более широкую группу больных, лучше отражающую реальности клинической практики. Особый случай – это пожилые больные, которых обычно исключают из III фазы клинических исследований, но которые потребляют примерно 25% всех лекарств.
Другой целью IV фазы является изучение относительной значимости новых препаратов по сравнению с уже имеющимися. Как указано в таблице 1, роль I-III фаз испытаний заключается в подтверждении биологического действия и клинической активности препарата, поэтому его необходимо сравнивать с плацебо или с нелечеными больными. Наоборот, клинические исследования IV фазы предназначены для подтверждения эффекта, поэтому его нужно сравнивать с альтернативными средствами лечения рассматриваемого заболевания.
Третьей целью IV фазы является проверка предположений и вопросов, которые не могут быть изучены до регистрации препарата из-за малого количества больных и ограниченного времени до подачи заявки на регистрацию. К таким вопросам относятся:
Некоторые считают, что самой важной целью IV фазы является внедрение нового препарата в повседневную клиническую практику. Часто в основе этого лежит чисто коммерческая задача. Действительно, некоторые лекарственные препараты могут недостаточно широко применяться, если врачи не убеждены в их преимуществах. Так некоторые крупные исследования хорошо известных препаратов были проведены с единственной целью – убедить скептически настроенных врачей применять их. Ярким примером таких исследований является крупномасштабное исследование применения стрептокиназы и аспирина при остром инфаркте миокарда, которое было проведено после того, как данные о благоприятном эффекте стрептокиназы были получены в перекрёстном анализе нескольких ранее проведённых исследований. Несмотря на имеющиеся данные, стрептокиназа рутинно не применялась, и некоторые эксперты даже считали её опасной. Такая ситуация встречается нередко, так же, как и противоположная ситуация, когда клинические эксперты продолжают рекомендовать неэффективный или потенциально опасный препарат.
Маркетинговая цель не должна использоваться при проведении пострегистрационный клинических исследований IV фазы.
Изучение безопасности. I-III фазы клинических исследований дают скорее предварительные данные, чем подтверждение безопасности препарата. Частые или ожидаемые нежелательные реакции (НР) в них хорошо документируются, а редкие или непредвиденные нежелательные реакции (ННР) могут быть выявлены только при лечении большого количества больных.
Простое правило гласит, что если N больных получили лечение, и какой-либо НР не обнаружено, то частота этой НР меньше 3/N с вероятностью 95%. Поэтому для исключения с разумной достоверностью того, что какая-то НР происходит с частотой 1/1000, лечение должны получить 3000 больных. К моменту регистрации нового препарата такого количества больных почти никогда не набирается.
Клинические исследования IV фазы предоставляют идеальные условия для изучения безопасности нового лекарственного препарата. Поскольку они имеют соответствующий контроль и тщательно мониторируются, то такие исследования дают более точные данные о безопасности, чем любой метод регистрации спонтанных сообщений о НР (сигналы, описания клинических случаев, скрининг литературы и т.д.). В частности, при расчёте истинной частоты той или иной НР лекарственного препарата числитель (количество больных, получивших лечение) бывает точно известен в проспективном исследовании, но неизвестен или приблизительно известен в других ситуациях (например, если аппроксимируется количество реализованных доз препарата).
Схема исследования
Рандомизация. Самым важным аспектом клинических исследований IV фазы является то, что они должны проводиться по строгим принципам статистического анализа. Это не означает автоматически, что они должны быть рандомизированными, но вопрос о рандомизации следует серьёзно рассмотреть во всех случаях, когда она этически оправдана. Правильно рандомизированные исследования достаточного масштаба редко оказываются неспособными дать надёжный и определённый ответ на поставленный вопрос, даже если они очень простые. Публикация их результатов может оказать существенное влияние на медицинскую практику. Наоборот, не рандомизированные исследования, например, с применением вопросников, редко дают надёжный ответ, даже если они очень сложные. Тем не менее, на практике проводится большое количество не рандомизированных клинических исследований IV фазы с единственной целью – дать возможность врачам получить опыт применения препарата. Хотя такая цель может быть желательной, она относится не к клиническим исследованиям, это маркетинговые исследования – то есть направленные на получение информации о рынке, а также на изучение поведения и представлений потребителей и заинтересованных лиц на таком рынке.
Необходимо чётко различать исследования, направленные в основном на оценку эффективности, и исследования по фармаконадзору, направленные исключительно на контроль безопасности. Рандомизация может проводиться при обоих типах исследований, но в последнем случае её роль меньше.
Большое количество субъектов. Одной из целей клинических исследований IV фазы является изучение эффективности препарата, применяемого в реальной клинической практике. Это означает, что количество субъектов таких исследований должно быть достаточно большим, чтобы дать ответы на интересующие вопросы с разумной определённостью. В действительности, эффективность новых препаратов в клинических исследованиях IV фазы может быть ниже, чем в III фазе, из-за того, что в IV фазе могут участвовать больные, менее чувствительные к препарату, условия лечения больных могут контролироваться менее строго, могут участвовать менее опытные исследователи и т.д. Объём выборки в клинических исследованиях IV фазы IV должен учитывать все эти аспекты.
Зачастую необходимое количество больных для ответа на поставленный вопрос, трудно найти в одной стране, имеющимся количеством исследователей или с имеющимся бюджетом исследования. Такая ситуация может потребовать упрощения некоторых аспектов исследования, но она никогда не должна быть причиной выбора неоптимальной схемы исследования.
Небольшое рандомизированное исследование лучше, чем не рандомизированное или отсутствие исследования вообще.
Для объединения результатов нескольких исследований, каждое из которых по отдельности слишком мало для получения ответа на интересующий вопрос, может проводиться перекрёстный анализ. Иногда крупномасштабное исследование трудно провести по практическим (а не по научным) соображением; в этом случае лучше всего будет провести несколько мелких исследований того же вопроса, и запланировать проспективный перекрёстный анализ получаемых результатов.
Широкие критерии включения. Одной из основных целей клинических исследований IV фазы является изучение эффективности препарата в широкой популяции больных. Это означает, что критерии включения больных в такие исследования более свободные, чем в III фазе. Как правило, строгие критерии пригодны для клинических исследований III фазы, а широкие критерии – для IV фазы. Из клинических исследований IV фазы не следует исключать никаких больных, за исключением случаев появления проблем с безопасностью препарата или при наличии надёжных оснований для отбора определённой субпопуляции больных. Решение о включении больного в клиническое исследование IV фазы лучше всего оставить на усмотрение лечащего врача, а не определять длинным списком критериев включения и исключения. В конечном итоге, единственным необходимым критерием «пригодности» является то, что врач должен быть не уверен в благоприятном эффекте любого из изучаемых лекарств.
Активный контроль и исследования эквивалентности. Для получения разрешения на применение многие новые препараты необходимо сравнивать с плацебо, даже если для данного заболевания уже существуют другие средства лечения. Однако задача заключается не в том, чтобы показать, что препарат оказывает такое же действие, как плацебо, а в том, чтобы доказать превосходство препарата перед имеющимися средствами лечения. Поэтому важное значение имеют клинические исследования IV фазы с «активным контролем», которые не требуются для регистрации препарата, но важны для медицинской практики.
Когда в исследованиях используется активный контроль, часто бывает интересно доказать, что препарат обладает такой же (а не более высокой) эффективностью, чем контроль, и в этом случае исследования называются исследованиями эквивалентности (или эквивалентности с активным контролем). Такие исследования необходимы в тех случаях, когда новый препарат вряд ли будет более эффективен, чем стандартная терапия, но может иметь лучшие показатели безопасности или более практичен в применении или более дёшев, и поэтому может заменить стандартные препараты в повседневной клинической практике. Исследования эквивалентности таких новых препаратов в рамках IV фазы тоже имеют большое значение.
Требования Надлежащей клинической практики
Пострегистрационные клинические исследования IV фазы подпадают под действие правил Надлежащей клинической практики (GCP).
Основные понятия
Российское и международное законодательство, подзаконные акты и стандарты фарминдустрии
Что означает пострегистрационное наблюдение
Зачем проводят пострегистрационные исследования?
После доклинических исследований на животных каждый препарат проходит клинические испытания, чтобы получить разрешение на государственную регистрацию.
Успешно пройдя исследования, которые требуют регуляторные органы, лекарственное средство выходит на рынок, и компания-производитель занимается лишь продвижением своего продукта. При этом сохраняется необходимость в получении информации о результатах применения ЛС в рутинной клинической практике, в уточнении профиля рисков препарата, в изучении его взаимодействия с другими назначаемыми пациенту лекарственными средствами. Такие данные пришлось бы собирать долгие годы, если бы не велись неинтервенционные исследования, которые могут предоставить нужные сведения об использовании препарата в массовом порядке.
Неинтервенционные исследования лекарственных препаратов могут проводиться компаниями-производителями или научными коллективами в рамках проведения научно-исследовательских работ. Несмотря на то что эти исследования имеют важное медико-социальное значение, далеко не каждый производитель препарата готов оправдать доверие своих потребителей и выступить в качестве инициатора и спонсора такого рода исследований, так как этого не требуют регуляторные органы, а продукт уже выведен на рынок. Но в чем же научная значимость и преимущества наблюдательных исследований?
Неинтервенционные исследования – исследования без вмешательств, т.е. лекарственное средство назначается врачом обычным способом в соответствии с инструкцией к препарату. Применение препарата в реальной жизни, в рутинной клинической практике и в рамках разрешенной терапии предоставляет наиболее достоверные данные об эффективности и безопасности ЛС. Также появляется возможность оценить отношение пациентов к схеме приема и самому препарату, что более точно отражает результаты исследования.
В регистрационных клинических исследованиях эффективность изучаемого препарата определяется на пациентах, которые были выбраны согласно строгим критериям включения. Неинтервенционные исследования позволяют изучить ЛС на большой популяции пациентов без возрастных ограничений, что нивелирует фактор случайности при изучении вариаций оцениваемых параметров. В том числе дается возможность изучения эффективности и безопасности препарата у пациентов с сопутствующими заболеваниями и патологиями. Также необходимо учитывать, что сроки наблюдения за пациентами определяются спонсором исследования, поэтому за больными можно наблюдать длительное время, соответственно легче отследить процесс лечения по некоторым дополнительным параметрам, например по сезонности заболевания.
Еще одна ключевая особенность неинтервенционных исследований – возможность оценить использование в комплексной терапии, т.е. в сочетании с другими лекарственными средствами и процедурами, что не предусматривается в клинических исследованиях. Это позволяет собрать не только информацию о конкретном препарате, но и проследить течение заболевания и оценить существующие методики лечения. Также в пострегистрационном периоде могут быть обнаружены и новые положительные свойства препарата, которые в дальнейшем потребуют дополнительных клинических исследований и могут стать основой для расширения показаний для лекарственного средства.
Для реальной клинической практики огромное значение имеет комплаентность пациента, т.е. приверженность пациента к лечению, на которую напрямую влияют факторы информированности, скорости ожидаемого эффекта и удобства приема лекарственного препарата. Неинтервенционные исследования позволяют наладить обратную связь с пациентами: получить оценку назначаемой терапии, соблюдения курса лечения и определить степень удовлетворенности лекарственным препаратом.
Примером того, как компания-производитель ЛС сама инициирует и проводит пострегистрационное исследование для подтверждения эффективности, безопасности своего препарата и получения новых данных о течении заболевания, является международное многоцентровое проспективное когортное наблюдательное исследование «Лечение ОРВИ и гриппа в рутинной клинической практике» (FLU-EE). Результаты этого проекта уже вызвали интерес у профессионального сообщества, так как данные, полученные в исследовании FLU-EE, позволяют более точно прогнозировать течение и исход ОРВИ, улучшить результаты лечения и повысить качество жизни пациента в целом. Неинтервенционное исследование компании «Ниармедик» не только подтвердило эффективность и безопасность противовирусного препарата «Кагоцел», но и предоставило новые научные и статистические данные, которые крайне важны для понимания течения гриппа и ОРВИ, а также анализа применяемых в повседневной клинической практике схем терапии.
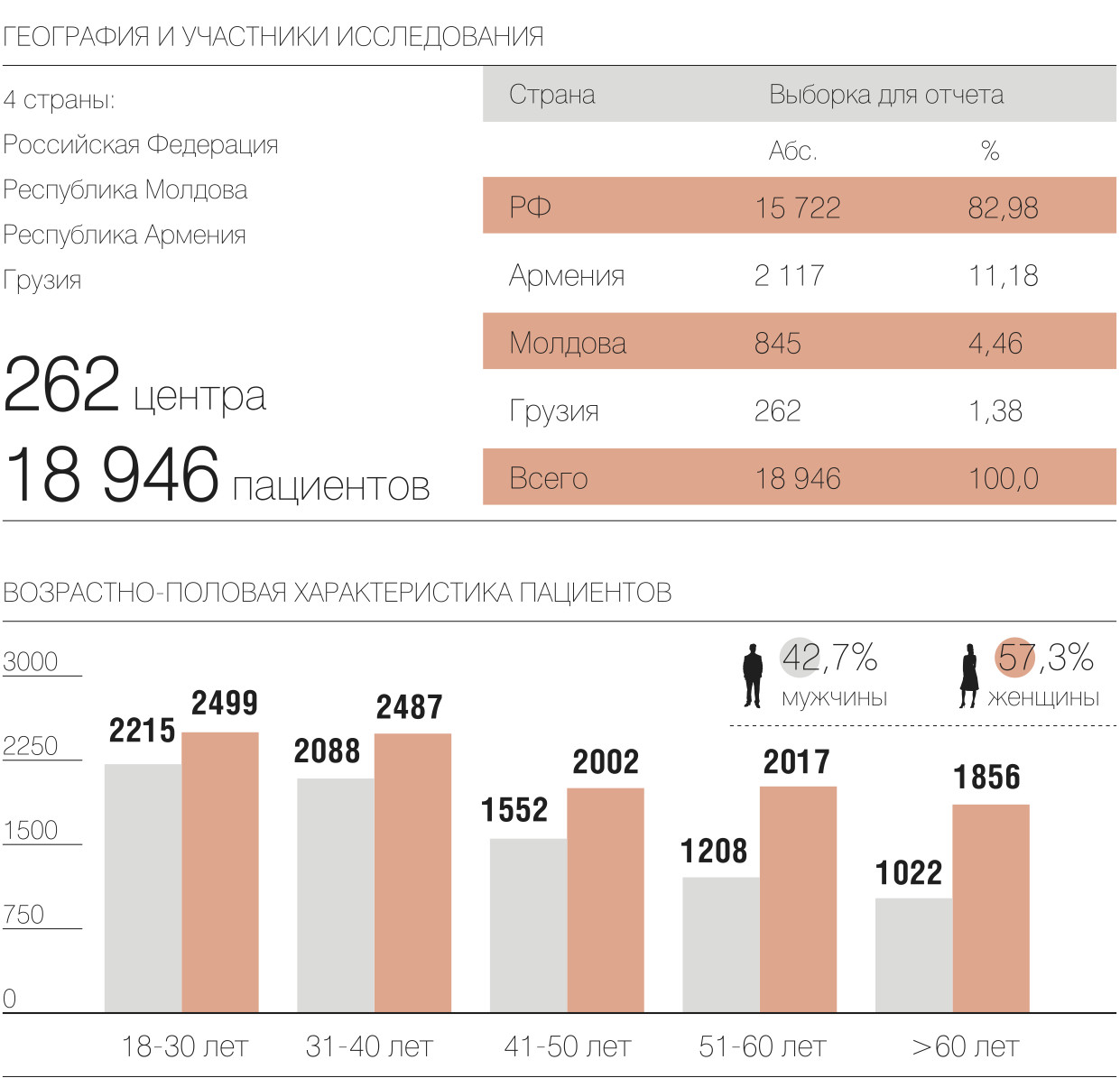
В исследовании FLU-EE приняли участие 18 946 пациентов в возрасте от 18 до 93 лет с установленными диагнозами ОРВИ и грипп. Компания сотрудничала с 262 медицинскими центрами России, Молдовы, Армении и Грузии. Врачами-исследователями стали специалисты первичного звена, терапевты, семейные врачи и врачи общей практики. К проекту также привлекли специалистов из Первого МГМУ им. И. М. Сеченова, которые проводили статистическую обработку данных и их клиническую интерпретацию.
В исследовании FLU-EE было предусмотрено три визита пациента к врачу, промежутки между визитами не регламентировались, и врачи придерживались принятой в каждой стране клинической практики лечения больных ОРВИ и гриппом. Общее количество получаемых пациентами препаратов на протяжении всего исследования варьировалось от 1 до 11, в среднем – 3 препарата. Наиболее часто назначали противомикробные средства для системного использования (это и противовирусные препараты, и антибактериальные) – 93,3%, а также лекарственные средства для лечения патологии дыхательной системы – 58,8%. Так как это неинтервенционное исследование, дополнительные процедуры не проводились. Врачи сами назначали необходимые, на их взгляд, препараты, в том числе и «Кагоцел».
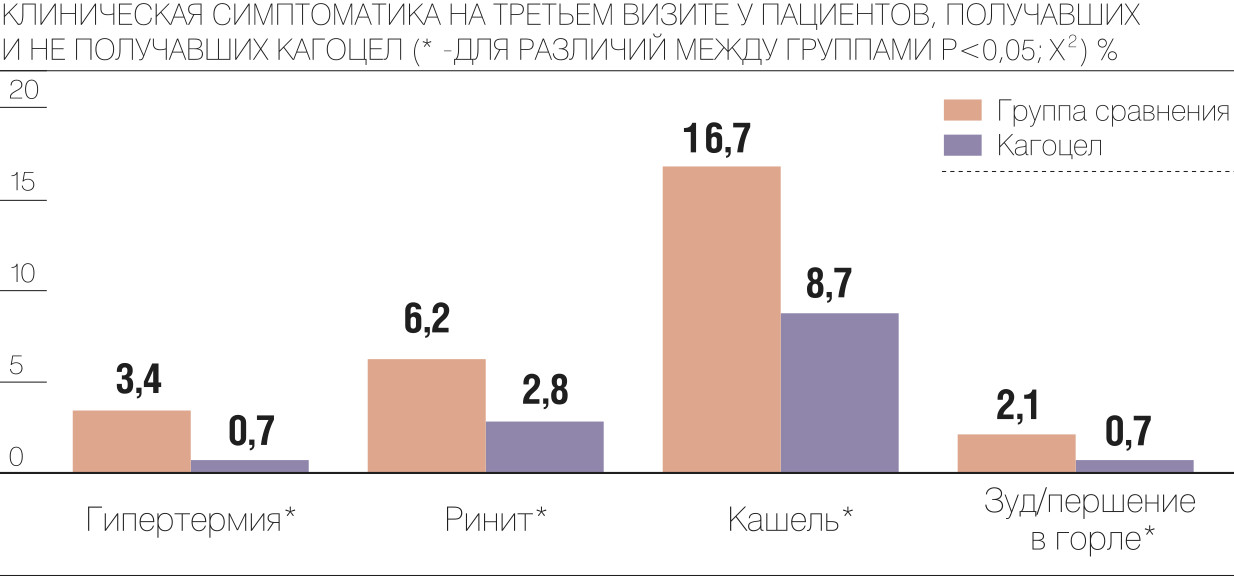
По окончании исследования для анализа результатов пациентов разделили на две группы, одной из которых в составе комплексного лечения был назначен противовирусный препарат «Кагоцел». Исследование FLU-EE доказало, что применение этого препарата в составе комплексной терапии улучшает клиническую картину заболевания: регистрировалось более быстрое купирование клинических симптомов (как интоксикации, так и катаральных) и происходила нормализация температуры, а также сокращались сроки выздоровления больных, в том числе с тяжелым течением заболевания. «Кагоцел» продемонстрировал эффективность у пациентов разного возраста и степени тяжести заболевания вне зависимости от времени назначения, в том числе при запоздалом лечении, на фоне высокого уровня безопасности.
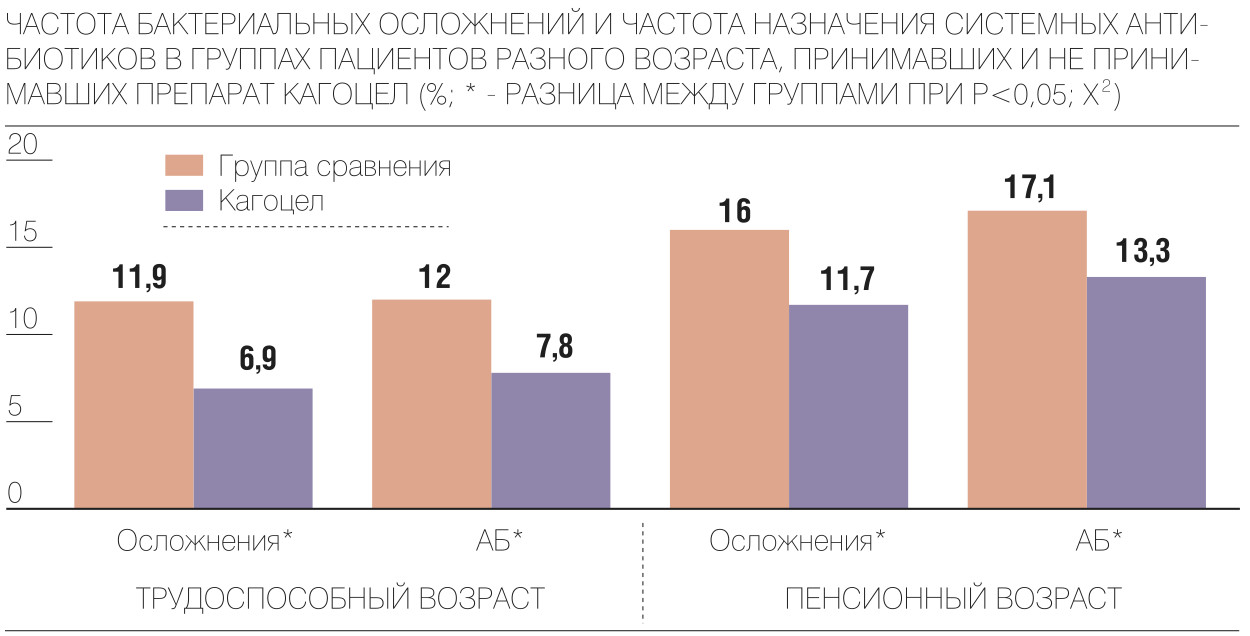
В ходе исследования FLU-EE удалось получить очень важные для специалистов данные. Например, для борьбы с бактериальными осложнениями в клинической практике используют антибиотики, но они не рекомендуются при легком и среднетяжелом течении ОРВИ, так как это грозит развитием лекарственной устойчивости возбудителей и замедлением процесса выздоровления организма. Даже возможно ухудшение исхода заболевания из-за побочных свойств антибактериальной терапии. В исследовании FLU-EE сравнили количество пациентов с зарегистрированными осложнениями и количество пациентов, которым были назначены антибактериальные препараты для терапии бактериальных осложнений, развивающихся на фоне ОРВИ и гриппа. Исследование FLU-EE наглядно показало, что антибактериальную терапию врачи рекомендовали 9,3% пациентов, при этом осложнения, действительно требующие назначения препаратов этой группы, зарегистрировали только у 8,3%. Учитывая огромный размер исследуемой популяции (почти 19 тысяч пациентов), за этим 1% разницы стоят реальные больные, т.е. такому большому количеству пациентов необоснованно прописали антибактериальную терапию. Некоторые пациенты получали антибиотики с профилактической целью. Были также зарегистрированы осложнения, которые требовали назначения антибактериальных препаратов, но пациенты не принимали их, в основном по причине добровольного отказа.
Эти данные наглядно демонстрируют, что, несмотря на растущую резистентность к антибиотикам и доказанную нецелесообразность их применения при ОРВИ, они активно рекомендуются врачами для лечения пациентов, что может ухудшить исход заболевания. Также исследование FLU-EE доказало, что «Кагоцел» в составе комплексного симптоматического лечения ОРВИ и гриппа достоверно способствует сокращению числа осложнений и, как следствие, снижает частоту назначения антибиотиков на 51%.
Кроме того, исследование показало, что применение «Кагоцела» сокращает частоту и длительность употребления жаропонижающих средств в 1,5 раза и позволяет справиться с лихорадкой нелекарственными методами. В группе «Кагоцела» существенно уменьшилась частота приема парацетамола (в 3,5 раза) и ибупрофена (в 3,7 раза), что, несомненно, положительно влияет на качество жизни пациентов и является весомым аргументом в пользу включения в комплексную терапию ОРВИ и гриппа индукторов интерферонов.
Для реальной клинической практики огромное значение имеет комплаентность пациента (приверженность пациента к лечению), на которую напрямую влияют факторы информированности, скорости ожидаемого эффекта и удобства приема лекарственного препарата, поэтому в ходе исследования была организована обратная связь с пациентами.
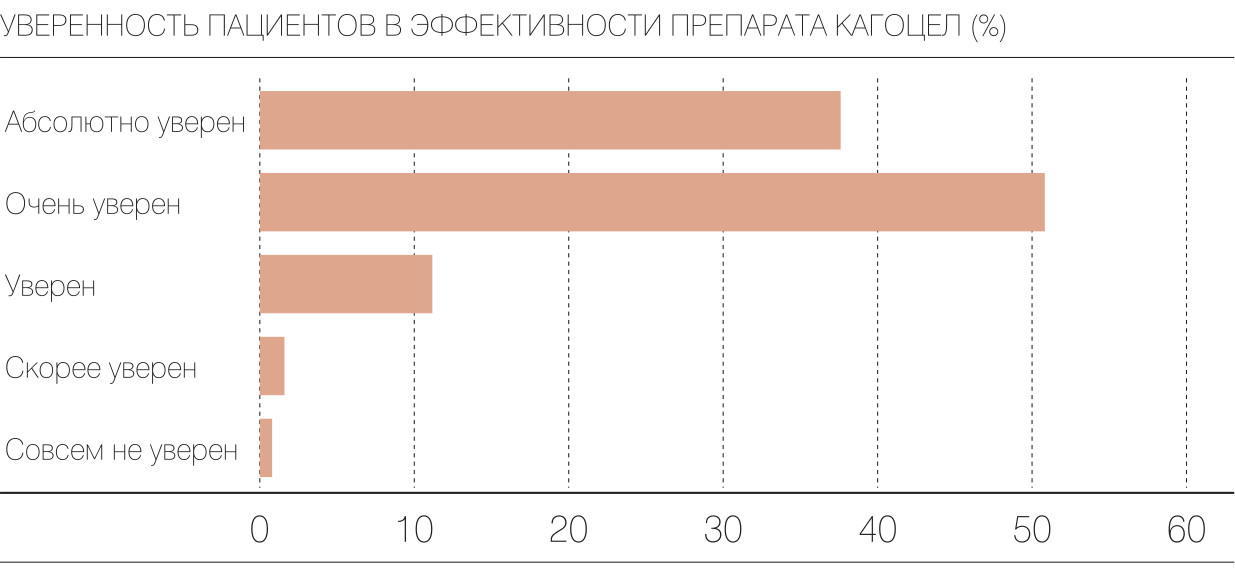
На третьем визите к врачу пациентам было предложено заполнить опросник удовлетворенности лечением TSQM (Treatment Satisfaction Questionnaire for Medication). В результате получены уникальные данные: 99% пациентов, получавших «Кагоцел», были уверены в пользе препарата. Более того, по результатам анализа субъективной оценки удовлетворенности терапией по таким параметрам, как результаты лечения, купирование симптоматики, сроки выздоровления, пациенты, которые получали в составе терапии «Кагоцел», были на 70% более довольны результатами лечения. Большинство пациентов отметили удобство формы, времени и схемы приема. Как мы видим, сами пациенты очень высоко оценивают эффективность препарата.
Доказанная эффективность в реальной клинической практике для врача, порой, может иметь большее значение, чем эффективность, показанная в ходе чистых клинических исследований. Зачастую неинтервенционные исследования, как продолжение клинических испытаний, служат единственным методом изучения редких нежелательных явлений препарата и дают максимально подробную информацию об эффективности ЛС в реальных условиях. Полученные данные в ходе исследования FLU-EE очень важны для понимания течения гриппа и ОРВИ, а также особенностей применения препарата «Кагоцел» в рутинной клинической практике. Исследование компании «Ниармедик» позволит более точно прогнозировать течение и исход ОРВИ, что, разумеется, существенно скажется на качестве жизни пациентов.
Научно доказанная безопасность
Рынки обращения лекарственных средств стран Евразийского экономического союза (ЕАЭС) объединяются и начинают работу в формате единого пространства. Создается единая фармакопея ЕАЭС. До 2025 года досье всех лекарственных препаратов стран-участниц необходимо привести в общий формат в рамках экономического союза. Компания «Ниармедик» уже сейчас начала подготовку к переходу на новый стандарт и актуализирует данные о противовирусном препарате «Кагоцел».
«Кагоцел» – противовирусный препарат компании «Ниармедик» для лечения и профилактики гриппа, ОРВИ и герпеса. Он способствует образованию в организме человека так называемых поздних интерферонов (ИНФ), которые обладают противовирусной активностью.
В настоящее время «Кагоцел» является одним из самых назначаемых в России противовирусных лекарственных средств. Эффективность и высокий профиль безопасности «Кагоцела» отмечают как врачи, так и пациенты. Несмотря на то что препарат имеет в полном объеме все необходимые для подтверждения эффективности и безопасности препарата доклинические и клинические исследования, проведенные согласно требованиям Министерства здравоохранения Российской Федерации, компания «Ниармедик» продолжает заниматься дополнительными пострегистрационными исследованиями «Кагоцела». Так как препарат разрешен к применению у детей с 3 лет, особое внимание уделяется маленьким пациентам: значительное количество научно-исследовательских работ компании «Ниармедик» посвящено изучению различных аспектов безопасности препарата на неполовозрелых животных. Вопрос репродуктивной безопасности любого лекарственного средства является важнейшим и масштабным, так как определяет развитие страны на десятилетия вперед.
Действующее вещество противовирусного препарата «Кагоцел» является продуктом химического синтеза, в котором к полимерной полисахаридной матрице (карбоксиметилцеллюлозе) ковалентно присоединены молекулы госсипола (природного полифенольного пигмента хлопчатника). В многочисленных исследованиях, проводимых в ведущих исследовательских лабораториях в различных странах мира, доказано, что в результате прочной химической связи госсипола с различными веществами по его альдегидным группам он утрачивает свои токсические свойства, но при этом сохраняется его противовирусная и иммуномодулирующая активность.
Именно этот метод был использован при разработке препарата «Кагоцел». Ковалентное связывание молекулы госсипола с полимерным носителем – карбоксиметилцеллюлозой – позволило создать эффективный и безопасный лекарственный препарат. В разработанной технологии синтеза за счет использования избытка окисленной карбоксиметилцеллюлозы и проведения многократных стадий очистки продукта обеспечивается максимально полное удаление остаточных примесей свободного госсипола в препарате.
Сейчас в мировой практике фармацевтического производства для контроля конкретной примеси рекомендуется метод высокоэффективной жидкостной хроматографии (ВЭЖХ), который позволяет проводить одновременное разделение сложных проб на составляющие их компоненты и измерение концентрации одного или нескольких соединений.
Для контроля примесей свободного госсипола в лекарственном препарате «Кагоцел» компания «Ниармедик» совместно с МГУ имени
М. В. Ломоносова разработала и валидировала собственную высокочувствительную методику ВЭЖХ, которая отвечает современным требованиям и обладает высокой чувствительностью. С помощью данного метода подтверждено, что содержание остаточных примесей свободного госсипола в препарате после изготовления, а также после хранения в течение установленного срока годности находится на уровне от 0, 0002 до 0,0030% от массы субстанции. Для сравнения: основные мировые фармакопеи установили максимальный порог, при котором необходимо строго контролировать содержание примесей в веществе при производстве лекарственных средств – 0,05%. Соответственно, такой низкий уровень содержания примесей госсипола гарантирует отсутствие неблагоприятных воздействий препарата «Кагоцел» на организм человека.
Научное подразделение компании «Ниармедик» совместно со специалистами ФИЦ Биотехнологии РАН провели исследование на предмет исключения высвобождения свободного госсипола из препарата «Кагоцел» в среде, которая имитирует физико-химические условия пищеварительного тракта. В ходе проведенных работ доказано, что содержание микропримесей свободного госсипола в среде после 24-часового инкубирования в известных стандартных имитаторах желудочного и кишечного соков не увеличивается. Более того, количество примесей госсипола уменьшается, что говорит об их деградации. Важно, что при применении препарата по инструкции поступление в организм госсипола в виде содержащихся в препарате остаточных примесей не превысит 0,0007 мг в сутки. А это практически в 10 000 раз ниже допустимой суточной дозы госсипола, поступающего с некоторыми продуктами питания (согласно постановлениям Европейской комиссии по безопасности питания для взрослого человека негативные эффекты в отношении репродуктивной сферы способны вызвать дозы, превышающие 7–8 мг в сутки).
Для очередного подтверждения этих выводов о безопасности препарата в отношении репродуктивной функции в случае его применения у детей были проведены эксперименты на животных с использованием как терапевтических доз, так и многократно их превышающих. Все дополнительные научно-исследовательские работы были проведены в ведущих научно-исследовательских учреждениях нашей страны под руководством специалистов высокой квалификации в области оценки репродуктивной функции.
В ходе экспериментов были разработаны уникальные дизайны исследований, призванные еще раз убедительно показать полную безопасность препарата для репродуктивной системы организма, в том числе для развития потомства.
В рамках исследования на тему «Экспериментальная оценка влияния препарата «Кагоцел» на генеративную функцию крыс-самцов пубертатного возраста» было доказано отсутствие токсического действия противовирусного препарата «Кагоцел» на репродуктивную систему неполовозрелых крыс-самцов ювенильного возраста. Препарат «Кагоцел» вводился в терапевтической дозе и в дозе, в 10 раз ее превышающей, ежедневно в течение 48 дней (период сперматогенеза у крыс), что не привело к статистически значимому снижению способности животных к оплодотворению и зачатию. Морфологический анализ половых желез крыс-самцов установил, что в семенниках крыс всех групп отмечалось наличие активного процесса созревания мужских половых клеток. Полученные данные подтвердили, что препарат не вызывает в мужских половых клетках генетических нарушений.
Аналогичное исследование проведено также на крысятах самого маленького возраста. «Кагоцел» в течение 12 дней вводили в инфантильном периоде развития (начиная с 10-дневного возраста, что соответствует возрасту 1–2 года у человека) в терапевтической дозе и в дозе, в 10 раз превышающей. Введение препарата в таких дозах не привело к нарушению репродуктивной функции по достижении половой зрелости: индексы фертильности (способность к оплодотворению и зачатию) крыс-самок и крыс-самцов в экспериментальных группах находились на уровне групп контроля, морфологических патологических изменений не обнаружено. Число новорожденных, один из родителей которых получал «Кагоцел», соответствует группам контроля.
Противовирусный препарат «Кагоцел» рекомендуется не только для лечения, но и для профилактики ОРВИ и гриппа, поэтому был разработан специальный дизайн эксперимента на животных, моделирующий длительный профилактический прием, например, для категории часто болеющих детей, начиная с раннего детского возраста и до периода полового созревания. В ходе эксперимента «Кагоцел» вводили неполовозрелым животным (в том числе в дозе, в 10 раз превышающей норму по инструкции) короткими курсами в течение всего периода полового созревания – это можно считать экспериментальной моделью применения препарата «Кагоцел» у детей раннего детского возраста (2–3 года) и до периода полового созревания. Способность животных к зачатию не изменилась. Применение «Кагоцела» такими повторными курсами не приводит к нарушению морфологического состояния половых желез и не оказывает токсического действия на потомство.
В заключение отметим, что противовирусный препарат «Кагоцел» обладает широким профилем репродуктивной безопасности и может быть использован в педиатрической практике для детей раннего возраста, что было в очередной раз подтверждено циклом пострегистрационных экспериментальных работ.
По материалам “Коммерсант. Наука”