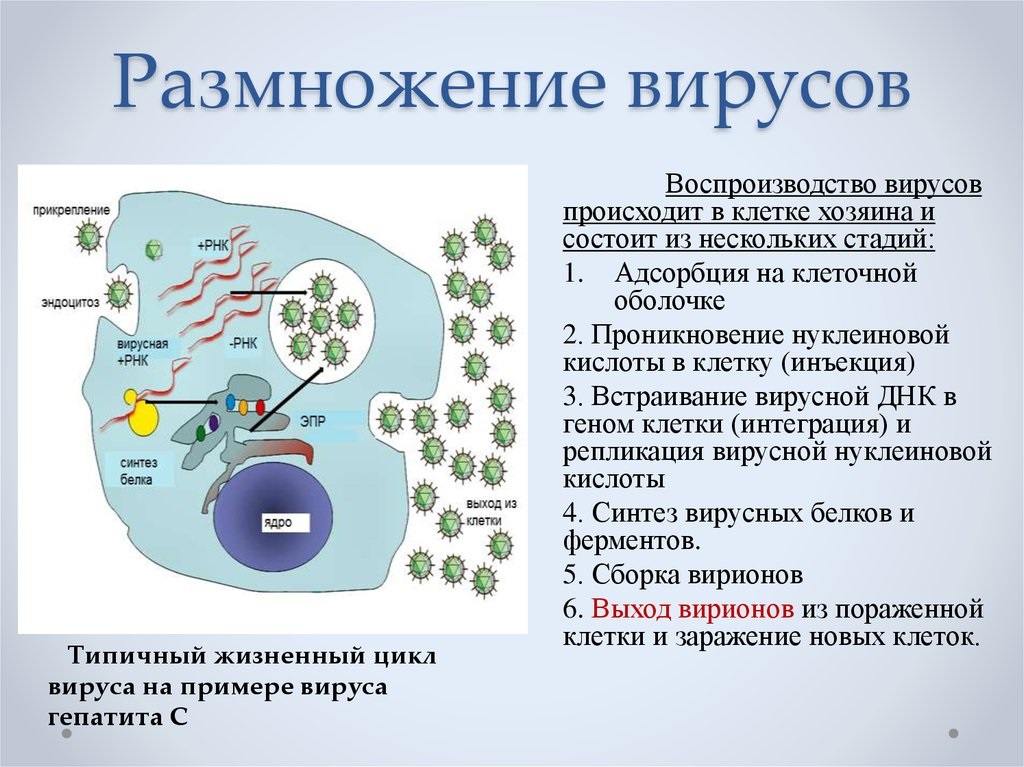
что означает репликация вируса
Репликация вирусов
Репликация вирусов
Размножение вируса, или репликация, является весьма характерным процессом, свойственным только обитателям этого особого мира природы. Как известно, рост организмов растительного и животного мира природы невозможен без деления клеток. Вирус же вообще не увеличивается в размерах. Вирусные частицы появляются сразу «взрослыми» в результате своеобразного процесса, названного репликацией. Но самое поразительное — то, что в продуцировании новых вирусных частиц участвует только одна нить: одинарная цепочка нуклеиновой кислоты.
Проследим за нуклеиновой кислотой бактериофага, проникшей в клетку бактерии. Первым делом ДНК выключает жизненно важные для клетки хозяина процессы. Затем начинают образовываться специфические вещества ферменты, идущие на строительство молекул ДНК, точно таких же, какие были и у бактериофага. Примерно через 8 мин образование ферментов замедляется и начинают образовываться белки капсидов. На строительство цепочек нуклеиновых кислот потомства кроме ферментов идет часть родительской ДНК бактериофага и разбитая ДНК хозяина. Капсиды новых бактериофагов строятся из вновь образованных белков; сюда же идет часть белков разрушенной клетки и старого бактериофага.
Примерно через 15 мин после инфицирования в клетке бактерий образуется столько вирусных частиц, что им становится тесно. Они разрывают оболочку хозяина и вырываются наружу, заражают новые клетки бактерий и т. д.
Репликация вирусов как сборочный конвейер
Часто процесс репликации вирусов сравнивают с заводским сборочным конвейером, действующим по заранее разработанному технологическому процессу. Сначала под руководством ДНК идет изготовление строго определенных элементов деталей. Далее ДНК вырабатывает белки своей сферы и ядрышко, вокруг которого белки под влиянием электростатических сил собираются в сферу. Ядрышко уничтожается, после того как образовалась головка-сфера. Один из ответственейших моментов сборки — заполнение сферы цепочкой ДНК. К этому моменту из отдельных участков «цеха сборки» к «главному конвейеру» подаются недостающие детали бактериофага: стержень, сократительные кольца, пластинки, нити. Эти детали друг за другом прикрепляются к сфере.
Интересно, что «рабочие» операции по сборке вирусов сходны с процессами зарождения и развития более сложных организмов. Не заимствованы ли эти приемы из мира вирусов?
Кстати, технические приемы репликации различных видов вирусов не только состоят из общих операций, но имеют и некоторые особенные черты. Так, вирусы оспы размножаются в цитоплазме, а вирусы группы герпеса и аденовирусы — в ядре. В процессе построения нуклеиновых кислот участвуют разрушенные системы клетки хозяина. Следовательно, вирусам оспы и аденовирусам придется использовать различный строительный материал. Эти вирусы относятся к группе крупных вирусов. Например, в молекуле ДНК вируса осповакцины закодировано около 500 белков. Цикл размножения длится более 20 ч. Можно представить, как сложно контролировать процесс репликации вируса! И если системы, отвечающие за последовательность сборки, хоть раз ошибутся, вирусу не удастся «самособраться». Запомните это уязвимое место в процессе репликации.
Репликация вируса гепатита С: что это такое?
Гепатит С вызывают вирусы HCV (ВГС), которые являются антропонозными, то есть их жизненный цикл происходит только в организме человека. Они имеют высокий уровень гетерогенности генома, в результате чего постоянно мутируют на уровне последовательности нуклеотидов. Репликация вируса гепатита С происходит в печеночных клетках гепатоцитах, поэтому инфицированию подвергается именно этот орган.
Что такое репликация вируса?
ВГС представляет собой РНК-содержащий вирус. Он не имеет ДНК и вся генетическая информация закодирована в рибонуклеиновой кислоте. Для репликации (клонирования, размножения) вирусных агентов необходимы гепатоциты или клетки иммунитета лимфациты.
РНК содержится внутри вирусного агента и содержит более девяти тысяч нуклеотидов, из которых 30% могут подвергаться мутациям. Молекула находится в защитной капсуле, предохраняющую ее от разрушения. При проникновении внутрь клетки печени, она высвобождается и начинается процесс воспроизводства полноценного вирусного агента.
По сути, репликация — это стадия размножения вирусной частицы. Интенсивность репликативной фазы у гепатита С невелика по сравнению с другими типами инфекции. Именно поэтому заболевание сложно распознать даже в острой фазе. У большинства больных из-за вялого репликативного процесса оно сразу приобретает хроническое течение.
Стадии репликации HCV
Для выработки новых антител требуется время. Пока они появляются, вирионы снова мутируют. Считается, что они способны полностью изменять структуру каждую неделю. Таким образом, заболевание остается неизлечимым.
После проникновения патогенов в кровь многие из них погибают. Активная стадия репликации вируса начинается максимум через 2 недели после заражения, когда вирусные частицы достигают клеток печени. Эта фаза длиться до 3 месяцев и в некоторых случаях проявляется острыми симптомами, похожими на грипп. Если иммунная система сильная, то она способна победить заболевание.
Далее наступает носительство и латентная фаза, когда интенсивность размножения и активности вируса снижается. Длительность этого периода определяется состоянием иммунной системы и скоростью патологических изменений в печени.
На что влияет и от чего зависит показатель
Активность размножения патогена зависит от генотипа. Самая низкая интенсивность репликации у гепатита С 1b. Он практически сразу принимает хроническую форму и никак не проявляет себя. При этом вирусы размножаются и повреждают орган. В какой фазе находится заболевание можно узнать по маркерам гепатита С.
к.м.н. Альбина Белова
Имеются противопоказания. Перед применением проконсультируйтесь со специалистом.
Перед применением препаратов, указанных на сайте, проконсультируйтесь с врачом.
Маркеры гепатита В (HBeAg, anti-HBcoreM, anti-HBe, Anti-HBcore)
Гепатит В – острое или хроническое заболевание печени, вызываемое вирусом гепатита В (HBV), протекающее в различных клинических вариантах: от бессимптомных форм до злокачественных (цирроз печени, гепатоцеллюлярная карцинома). На долю ГВ приходится около 15% всех регистрируемых в РФ острых гепатитов и не менее 50% хронических.
Схематично строение вирусной частицы гепатита В можно изобразить так:
Рис.1. Структура вируса гепатита В.
Белок внешней оболочки ВГВ является его поверхностным антигеном – HBsAg. HBsAg – это основной маркёр ГВ. При остром гепатите HBsAg может быть выявлен в крови обследуемых уже в инкубационный период в первые 4–6 недель от начала клинического периода. Присутствие HBsAg более 6 мес рассматривается как фактор перехода болезни в хроническую стадию.
Следует отметить, что только часть HBsAg, образующегося при размножении вируса, используется для построения новых вирусных частиц, основное же его количество поступает в кровь инфицированных лиц, где и определяется HBsAg- антиген.
Это четвертый маркер активной репликации вируса наряду с ДНК, HBs Ag и антиHBc –IgM.
Исчезновение HBeAg и быстрое нарастание титра анти-HBе у больного практически исключает угрозу хронизации ГВ. Отсутствие такой динамики и выявление монотонно низких концентраций анти-НВе, наоборот, может свидетельствовать о развитии хронического ГВ с невысокой активностью (HBeAg-негативный хронический ГВ).
анти-HBs определяют для оценки течения инфекционного процесса и благоприятности его исхода. Факт появления анти-HBs рассматривается как надежный критерий развития постинфекционного иммунитета, т.е. выздоровления после гепатита В. Хотя при хроническом гепатите В HBsAg и анти-HBs могут иногда обнаруживаются одновременно.
Период, в который отсутствуют и HBsAg, и анти-HBs, называется фазой серологического «окна». Сроки появления анти-HBs зависят от особенностей иммунологического статуса больного. Продолжительность фазы «окна» чаще составляет 3–4 мес. с колебаниями до года.
Анти-HBs могут сохраняться пожизненно. Анти-HBs обладают протективными (защитными) свойствами. Этот факт лежит в основе вакцинопрофилактики. В настоящее время в качестве вакцины против ГВ, в основном, применяют препараты рекомбинантного HBsAg. Эффективность иммунизации оценивают по концентрации антител к HBsAg у вакцинированных лиц. Согласно данным ВОЗ, общепринятым критерием успешной вакцинации считается концентрация антител, превышающая 10 мМЕ/мл.
При интегративной фазе развития (т.е. когда вирусные частицы не подвергаются дальнейшей репликации) геном HBV встраивается в геном гепатоцита. Основную роль играет фрагмент, несущий ген, кодирующий HBs антиген Поэтому при этой фазе идет преимущественное образование HBs Ag и антител к коровскому белку и анти- HBe Ag.
Рис. 2. Динамика серологических маркёров при остром гепатите В.
Хронический гепатит С: клиника, диагностика, лечение
В настоящее время проблемой хронической HCV-инфекции интересуются как врачи-специалисты, так и люди, никак не связанные с медициной. От гепатита С во всем мире страдают по меньшей мере 200 млн человек.
В настоящее время проблемой хронической HCV-инфекции интересуются как врачи-специалисты, так и люди, никак не связанные с медициной.
От гепатита С во всем мире страдают по меньшей мере 200 млн человек. Последствиями перенесенного заболевания могут быть хронический гепатит, цирроз и первичный рак печени.
Эпидемиология
Распространенность хронической HCV-инфекции на земном шаре варьирует от 0,5 до 2%. Существуют регионы, для которых характерна более высокая распространенность этого заболевания: 6% в Заире и Саудовской Аравии, 16% в изолированных поселениях в Японии. В России наблюдается рост заболеваемости гепатитом С (3,2 на 100 тыс. населения в 1994 году и 19,3 в 1999 году). Источниками заражения вирусным гепатитом C служат больные острыми и хроническими формами HCV-инфекции, причем в основном это люди, у которых отсутствует желтуха и наблюдается бессимптомное или малосимптомное течение заболевания.
В настоящее время HCV чаще всего инфицируются молодые люди, преимущественно мужчины в возрасте около 20 лет, примерно 40% из них заражаются при внутривенном введении наркотиков. Основным путем инфицирования HCV является парентеральный. Так, у 6,1% больных, которым производилось переливание крови и ее компонентов во время кардиохирургических операций, развивался острый вирусный гепатит C, у 60% из них гепатит принимал хроническую форму.
Существует и риск заражения гепатитом C половым путем, однако он невелик (5-8%). Возможна передача HCV от матерей с острой или хронической формой инфекции; это также редкое явление, встречается не чаще чем в 5-6% случаев. Риск заражения вышеуказанными путями уступает таковому при гепатите В.
Приблизительно у половины больных путь инфицирования HCV установить не удается.
Вирус гепатита С
Вирус гепатита С относится к семейству флавивирусов. Геном вируса представлен однонитевой РНК протяженностью около 10 000 нуклеотидов. Вирус гепатита С вызывает заболевание только у человека. В экспериментальных условиях воспроизвести инфекцию можно у высших обезьян.
Популяция вируса неоднородна. Идентифицированы 6 генотипов (классификация по Simmonds), более 90 субтипов и множество вариантов вируса, обозначаемых как квазивиды. Зарегистрирована территориальная неравномерность циркуляции генотипов вируса гепатита С. В России чаще всего выявляются генотипы 1b и 3а этого вируса.
Определение генотипов вируса гепатита С имеет большое значение для практической медицины. Хотя до сих пор не установлено четкой корреляции между генотипами и уровнем виремии, характеристиками пациента, тяжестью течения заболевания, большинство исследователей соглашаются с выводами о значении генотипов вируса как важного фактора, влияющего на эффективность противовирусной терапии.
Вакцину против гепатита С создать пока не удалось из-за высокой изменчивости вируса гепатита С (ВГС).
Патогенез
Считают, что вирус оказывает прямое цитопатическое действие и вызывает иммуноопосредованное повреждение гепатоцитов. Высокая степень хронизации вирусного гепатита С обусловлена некоторыми особенностями действия вируса:
В течении хронической HCV-инфекции может происходить нейтрализация мажорного варианта вируса, но тогда генерируются минорные варианты. Квазивиды HCV представляют собой движущуюся мишень, которую ограничивает иммунная система хозяина. Появление нового мажорного квазивида сопровождается повышением виремии и увеличением титра Ig M антител к вирусным белкам. Постепенно и этот новый мажорный вариант заменяется. Такой процесс приводит к периодической волнообразной виремии, сопровождающейся обострением хронического гепатита С (ХГС) и повышением уровня антител.
Возможно, антивирусному Т-клеточному ответу отведена центральная роль в элиминации ВГC, так как нейтрализующие антитела, по-видимому, очень часто оказываются неэффективными. Т-хелперные (Th) лимфоциты распознают вирусные антигенные пептиды, представленные HLA-комплексом II класса на поверхностной мембране антиген-презентирующих клеток. В зависимости от типа цитокинового профиля Th-клетки делятся на две группы: Th1 и Th2. Первые продуцируют IFNg и IL2, стимулируя Т-клеточный ответ и цитотоксическую Т-лимфоцитную активность, а вторые продуцируют IL4 и IL10, стимулируя В-клеточный ответ. Таким образом, Тh-лимфоциты играют существенную роль в регуляции иммунного ответа. У пациентов, у которых болезнь перешла в хроническую стадию, в острой фазе вирус-специфический Th ответ был ниже и преобладали цитокины типа Th2.
У хронически ВГC-инфицированных пациентов значительно увеличено содержание вирусоспецифических Th2-клеток и их цитокинов. Нарушение баланса Th1/Th2 цитокиновой продукции может играть важную роль в иммунопатогенезе хронической ВГC-инфекции. Показано снижение уровня IFNg и IL12 при ХГС. Этот дефицит является следствием повышенного уровня IL10, предполагаемого отрицательного регулятора для IFNg. Повышенное содержание Th2-клеток при ХГС может снижаться при комбинированной терапии рибавирином и IFNa. Обнаружено, что у пациентов с клинико-биохимическим улучшением после лечения IFNa произошло увеличение уровня Th1-цитокинов.
Цитотоксические лимфоциты (CTL) играют, по-видимому, некоторую роль в ограничении репликации ВГС. Этот ответ недостаточен для полной элиминации вируса при хронической инфекции и, кроме того, может вызывать повреждение печени. Известно, что CTL способны быстро опознавать и направленно лизировать клетки, несущие ВГC-антигены, не провоцируя значительного воспаления, с помощью перфоринового, FasL- и TNFα-базируемых механизмов.
ТNF, как предполагается, индуцируют апоптоз клеток, опосредуя высвобождение свободных радикалов из митохондриальных электронно-транспортных путей и модуляцию синтеза некоторых белков. Взаимодействие нуклеокапсидного белка ВГC с внутрицитоплазматической частью рецептора TNFb, вероятно, представляет собой эволюционно-отобранный механизм, с помощью которого вирус препятствует преждевременному апоптозу клетки-хозяина. В отсутствие доступных модельных клеточных культур прямая цитопатичность вируса гепатита С не может быть исследована в полном объеме.
В подавляющем большинстве случаев острого гепатита С иммунной системе не удается элиминировать вирус. До сих пор нет ясного представления о том, почему это происходит. Очевидно, ВГС обладает эволюционно-закрепленными способностями, обеспечивающими ему персистенцию.
Однако иммунная система может оказывать существенное влияние на ВГC-инфекцию. В 15% случаев острого гепатита С она эффективно уничтожает вирус, а у хронически ВГC-инфицированных обеспечивает умеренное ограничение инфекции в течение почти 20 лет. Возможно, ослабление какого-либо звена антивирусных иммунных механизмов позволяет вирусу активно воздействовать на иммунную систему. Длительная ВГC-персистенция может привести к развитию В-клеточных лимфопролиферативных нарушений, таких, как смешанная криоглобулинемия, злокачественная не-Ходжкинская лимфома и появление органоспецифических и неспецифических аутоантител. Таким образом, хроническую ВГC-инфекцию следует рассматривать как мультисистемное заболевание.
Диагностика
Лабораторная диагностика гепатита С основана на выявлении специфических маркеров инфицирования ВГС (анти-ВГС-IgM/G, РНК ВГС) и должна проводиться разрешенными МЗ РФ к применению диагностическими препаратами отечественного или зарубежного производства в лабораториях, имеющих лицензию на проведение данного вида лабораторных исследований.
HCV RNA — самый ранний маркер репликации вируса, определяемый с помощью полимеразной цепной реакции (ПЦР) спустя несколько недель после заражения. Для выявления анти-ВГС применяют иммуноферментный анализ (ИФА). В настоящее время используют тест-системы третьего поколения ELISA-3. Подтверждающим методом является рекомбинантный иммуноблотинг (RIBA). У 60% больных анти-ВГС определяются в острой фазе, у 35% они появляются спустя 3-6 месяцев после инфицирования, у 5% инфицированных лиц анти-ВГС не определяются.
Болезнь может протекать бессимптомно. Наиболее распространенным симптомом является слабость. Целенаправленный опрос больных часто помогает выявить такие факторы риска, как переливание крови, внутривенное введение наркотиков, хронический гемодиализ и др. Кроме слабости больной может жаловаться на быструю утомляемость, тяжесть в правом подреберье, боли в правом верхнем квадранте живота, диспепсические явления.
Критериями постановки диагноза являются увеличение печени и селезенки, гиперферментемия и анти-ВГС в крови в течение не менее 6 месяцев.
Гепатоспленомегалия выявляется не более чем у 50% обратившихся за помощью больных, активность сывороточных трансаминаз редко превышает верхнюю границу нормы в 6 раз. Следует обратить внимание на то, что активность сывороточных трасаминаз не отражает степени изменений в печени: она может быть нормальной, несмотря на значительные морфологические изменения. Концентрация РНК ВГС в сыворотке имеет существенное значение для определения контагиозности и для мониторинга результатов лечения. При наличии в крови HCV-РНК биопсия печени, как правило, выявляет ряд изменений. Концентрация HCV-РНК в сыворотке, превышающая 105 молекулярных эквивалентов (копий) в 1 мл, наблюдается в активной фазе заболевания и совпадает с пиками активности трансаминаз.
Наличие или отсутствие РНК ВГС, как правило, не является диагностическим критерием хронического гепатита С и определяет фазу процесса (активный, неактивный).
Для раннего выявления ГЦК у больных циррозом печени, особенно у мужчин старше 40 лет, каждые 6 месяцев определяют уровень сывороточного α-фетопротеина и выполняют УЗИ печени.
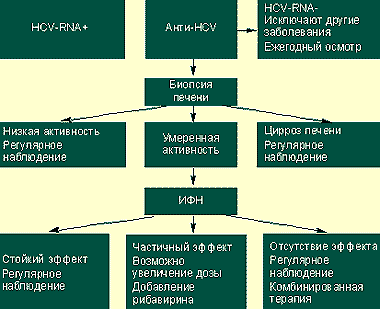 |
| Алгоритм ведения HCV-положительных больных |
Естественное течение и прогноз
Считается, что не более чем у 30% больных ВГС с минимальной морфологической активностью через 20 лет возможно развитие цирроза печени. Таким образом, больные, у которых при гистологическом исследовании биоптата печени выявляется наличие минимального воспаления и минимального фиброза, нуждаются в динамическом наблюдении.
Если персистенция РНК ВГС сохраняется более 6 месяцев, то спонтанное разрешение хронической HCV-инфекции маловероятно.
Клиническая картина
У большинства больных с хроническим гепатитом С заболевание протекает бессимптомно. Если жалобы существуют, то это чаще всего слабость, тупые боли в правом подреберье, тошнота, снижение аппетита, кожный зуд, артралгии и миалгии. Физикальный осмотр пациента помогает установить диагноз зачастую только на стадии цирроза печени.
Внепеченочные проявления HCV-инфекции
Ассоциация хронического гепатита С с различными внепеченочными проявлениями — хорошо известный врачам факт. Наиболее вероятным для большинства заболеваний и синдромов, наблюдаемых при HCV-инфекции, представляется иммунный патогенез, хотя конкретные механизмы во многом еще не выяснены. Доказанные и предполагаемые иммунные механизмы включают:
Частота иммуноопосредованных заболеваний и синдромов у больных хроническим гепатитом С достигает 23%. Наиболее характерны аутоиммунные проявления для больных с гаплотипом HLA DR4, который ассоциируется с внепеченочными проявлениями при аутоиммунном гепатите. Этот факт подтверждает гипотезу о триггерной роли вируса в инициации аутоиммунных процессов у генетически предрасположенного индивидуума.
Заболевания, ассоциированные с HCV-инфекцией
Ассоциированные с продукцией или отложением иммуноглобулинов:
Ассоциированные с неизвестным механизмом:
Выявление сывороточных аутоантител отражает наиболее частый феномен аутоиммунизации при HCV-инфекции, который диагностируют у 40-65% больных. Спектр аутоантител достаточно широк и включает ANA (до 28%), SMA (до 11%), анти-LKM-1 (до 7%), антифосфолипидные (до 25%), антитиреоидные (до 12,5%), ревматоидный фактор, анти-ASGP-R и др. Чаще всего титры этих антител не достигают диагностических значений, показательных для той или иной аутоиммунной патологии.
Анти-GOR являются антителами, специфичными для HCV-инфекции, и их выявляют не менее чем у 80% больных. Эпитоп, распознаваемый анти-GOR, локализуется на пока неидентифицированном ядерном белке, гиперэкспрессию которого наблюдают при гепатоцеллюлярной карциноме. Выработка анти-GOR ассоциирована только с HCV-инфекцией, но не с АИГ.
Аутоиммунные расстройства наблюдаются в среднем у 23% больных хроническим гепатитом С. Наиболее часто встречаются патология щитовидной железы.
Гистологическое исследование печени
Гистологическая картина не является патогномоничной, при этом достаточно часто выявляются характерные изменения. Отличительная особенность ее — лимфоидные агрегаты или фолликулы в портальных трактах, которые могут быть как изолированными, так и частью воспалительных изменений портальных трактов. По клеточному составу эти агрегаты напоминают первичные лимфоидные фолликулы в лимфатических узлах. Жировая дистрофия обнаруживается в 75% случаев. Кроме того, выявляются следующие характерные изменения: негнойный холангит с лимфоидной и плазмоклеточной инфильтрацией стенок протоков; лимфогистиоцитарная инфильтрация перипортальной зоны; слабовыраженные ступенчатые некрозы; мостовидные некрозы (обнаруживаются редко), пролиферация и активация сателлитных клеток печени, пролиферация эпителия желчных канальцев.
Отмечено, что индекс гистологической активности (ИГА) и индекс фиброза (ИФ) у больных хроническим гепатитом С с наличием жировой дистрофии достоверно выше, чем у пациентов без сопутствующей жировой дистрофии. У 93% больных с жировой дистрофией в гепатоцитах обнаруживался Core-протеин ВГС, при отсутствии жировой дистрофии — лишь у 39%. Этим фактом подчеркивается роль Core-протеина в развитии жировой дистрофии гепатоцитов.
Биопсия печени играет существенную роль в уточнении диагноза и оценке активности и стадии заболевания.
РНК ВГС можно определить в ткани печени методом ПЦР.
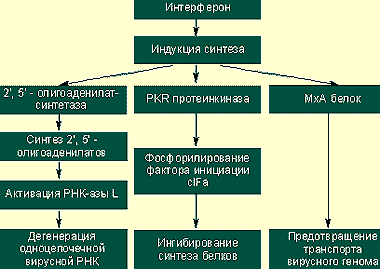 |
| Предотвращение вирусной транскрипции и трансляции |
Лечение
Основная цель лечения — предотвратить прогрессирование заболевания.
Режим отдыха, диета и прием витаминов не оказывают лечебного действия.
Отбор пациентов для лечения. Показанием к назначению терапии интерфероном служит умеренное (но не минимальное) либо тяжелое воспаление и/или фиброз. Решение о лечении пациентов с циррозом печени принимают индивидуально в каждом конкретном случае. Больные, у которых гистологическая активность минимальна, должны находиться под динамическим наблюдением, так как они имеют хороший жизненный прогноз без лечения и очень низкий риск развития цирроза печени через 10-20 лет.
Факторы, связанные с благоприятным эффектом противовирусной терапии при хронической HCV-инфекции:
Больным с нормальным уровнем АЛТ и положительным тестом на HCV RNA без результатов гистологического исследования противовирусное лечение проводить не рекомендуется.
Основной препарат, эффективность которого в лечении гепатита С доказана, — это интерферон альфа (ИФα).
В настоящее время принята оптимальная схема монотерапии ИФ: разовая доза составляет 3 млн МЕ, ее вводят подкожно или внутримышечно 3 раза в неделю в течение 3 месяцев. Через 3 месяца необходимо исследовать РНК ВГС. Если результаты ПЦР положительные схему лечения меняют. Если же РНК не выявляется, лечение продолжают до 12 месяцев. Стойкий положительный ответ в этом случае регистрируется у 15-20% больных.
Оптимальная схема лечения хронического гепатита С в настоящее время — это комбинация ИФa и рибавирина.
Согласно рекомендации согласительной конференции Европейской ассоциации по изучению печени (1999), больным с впервые установленным диагнозом «хронический гепатит С» и показаниями к лечению необходимо назначать ИФa в комбинации с рибавирином следующими курсами:
Стойкий положительный ответ при комбинированном лечении ИФa с рибавирином наблюдается в 40-60% случаев.
Суточная масса рибавирина составляет 1000-1200 мг в зависимости от массы тела.
В последние годы для повышения эффективности интерферона применяют пегилирование, которое заключается в присоединении к молекуле интерферона полиэтиленгликоля. В итоге образуется ПЭГ-интерферон, имеющий более длительный период полураспада. Предварительные данные свидетельствуют о большей эффективности такого лечения по сравнению с терапией интерфероном альфа.
Одним из наиболее перспективных пегилированных интерферонов является пегасис — ПЭГ-интерферон альфа-2а, соединенный с разветвленной молекулой полиэтиленгликоля, молекулярная масса которого составляет 40 kDa, общий вес молекулы — около 60 kDa. Особенности химической структуры данного препарата определяют его фармакокинетические свойства и клиническую эффективность. Молекула полиэтиленгликоля присоединена к альфа-интерферону посредством самой стабильной амидной связи, это делает молекулу пегасиса чрезвычайно устойчивой к действию петидаз и позволяет выпускать препарат в виде растворенной и готовой к употреблению лекарственной формы. Особенностью молекулы полиэтиленгликоля является способность активно связывать несколько молекул воды, что создает вокруг химически структурной единицы пегасиса эффект «водного облака», делая ее устойчивой во внутренней среде и сообщая препарату относительно небольшой объем распределения. Это, в свою очередь, способствует тому, что отпадает необходимость в коррекции дозы препарата в зависимости от массы тела пациента: пегасис вводится один раз в неделю в дозе 180 мкг. Существенными преимуществами препарата пегасис являются значительно лучшая переносимость и меньшая частота побочных реакций, ассоциированных с системным действием альфа-интерферона, что значительно улучшает качество жизни пациентов, получающих лечение по поводу хронического гепатита С. Кроме того, в отличие от других пегилированных интерферонов пегасис не требует существенной коррекции дозы в зависимости от функционального состояния почек, что делает препарат незаменимым у пациентов с сопутствующей хронической почечной недостаточностью.
Клиническая эффективность пегасиса оценена солидными широкомасштабными многоцентровыми рандомизированными исследованиями. Было показано, что частота доказанного ответа на лечение значительно превышает таковую по сравнению с «короткими» интерферонами как в схемах монотерапии, так и в сочетании с рибавирином. Особенно впечатляющими в этой связи являются результаты этиопатогенетической терапии с использованием пегасиса в сочетании с рибавирином у так называемой «трудной» категории пациентов, имеющих морфологические проявления цирроза печени, 1b-генотип вируса, высокую виремию: частота доказанного ответа на лечение у данной категории пациентов при использовании пегасиса в сочетании с рибавирином может составлять около 40%, у иных категорий пациентов этот показатель может превышать 75%, что ранее было практически немыслимым результатом.
Другие противовирусные препараты в лечении хронического гепатита С
Имеются данные, свидетельствующие о положительном действии таких препаратов, как ремантадин, урсодеоксихолевая кислота, пегилированные интерфероны, препараты глициризиновой кислоты, однако эта информация нуждается в дальнейшей проверке.
По вопросам литературы обращаться в редакцию