демиелинизирующий генез что такое
Что такие демиелинизация?
Демиелинизация — это потеря миелина, жировой ткани, которая окружает и защищает нервы по всему телу. Процесс связан со многими неврологическими заболеваниями — например, с рассеянным склерозом и невритом. Демиелинизация может поражать участки головного и спинного мозга, а также периферические нервы.
Симптомы демиелинизации соответствуют пораженной области нервной системы. Вот несколько примеров:
К общим симптомам демиелинизирующих заболеваний (то есть заболеваний, при которых разрушается миелин) относятся:
Симптомы демиелинизации не отличаются стабильностью: они могут появляться и исчезать или постепенно ухудшаться.
Миелиновые оболочки позволяют нервам эффективно посылать сигналы в мозг. Эта жировая ткань изолирует периферические нервы, а также нервы головного и спинного мозга. Когда наблюдается дефицит или внезапное уменьшение миелина, нервы могут перестать функционировать, что и приведёт к симптомам.
Демиелинизация часто вызвана воспалением, из-за которого разрушается миелин. Воспаление может возникать в ответ на инфекцию. Также оно бывает частью аутоиммунного процесса. Среди других факторов — генетика, инфекция и дефицит питательных веществ. Некоторые демиелинизирующие состояния, такие как синдром Гийена-Барре, являются идиопатическими, то есть возникают без явного триггера.
Заболеваний, при которых разрушается миелин, достаточно много. Всем им свойственны симптомы, описанные выше. Вот некоторые из таких болезней:
У лечения есть две цели: устранить симптомы и предотвратить их ухудшение. Если нервы повреждены не слишком сильно, возможно полное выздоровление. Для предотвращения демиелинизации используют следующие методы:
В большинстве случаев демиелинизацию можно контролировать. Главное — вовремя обратиться к врачу, чтобы начать лечение. Поэтому если вы замечаете симптомы из статьи, обязательно обратитесь к специалисту.
Хроническая воспалительная демиелинизирующая полиневропатия
Хроническая воспалительная демиелинизирующая полиневропатия (ХВДП) – это аутоиммунное демиелинизирующее заболевание периферической нервной системы, характеризующееся рецидивирующим или прогрессирующим течением с преимущественно демиелинизирующим типом поражения.
Длительное время ХВДП рассматривалась как хроническое проявление синдрома Гийена-Барре [3].
Частота заболеваемости ХВДП, оцененная на большой популяции у взрослых составляет от 1 до 3 на 100 тыс. населения [2]. ХВДП встречается в любом возрасте, включая детей [9]. Для ХВДП характерно два пика заболевания. Первый пик заболевания регистрируется в 40-50-ти летнем возрасте, второй – старше 70-ти лет.
Развитию заболевания предшествует контакт организма с вирусной инфекцией или с иммунизацией (профилактической вакцинацией).
Длительное время считалось, что развитие ХВДП связано с носительством определённых генов HLA (A1, B8, DRW3). В настоящее время эта гипотеза не была подтверждена. В основе патогенеза ХВДП лежит вовлечение в процесс клеточного и гуморального звена иммунитета [8]. Считается, что в результате феномина «мимикрии», вызванное инфекционными агентами, происходит активация аутореактивных клеток. Аутореактивные клетки проникают в нерв и нарушают целостность миелина [3]. Демиелинизация может наблюдаться на любом отрезке периферического нерва от спинномозговых корешков до его дистальных участков. Кроме демиелинизации в биоптатах икроножного нерва были выявлены воспалительные инфильтраты и отёк подоболочечного пространства нерва.
Обычно заболевание начинается постепенно, с симметричной слабости в конечностях и потери чувствительности. Сначала поражаются нижние конечности. В результате поражения нижних конечностей у больных затрудняется походка, способность подняться по лестнице или из кресла. Наиболее типичной формой ХВДП является сенсомоторная форма, при которой отмечаются как двигательные, так и чувствительные нарушения в конечностях. В течение нескольких недель или месяцев у больных отмечается появление слабости в руках. Однако, слабость в руках выражена меньше, чем в ногах. Мышечная слабость в конечностях сопровождается снижением сухожильных рефлексов и сенсорными нарушениями в виде гипестезии, анестезии.
Согласно литературным данным примерно в 15% случаев ХВДП имеет острое начало с быстрым нарастанием мышечной слабости в течение первых 4 недель от начала заболевания. Такое острое и бурное начало заболевания напоминает СГБ, в частности острую восполительную демиелинизирующую полирадикулоневропатию, что затрудняет постановку правильного диагноза [1, 2]. Несмотря на похожую клиническую картину острого начала ХВДП и СГБ можно отметить ряд отличий. В первых при ХВДП редко наблюдается поражение дыхательной мускулатуры и развитие дыхательной недостаточности. Во вторых для СГБ характерно поражение черепных нервов и чёткой связи с предшествующей инфекцией [3]. Однако, часто поставить правильный диагноз ХВДП можно только в том случае если в течение 2 месяцев от начала заболевания сохраняется прогрессирование заболевания или её рецидив.
Течение ХВДП может быть прогрессирующим, ремитирующим и стационарным. Ремитирующее течение ХВДП считается типичным и встречается в 48% случаев у лиц молодого и среднего возраста. Для лиц пожилого возраста характерно прогрессирующее течение заболевания. У 20% больных ХВДП протекает с нечётко выраженными клиническими проявлениями заболевания на протяжении многих лет [10].
Диагностические критерии ХВДП были предложены Европейской федерацией неврологических обществ (European Federation of Neurological Societies (EFNS) ) в 2010 году [14]. Диагностические критерии ХВДП включают клинические и лабораторные данные (табл. 1).
Диагностические критерии ХВДП [14]
Диагноз ХВДП считается достоверным при наличии всех диагностических критериев. Вероятным диагноз считается при наличии всех клинических и исключающих критериев и 2 или 3-го лабораторных критериев.
Лечение ХВДП состоит из патогенетической и симптоматической терапии. К патогенетической терапии или терапии первой линии относятся глюкокортикоиды (ГК), иммуноглобулин G для внутривенного введения (IgG) и плазмаферез (ПФ). Данные методы обладают одинаковой эффективностью, однако необходимо учитывать их доступность и индивидуальную вариабельность. Согласно литературным данным при типичном течении ХВДП с выраженными сенсорными нарушениями высокой эффективностью обладают ГК. При ассиметричных и двигательных нарушениях – IgG [3, 11, 12, 14].
ГК (метилпреднизолон, преднизолон) назначают в дозе 1 мг/кг/сут в течение 2-4 недель с последующим снижением дозы на 5 мг каждые 2-3 недели. Продолжительность лечения ГК составляет 1-2 года. Альтернативной схемой лечения является назначение метилпреднизолона в дозе 1 г/сут в течение 5 дней с последующим введением 1 г/сут 1 раз в неделю в течение 4-8 недель.
IgG для лечения ХВДП применяются в дозе 2 г/кг в течение 2-5 дней, затем 1 г/кг каждые 3 недели или 0, 5 г/кг в течение 4 дней каждый месяц на протяжении 6 месяцев.
В случае недостаточной эффективности ГК или IgG применяется ПФ [2, 3, 7, 14]. Согласно рекомендациям Американского Общества Афереза (2010) ПФ проводится 2-3 раза в неделю до наступления улучшения. Схема проведения ПФ заключается в удалении 1-1, 5 объёма циркулирующей плазмы. Замещение удаляемого объёма плазмы производится 5% альбумином [4, 13].
Терапия второй линии обычно проводится в тех случаях, когда терапия первой линии оказывается неэффективной или требуется снижение дозы ГК по тем или иным причинам, а также, если нет возможности для использования IgG. К препаратом второй линии относятся азатиоприн, циклофосфамид, циклоспорин, метотрексат [14].
В симптоматическую терапию входит купирование неврологических болей, комплекс реабилитационных мероприятий (массаж, лечебная физкультура).
На фоне проводимой терапии, полное и частичное восстановление двигательных функций наблюдается у 10-15 и 70% больных соответственно. У 13% больных наблюдается прогрессирование заболевания, что приводит к инвадилизации [2, 5, 7].
Автор статьи:
Кутепов Дмитрий Евгеньевич
Острый диссеминированный энцефаломиелит
Острый диссеминированный энцефаломиелит (ОДЭМ) — воспалительное демиелинизирующее заболевание ЦНС, развивающееся остро или подостро в тесной временной связи с инфекционным заболеванием или вакцинацией. Неврологическая картина ОДЭМ обычно отражает многооча
Острый диссеминированный энцефаломиелит (ОДЭМ) — воспалительное демиелинизирующее заболевание ЦНС, развивающееся остро или подостро в тесной временной связи с инфекционным заболеванием или вакцинацией. Неврологическая картина ОДЭМ обычно отражает многоочаговое, но монофазное поражение нервной системы с полным или выраженным клиническим выздоровлением в большинстве случаев (4, 6, 11, 12, 14, 15).
История изучения ОДЭМ. Впервые клиническую картину заболевания описал J. Lucas в XVIII столетии. В то время ОДЭМ был ассоциирован с корью, натуральной и ветряной оспой и сопровождался высокой смертностью. В 1920–1930 гг. были проведены первые эксперименты по созданию модели воспалительной демиелинизации на животных. Обезъяны иннокулировались экстрактом мозга, и у них развивались слабость и атаксия, при этом гистологически отмечались периваскулярное воспаление и демиелинизация. Сходство экспериментального и поствакцинального ОДЭМ было очевидным.
В 1931 г. D. McAlpine выделил три варианта ОДЭМ: постинфекционный, поствакцинальный и спонтанный (спорадический).
Постинфекционный ОДЭМ, как правило, связан с предшествующей или сопутствующей инфекцией, обычно вирусной и неспецифической инфекцией верхнего дыхательного тракта. Полный список признанных причин ОДЭМ представлен в табл. 1.
Пациенты могут заболевать в любом возрасте, но наиболее подвержены ОДЭМ дети и подростки. Истинная частота ОДЭМ не известна. Частота посткоревой и постветряночной ОДЭМ оценивается как 1:1000 случаев [7].
Поствакцинальный ОДЭМ. Поствакцинальный ОДЭМ составляет 5% всех случаев ОДЭМ. После широкого введения в 1853 г. противооспенной вакцины E. Jenner и в 1885 г. антирабической вакцины L. Paster у вакцинированных индивидуумов были отмечены «нейропаралитические случаи». «Инокулум» Пастера вызывал «нейропаралитический случай» ОДЭМ примерно у 1 на 1000 человек. Первоначально считали, что неврологические симптомы обусловлены вирусным компонентом вакцины, хотя впоследствии было признано, что это результат присутствия ткани ЦНС, «загрязняющей» вакцину. Эта гипотеза подтверждена снижением встречаемости поствакцинального ОДЭМ в настоящее время, когда большинство вакцин больше не готовятся из инфицированной in vivo ткани ЦНС [9, 10].
Частота ОДЭМ составляет 1–2 случая на 1 млн человек при вакцинации живой коревой вакциной. Наиболее часто ассоциированными с поствакцинальным ОДЭМ являются противокоревая, паротитная и краснушная вакцины.
Патогенез ОДЭМ. По патогенезу и клинической картине ОДЭМ близок к рассеянному склерозу (РС). Наиболее признанные теории основываются на концепции, что патологоанатомические данные при ОДЭМ аналогичны тем, что получены при экспериментальном аллергическом энцефаломиелите (ЭАЭ): агент поражает миелин, активируя сегрегированные антигены, в ответ на это запускается иммунная реакция [2, 8, 13, 16].
Для развития ОДЭМ достаточно воздействия любой системной инфекции. Инициирование постинфекционного ОДЭМ обусловлено скорее всего молекулярной мимикрией между вирусом и миелиновыми антигенами. В случае поствакцинального ОДЭМ основной причиной развития заболевания является направленная иммунная реактивность к основному белку миелина (ОБМ).
В настоящее время допускается, что первичная системная активация Т-клеток монофазна и уменьшается при исчезновении провоцирующих факторов, например, инфекции.
Гистологические изменения при ОДЭМ имеют форму периваскулярной демиелинизации и отека, в то время как аксоны относительно не поражены. Поражение миелина выражается в его набухании, распаде и исчезновении из-за поглощения продуктов распада миелина фагоцитами. Осевые цилиндры страдают меньше. Как правило, в них отмечаются набухание, реже фрагментация. В более поздней стадии заболевания поражение заменяется глиозом.
Патоморфологические данные коррелируют с длительностью заболевания и показывают эволюцию от диффузного вовлечения сосудов к распространенной демиелинизации.
Клиническая картина. Факт перенесенного вирусного заболевания или вакцинации чаще находится в пределах 1-го месяца, предшествующего появлению неврологических симптомов. При изучении ОДЭМ у детей документированное подтверждение продромального вирусного заболевания или вакцинации встречалось в 75% случаев. Время появления первых симптомов варьируется в зависимости от этиологии. Обычно заболевание возникает от 1 до 14 дней после вакцинации, неделю или меньше после появления сыпи при экзантемных заболеваниях и 1–3 недели (или более) после инокуляции антирабической вакцины.
Отмечена зависимость клинического фенотипа ОДЭМ от предшествующего заболевания. Описано несколько вариантов фенотипа ОДЭМ: посткоревой ОДЭМ чаще имеет тяжелое клиническое течение, в то время как ОДЭМ, обусловленный ветряной оспой, имеет благоприятный прогноз. Своеобразный фенотип ОДЭМ у детей был представлен при гемолитической стрептококковой инфекции группы Аb [3]. У 10 детей в возрасте от 3 до 14 лет развились типичные клинические проявления ОДЭМ, но с выраженными симптомами экстрапирамидного синдрома (70%), нарушением поведения и речи (50%). При этом «синдром ОДЭМ», как правило, следовал за острым фарингитом, клинически отличался от ревматической хореи, и в сыворотке крови больных отмечался высокий уровень антител к базальным ядрам. Начало ОДЭМ может быть острым (90–95%): «взрывное» начало и прогрессирование неврологических симптомов в течение нескольких часов до пика в днях и подострым (5–10%): с незаметным началом, медленным прогрессированием и максимальным неврологическим дефицитом до 30 дня с момента заболевания.
Независимо от остроты начала заболевания и этиологической причины ОДЭМ клинически проявляется полисимптомно. При остром начале заболевания характерными являются одновременные появления инфекционных, общемозговых симптомов в сочетании с очаговыми: симптомы поражения ствола головного мозга, мозжечка, спинного мозга.
Дебютные симптомы ОДЭМ часто включают лихорадку, головную боль, рвоту. Судороги и менингеальные симптомы не характерны, но если наблюдаются, то при постинфекционных ОДЭМ чаще, чем после поствакцинальных.
Неврологические симптомы в основном многоочаговые, гетерогенные (зависят от места и выраженности воспалительного демиелинизирующего процесса в ЦНС) и включают изменение уровня сознания, пирамидные нарушения (монопарез, гемипарез), атаксию и симптомы поражения ствола головного мозга, черепных нервов (ЧН), в том числе и двусторонний оптический неврит.
В клинической картине ОДЭМ существенное место занимают симптомы поражения корешков и периферических нервов: боли, расстройства чувствительности в стопах и кистях, снижение сухожильных и надкостничных рефлексов, мышечная гипотрофия.
Изолированный поперечный миелит обычно рассматривается как самостоятельная нозологическая единица, но в четверти всех случаев может представлять клиническое проявление ОДЭМ.
В наших исследованиях (обследовано 50 детей в возрасте 8 мес –14 лет, средний возраст больных — 6,43 ± 0,59 года) инфекционный продром встречался в 50% случаев ОДЭМ и включал симптомы интоксикации (сонливость, общую слабость, анорексию), изменение температуры тела, респираторный синдром (кашель, фарингит, ринит). Температура тела была повышена до высоких цифр в 23 случаях (47%), в 2 (3%) — до субфебрильных цифр. В 1/2 всех случаев ОДЭМ (25 пациентов — 50%) температура тела не изменялась.
Из общемозговых симптомов отмечались: головная боль у 15 детей (30%), рвота — у 11 (22%), нарушение сознания — у 5 (10%), генерализованные судороги — у 3 (12%). Дыхательная недостаточность, потребовавшая проведения искусственной вентитяции легких (ИВЛ), вследствие угнетения сознания и цервикального миелита появилась у 2 пациентов (4%). Симптомы раздражения мозговых оболочек — у 7 пациентов (14%).
В 71% случаев наблюдались спастические парезы и параличи, при этом в виде асимметричного тетрапареза — у 24 детей (48%), нижнего парапареза — у 8 (16%), гемипареза — у 4 пациентов (8%) и у 2 пациентов (4%) — монопареза. В 20 случаях (40%) отмечалось сочетанное поражение центрального и периферического двигательного нейрона (смешанные парезы и параличи). Полиневритический синдром отмечен в 20 (40%) случаях.
Черепные нейропатии проявлялись в виде симметричного двустороннего оптического неврита (ОН) у 15 пациентов (30%), симптомов поражения III ЧН (расходящееся косоглазие, птоз) — у 12 (24%), V ЧН (нарушение чувствительности на лице) — у 5 (10%), VI ЧН (сходящееся косоглазие) — у 3 (6%), VII ЧН (периферический парез мимических мышц) — у 24 (48%), VIII ЧН (системное головокружение, рвота, вестибулярный нистагм) — у 4 (8%), IX, X, XII ЧН (бульбарный синдром) — у 23 (46%).
Снижение зрения отмечалось у 16 пациентов (32%), все они отвечали критериям двустороннего ОН. У детей с ОН ухудшение остроты зрения часто было тяжелым вплоть до стойкого амавроза.
Мозжечковые симптомы в виде атаксии, диффузной мышечной гипотонии, координаторной дисметрии отмечались у 38 пациентов (76%).
Редкими клиническими симптомами явились мышечная ригидность — «симптом зубчатого колеса» — у 1 пациента (2%), гиперкинезы: тремор покоя — у 1 (2%), атетоз — у 1 (2%) и миоклонии — у 3 (6%)).
Нарушения чувствительности в начале заболевания характеризовались болями, парестезиями у 10 пациентов (20%), снижением или потерей чувствительности у 22 детей (44%), из них у 4 (8%) — по проводниковому типу, у 12 (24%) — по полиневритическому типу, у 6 (12%) — по сегментарно- корешковому типу и ни в одном случае не выявлена моноанестезия.
У 12 больных (24%) при ОДЭМ наблюдалось нарушение функции тазовых органов, из них у 8 (16%) — по центральному типу (задержка мочи или императивные позывы на мочеиспускание и дефекацию), у 4 (8%) — по периферическому типу (недержание мочи и кала).
Нарушения высших психических функций (ВПФ) в остром периоде ОДЭМ проявлялись нарушениями в эмоционально-волевой сфере (12–24%) и когнитивными расстройствами (8–16%). Парциальные эпилептические приступы в острой фазе заболевания отмечены у 3 больных (6%), в последующем пациенты имели симптоматическую парциальную эпилепсию.
Таким образом, клиническая картина при ОДЭМ в связи с выраженной диссеминацией патологического процесса полиморфна. Могут поражаться все отделы ЦНС и ПНС (периферической нервной системы), при этом в одних случаях преобладают полушарные, а в других — симптомы поражения ствола мозга или спинного мозга.
Мультифазный диссеминированный энцефаломиелит (МДЭМ). Хотя ОДЭМ обычно имеет монофазное течение без клинических рецидивов или новых субклинических повреждений в дальнейшем, однако в медицинской литературе имеются сообщения о повторных случаях заболевания и рецидивирующем ОДЭМ. Рецидивирующие эпизоды, как предполагается, происходят в период нескольких месяцев и обычно с аналогичными клинико-лабораторно-рентгенологическими характеристиками. Терминология в настоящее время уточняется. Ранее применяли термин «рецидивирующий ОДЭМ». Недавно был предложен термин «двухфазный диссеминированный ЭМ».
Клиническое течение ОДЭМ: для ОДЭМ характерно отсутствие новых обострений, за исключением редких рецидивирующих форм. После острой стадии заболевания почти всегда наступает быстрое улучшение без последующих рецидивов, иногда со стойким неврологическим дефектом.
В наших исследованиях в подавляющем большинстве случаев ОДЭМ был монофазным (90%), в относительно редких случаях ОДЭМ рецидивировал. За период наблюдения рецидив имели 5 пациентов (10%). Количество рецидивов (относительно всей группы) в среднем составило 0,16 ± 0,08. Период до второго рецидива составил в среднем 29,29 ± 15,24 дня. Рецидивы происходили на фоне повторного заболевания ОРВИ (3 случая), перенесенной черепно-мозговой травмы (ЧМТ) (сотрясение головного мозга) и на фоне резкого снижения гормональной терапии (1 больной). В одном случае обострение было моносимптомным (резкое снижение остроты зрения до амавроза) и в 4 случаях полисимптомным (атаксия, нистагм, интенционный тремор, гемипарез) и по длительности были относительно короткими (10,5 ± 2,02 дня). В последующем за время наблюдения (в среднем в течение 450,0 ± 270,0 дней) рецидивов больше не отмечалось ни у одного ребенка.
Длительность наблюдения за детьми, перенесшими ОДЭМ, составила в среднем 26,81 ± 3,94 мес. 33 пациента (66%) выздоровели полностью; у 5 детей (10%) были легкие двигательные нарушения, которые можно было выявить только при детальном неврологическом обследовании; у 2 (4%) были нарушения в поведении и расходящееся косоглазие; у 3 детей (6%) отмечалась умеренно выраженная слабость и атаксия; у 5 (10%) — тетрапарез и атаксия, ходьба была возможна только при поддержке; 2 ребенка (4%) имели грубые двигательные нарушения (тетраплегию).
Диагностика. Диагноз ОДЭМ и МДЭМ часто ставится по типичной клинической картине, к сожалению, нет патогномоничных маркеров.
Анализ спинномозговой жидкости (ЦСЖ) в 25% случаев выявляет повышение внутричерепного давления и плеоцитарный цитоз с лимфоцитами, нейтрофилами, значительным числом эритроцитов, отражающих микрогеморрагический процесс, но в 75% случаев может быть без изменений. Олигоклональный IgG в ЦСЖ у детей с ОДЭМ встречается реже, чем при РС. Частота обнаружения олигоклональных IgG при ОДЭМ составляет от 3% до 29% случаев.
Нейровизуализация. Многоочаговое поражение на МРТ головного мозга аналогично тому, что наблюдается при РС. Но имеются некоторые различия, помогающие отличить РС от ОДЭМ:
Бембеева Р. Ц., доктор медицинских наук, профессор
РГМУ, Москва
Хроническая воспалительная демиелинизирующая полинейропатия (ХВДП) (информация для пациента)
Хроническая воспалительная демиелинизирующая полинейропатия (ХВДП)
Что означают эти термины?
Каковы причины развития заболевания?
Причины развития ХВДП до сих пор полностью не изучены. Однако результаты многочисленных исследований и эффективность иммуномодулирующей терапии указывают на нарушение работы иммунной системы, как ключевой причины развития заболевания. Иммунная система представляет собой очень сложный и гармоничный механизм. Ключевыми звеньями иммунной системы являются антитела, ряд белков сыворотки крови и белые клетки крови, лейкоциты. В норме иммунная система борется с чужеродными агентами (белки, вирусы, бактерии). Однако при ряде заболеваний (аутоиммунные заболевания) компоненты иммунной системы по ошибке начинают работать против собственного организма. К одним из таких заболеваний и относится ХВДП. В данном случае развивается реакция против компонентов оболочки периферических нервов, что проявляется в виде специфических симптомов, характерных для ХВДП.
В качестве триггерных факторов описаны респираторно-вирусные заболевания, оперативные вмешательства, беременность, вакцинация и другие причины, тем не менее прямая связь вышеуказанных факторов с развитием заболевания пока не доказана.
Возможна ли передача заболевания по наследству?
Нет. Существует ряд исследований, в которых выявлены гены, предполагаемые в развитии заболевания. Тем не менее, пока не доказано их участие в риске развития заболевания у потомков.
Как проявляется ХВДП и в чем особенности этого заболевания?
Точный механизм ХВДП до конца не раскрыт ввиду комплексности иммунных реакций, а потому симптоматика и характер течения заболевания могут варьировать. Отсюда выделены так называемые атипичные формы ХВДП, которые несколько отличаются от классического течения заболевания и могут иметь особенности прогноза и лечения. Диагностика таких форм может быть затруднена. К атипичным формам ХВДП относят:
На основании чего мне установили диагноз ХВДП?
Ключевым в постановке диагноза является клинический осмотр неврологом. Существуют критерии заболевания, предложенные Европейской федерацией неврологических сообществ в 2010 г. Для подтверждения диагноза и исключения альтернативных причин полинейропатии обычно проводится ряд лабораторных анализов, а также инструментальные методы исследования. К сожалению, до сих пор нет “золотого” стандарта диагностики, который с высокой точностью мог бы указывать на «ХВДП». Поэтому диагноз зачастую ставится на основании клинической картины и результатов исследования.
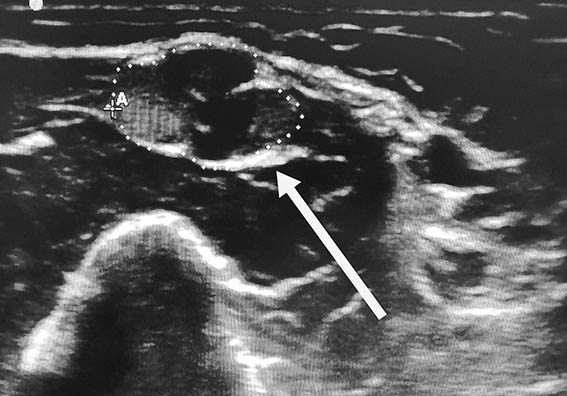
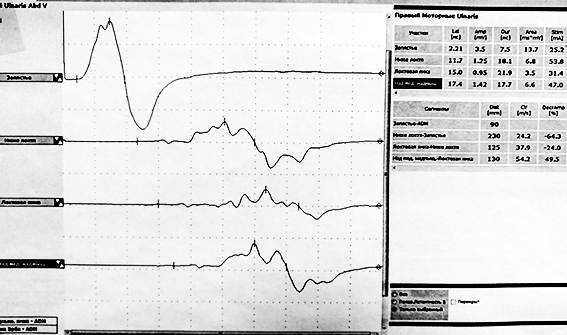
Ключевым инструментальным методом диагностики ХВДП, как и любой полинейропатии, является электронейромиография. Это исследование проводимости периферических нервов при помощи коротких электрических импульсов, передающихся по ходу нерва. Стимуляция приводит к сокращению мышцы, иннервируемой исследуемым нервом, которое регистрируется электродом.
Если данных для установки диагноза окажется недостаточно, могут дополнительно проводиться МРТ сплетений, анализ спинномозговой жидкости, УЗИ периферических нервов и в редких случаях биопсия нерва. К одним из критериев правильности установленного диагноза относится улучшение состояния, либо приостановление прогрессирования заболевания на фоне патогенетической терапии.
Какие варианты лечения ХВДП существуют?
До 80% пациентов с ХВДП имеют эффект от терапии, модулирующей работу иммунной системы. На основании крупных исследований в лечении ХВДП доказанную эффективность имеют следующие варианты лечения:
Ни один из известных на сегодняшний день препаратов не излечивает ХВДП, только позволяет снизить активность заболевания, предупредить от дальнейшего ухудшения или обострения, а также уменьшить выраженность симптомов. Кроме того, ответ на лечение у разных людей может различаться.
Каждый способ лечения имеет свои плюсы и минусы, которые обговариваются врачом, учитывая все индивидуальные особенности?
Аналогичными по эффективности глюкокортикостероидам являются препараты человеческого иммуноглобулина, однако последние гораздо реже сопряжены с развитием побочных эффектов, а потому более безопасны. Пожалуй, главным недостатком такого лечения является его высокая стоимость. Препараты человеческого иммуноглобулина получают путем очистки большого количества (>10,000 л) человеческой плазмы (>1000 доноров), что обуславливает их дороговизну. Лечение заключается в ежемесячном курсовом внутривенном введении препарата. Курс обычно занимает 4-5 дней. В дальнейшем частота введения препарата может варьироваться в зависимости от его эффективности. Важным моментом является выбор препарата. Необходимо обратить внимание на его основные характеристики: препарат должен подходить для проведения высокодозной внутривенной иммунотерапии, содержание IgG должно быть не менее 95%, количества IgA и IgM должны быть следовыми. При этом количество IgA должно быть четко обозначено в инструкции, так как именно с этим классом иммуноглобулинов ассоциировано развитие аллергических реакций.
Третьим вариантом лечения является высокообъемный плазмаферез. Данный способ терапии представляет собой забор плазмы с патогенными антителами через катетер и восполнение ее стерильными растворами, белковыми растворами и/или донорской плазмой. Процедура повторяется около 5 раз, обычно с интервалом через день. Эффект от такого лечения сохраняется на протяжении 3-4 недель. Учитывая его сложность, такой способ терапии не используется для длительного лечения и часто бывает полезен в случае стремительного и\или тяжелого обострения.
У некоторых больных, несмотря на грамотное лечение, заболевание всё равно может прогрессировать или не поддаваться контролю. В этих случаях назначаются иммунодепрессанты (микофенолата мофетил, азатиоприн, циклоспорин, циклофосфамид) или моноклональные антитела (ритуксимаб). Назначение данных препаратов должно исходить от врача, имеющего опыт их применения, учитывая все показания и противопоказания, с последующим тщательным контролем эффективности и безопасности терапии.
Нужно ли вносить какие-либо изменения в привычный образ жизни?
Да. Существуют ряд рекомендаций для больных с диагнозом ХВДП:
Каковы прогнозы при данном заболевании?
Если у вас есть симптомы полинейропатии или вам поставлен диагноз «Полинейропатия» или «ХВДП», вы можете пройти комплексное обследование в Центре заболеваний периферической нервной системы ФГБНУ НЦН, где вам помогут уточнить диагноз, выявить причины поражения периферических нервов и назначат терапию с позиций доказательной медицины.
Сотрудники центра заболеваний периферической нервной системы консультируют пациентов амбулаторно в рамках ОМС и на коммерческой основе.
ЗАПИСЬ НА ПРИЕМ И ЭНМГ/иЭМГ ПО МНОГОКАНАЛЬНОМУ ТЕЛЕФОНУ
+7 (495) 374-77-76
+7 (985) 931-60-24




