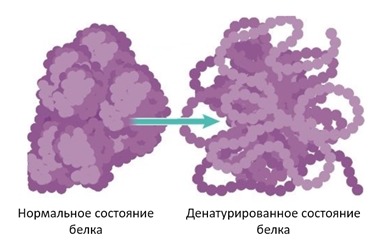
денатурированный белок что это
Денатурация белков
Денатурация белков (от лат. de- — приставка, означающая отделение, удаление и лат. nature — природа; не путать с лат. denaturatus — лишенный природных свойств) — термин биологической химии, означающий потерю белками их естественных свойств (растворимости, гидрофильности и др.) вследствие нарушения пространственной структуры их молекул.
Процесс денатурации отдельной белковой молекулы, приводящий к распаду её «жёсткой» трёхмерной структуры, иногда называют плавлением молекулы.
Содержание
Механизмы денатурации
Практически любое заметное изменение внешних условий, например, нагревание или обработка белка щелочью приводит к последовательному нарушению четвертичной, третичной и вторичной структур белка. Обычно денатурация вызывается повышением температуры, действием сильных кислот и щелочей, солей тяжелых металлов, некоторых растворителей (спирт), радиации и др.
Денатурация часто приводит к тому, что в коллоидном растворе белковых молекул происходит процесс агрегации частиц белка в более крупные. Визуально это выглядит, например, как образование «белка» при жарке яиц.
Ренатурация
Ренатурация (высаливание) — процесс, обратный денатурации, при котором белки возвращают свою природную структуру. Нужно отметить, что не все белки способны ренатурировать; у большинства белков денатурация необратима.
См. также
Ссылки
Полезное
Смотреть что такое «Денатурация белков» в других словарях:
денатурация белков — – явление разрушения нативной (вторичной, третичной и четвертичной) структуры белка под действием химических и физико химических факторов … Краткий словарь биохимических терминов
Денатурация белков — * дэнатурацыя бялкоў * denaturation of proteins разворачивание белковой молекулы, потеря ею четвертичной, третичной и вторичной структур под действием высокой температуры или ионных детергентов, таких как содиумдодецил сульфат. Переход из… … Генетика. Энциклопедический словарь
денатурация белков — (иск. лат. denaturare лишать природных свойств) изменение естественных свойств белков при изменении физ. и хим. условий среды (температуры, давления и т. п.), проявляющееся в понижении растворимости белков, повышении вязкости их растворов,… … Словарь иностранных слов русского языка
ДЕНАТУРАЦИЯ БЕЛКОВ — потеря, изменение естественных свойств белков (растворимости, гидрофильности, вязкости и т. д.) вследствие нарушения естественной вторичной и третичной структур под влиянием высокой температуры, действия сильных кислот и щелочей, тяжелых металлов … Словарь ботанических терминов
Денатурация — Денатурация лишение естественных свойств Денатурация биополимеров изменение структуры их молекул, приводящее к потере их естественных свойств: Денатурация белков Денатурация нуклеиновых кислот Денатурация продуктов изменение… … Википедия
денатурация — и, ж. dénaturation f. 1. Изменение природной структуры молекулы белка, нуклеиновой кислоты и других биополимеров при воздействии физических и химических свойств среды (температуры, давления и т. п.). БАС 2. Белки природных продуктов называют… … Исторический словарь галлицизмов русского языка
ДЕНАТУРАЦИЯ — (от лат. De приставка, означающая удаление, утрату, и nаtura природные свойства), утрата природной (нативной) конфигурации молекулами белков, нуклеиновых к т и др. биополимеров в результате нагревания, химич. обработки и т. п. Обусловлена… … Биологический энциклопедический словарь
денатурация — и, мн. нет, ж. ( … Словарь иностранных слов русского языка
Денатурация — белков (от Де. и лат. natura природные свойства, сущность), характерное для белковых веществ изменение их строения и естественных свойств при изменении физических и химических условий среды: при повышении температуры, изменении… … Большая советская энциклопедия
денатурация — см. денатурировать; и; ж. Денатура/ция белков. Денатура/ция спирта … Словарь многих выражений
Денатурированный белок что это
Под денатурацией понимают утрату трехмерной конформации, присущей данной белковой молекуле. Это изменение может носить временный или постоянный характер, но и в том, и в другом случае аминокислотная последовательность белка остается неизменной. При денатурации молекула развертывается и теряет способность выполнять свою обычную биологическую функцию. Вызывать денатурацию белков могут разнообразные факторы, перечисленные ниже.
Нагревание или излучение белка, например инфракрасное или ультрафиолетовое. Кинетическая энергия, сообщаемая белку, вызывает вибрацию его атомов, вследствие чего слабые водородные и ионные связи разрываются,и белок свертывается (коагулирует).
Сильные кислоты, щелочи, соли денатурируют белок. Под действием этих реагентов ионные связи разрываются и белок коагулирует. Длительное воздействие реагента может вызвать разрыв и пептидных связей.
Тяжелые металлы денатурируют белок. Положительно заряженные ионы тяжелых металлов (катионы) образуют прочные связи с отрицательно заряженными карбоксил-анионами R-групп белка и часто вызывают разрывы ионных связей. Они также снижают электрическую поляризацию белка, уменьшая его растворимость. Вследствие этого находящийся в растворе белок выпадает в осадок.
Органические растворители и детергенты денатурируют белок. Эти реагенты нарушают гидрофобные взаимодействия и образуют связи с гидрофобными (неполярными) группами. В результате разрываются и внутримолекулярные водородные связи. Использование спирта в качестве дезинфицирующего средства основано именно на том, что он вызывает денатурацию белка любых присутствующих бактерий.
Ренатурация белков
Иногда денатурированный белок в подходящих условиях вновь спонтанно приобретает свою нативную структуру. Этот процесс называется рена-турацией. Ренатурация убедительно показывает, что третичная структура белка полностью определяется его первичной структурой и что сборка биологических объектов может осуществляться на основе немногих общих принципов.
Современный блог для специалистов пищевой промышленности
Денатурация белков. Что же это такое?
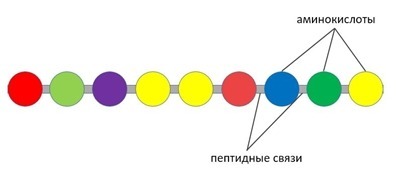
Белок – жизненно необходимый продукт для человека. Белки состоят из аминокислот. У каждой аминокислоты есть аминогруппа и кислотная (карбоксильная) группа, при взаимодействии которых получается пептидная связь, поэтому белки еще называют полипептидами.
Животные и растительные белки существенно различаются по аминокислотному составу и уровню биологической ценности. Аминокислотный состав мышечных и молочных белков близок к составу белков человека; большая часть белков животного происхождения является полноценной, тогда как растительные — из-за относительно низкого содержания в них лизина, триптофана, треонина и других незаменимых аминокислот – неполноценны.
Пищевая ценность животных белков идентична ценности белков мяса, они имеют приблизительно такой же состав и сбалансированность аминокислот. Благодаря химическому составу и функциональным свойствам, животные белки являются альтернативой и могут использоваться при производстве мясных продуктов с целью полноценной замены мяса, повышения пищевой и биологической ценности.
Полноценность белка
Для нормальной жизнедеятельности взрослого человека количество незаменимых аминокислот в суточном белковом рационе должно составлять 36-40%, что обеспечивается при соотношении животных белков к растительным, равном 55:45. При этом, годовая потребность в полноценном белке составляет от 20 до 26 кг.
К основным незаменимым аминокислотам относят валин, лейцин, изолейцин, триптофан, метионин, лизин, фенилаланин и треонин. Тирозин, цистеин, аргинин и гистидин — считают условно незаменимыми (или частично заменимыми), так как в организме они синтезируются довольно медленно. Установлено, что дефицит незаменимых аминокислот в питании может приводить к весьма тяжелым последствиям.
По степени соответствия количественного содержания отдельных незаменимых аминокислот (НАК) в составе белкового компонента продукта их содержанию в эталонном белке судят о его биологической ценности, определяя так называемый аминокислотный скор (АКС).
Аминокислотный состав эталонных белков определен в результате многолетних медико-биологических исследований, сбалансирован с учетом потребностей конкретного контингента в каждой НАК, в связи с чем иногда эталонный белок называют «идеальным».
Аминокислотный скор выражают в процентах или в виде безразмерной величины, представляющих собой отношение содержания каждой НАК в исследуемом белке к ее количеству в эталонном белке. Аминокислоты, скор которых составляет менее 100% (либо 1.0), считают лимитирующими. НАК, скор которой имеет самое низкое значение, называется первой лимитирующей аминокислотой. Значение скора именно этой аминокислоты предопределяет биологическую ценность и степень усвоения белков.
Таким образом, показатель аминокислотного скора устанавливает предельно возможный уровень использования азота данного вида белка для пластических целей. Избыток других имеющихся в составе белка аминокислот будет использоваться как источник неспецифического азота либо для энергетических потребностей организма.
При этом следует отметить, что с позиций рационального питания доля энергии, выделяющейся при биологическом окислении белка в организме не должна превышать 10% от общей калорийности суточного рациона.
Денатурация белков
Природные белковые тела наделены определенной, строго заданной пространственной конфигурацией и обладают рядом характерных физико-химических и биологических свойств при физиологических значениях температуры и рН среды. Под влиянием различных физических и химических факторов белки подвергаются свертыванию и выпадают в осадок, теряя нативные свойства.
Денатурация белков (от лат.de- — приставка, означающая отделение, удаление и лат. nature — природа; не путать с лат. denaturatus — лишенный природных свойств) — потеря белками их естественных свойств (растворимости, гидрофильности и др.) вследствие нарушения пространственной структуры их молекул.
Денатурация – это процесс нарушения высших уровней организации белковой молекулы (вторичного, третичного, четвертичного) под действием различных факторов.
При этом полипептидная цепь разворачивается и находится в растворе в развернутом виде или в виде беспорядочного клубка. При денатурации утрачивается гидратная оболочка и белок выпадает в осадок и при этом утрачивает нативные свойства.
Денатурацию вызывают физические факторы: температура, давление, механические воздействия, ультразвуковые и ионизирующие излучения; химические факторы: кислоты, щелочи, органические растворители, алкалоиды, соли тяжелых металлов.
Необратимая денатурация – это процесс, при котором биологическая активность не восстанавливается после удаления денатурирующих агентов. Процесс денатурации отдельной белковой молекулы, приводящий к распаду её «жёсткой» трёхмерной структуры, иногда называют плавлением молекулы (к примеру жаренное яйцо).
Денатурация: особенности процесса, влияющие факторы, механизмы и последствия
Что такое белки?
Человеческий организм нуждается в различных типах молекул, и наиболее важными являются молекулы белков, которые содержат азот и состоят из аминокислот. Молекулы белка образуют основной строительный блок мышц и других тканей в организме человека. Их название указывает на то, что они имеют решающее значение для здоровья человека. Слово «белок» происходит от греческого «протеос», что означает «первый» или «первом месте». Каждый белок имеет свое место действия и задачи, которые он выполняет. Функции белка можно разделить на 9 основных:
Молекулы белка имеют разные размеры, в зависимости от количества аминокислот. Малые молекулы включают, например, инсулин из 51 аминокислоты, в то время как очень большие молекулы включают титан из почти 27 000 аминокислот.Однако размер молекул не имеет значения, для правильного функционирования они должны быть в подходящей форме. Каждый тип белка имеет уникальную форму, которая определяет роль белка в организме. Попробуйте представить белки как ключи, которые принадлежат только определенным дверям в человеческом организме.
Человеческий метаболизм расщепляет белки на более простые частицы – аминокислоты. 20 аминокислот необходимы для роста мышц и обмена веществ, 11 из которых не являются необходимыми. Это означает, что наш организм может создавать их сам, и их не нужно употреблять в пищу. Остальные аминокислоты помечены как незаменимые, и организм человека получает их из пищи и пищевых добавок. Мышечная ткань не может расти или регенерировать без них.
Что такое денатурация белка?
Денатурация – это процесс, при котором структура белковой молекулы нарушается, тем самым теряя свою функцию. Различия в форме белка могут быть вызвать:
Денатурация меняет форму белка, но последовательность аминокислот остается прежней. Цель протеина в форме пищевой добавки состоит в том, чтобы восполнить достаточное количество белка, и чтобы пищеварительная система могла разрушиться, тем самым снабжая мышечную ткань. Эта функция не теряется при термообработке белков.
Хорошим примером также является белок пепсин, который действует как фермент и расщепляет белки в желудке. Он работает только при низком pH, теряет свою функцию в среде с высоким pH и денатурирует. По этой причине pH желудка поддерживается на очень низком уровне, чтобы обеспечить правильное функционирование пепсина.
Тепло используется для разрыва водородных связей и неполярных гидрофобных взаимодействий в молекуле белка. Более высокая температура увеличивает кинетическую энергию и заставит молекулы вибрировать очень быстро, пока связи между ними не будут разрушены. Молекула белка разворачивается из своей трехмерной структуры, обеспечивая лучший доступ пищеварительного фермента к белковым связям.
Вот почему мы готовим продукты, чтобы изменить структуру белка и облегчить его переваривание. Например, этот процесс происходит, когда вы готовите яйца. В это время белок из яиц денатурируется и во время варки. После употребления вареных яиц переваривание и усвоение содержащихся в них питательных веществ происходит быстрее. Вы можете быть удивлены тем, что такой же процесс происходит при стерилизации медицинских инструментов. Тепло денатурирует белки в бактериях, которые затем уничтожают бактерии и дезинфицируют объекты.
Особенности процесса
Он сопровождается разворачиванием полипептидной связи, которая в растворе изначально представлена в виде беспорядочного клубка.
Процесс денатурации белка сопровождается утрачиванием гидратной оболочки, выпадением белка в осадок, утрачиванием им нативных свойств.
Среди основных факторов, которые провоцируют процесс денатурации, выделим физические параметры: давление, температуру, механическое действие, ионизирующее и ультразвуковое излучение.
Денатурация белка происходит под воздействием органических растворителей, минеральных кислот, щелочей, солей тяжелых металлов, алкалоидов.
Свойства денатурированных белков, виды денатурации
При денатурации утрачивается гидратная оболочка и белок выпадает в осадок и при этом утрачивает нативные свойства.
Денатурацию вызывают физические факторы: температура, давление, механические воздействия, ультразвуковые и ионизирующие излучения; химические факторы: кислоты, щелочи, органические растворители, алкалоиды, соли тяжелых металлов.
Различают 2 вида денатурации:
Свойства денатурированных белков:
Ферментные методы гидролиза основаны на избирательности действия протеолитических ферментов расщепляющих пептидные связи между определенными аминокислотами.
Пепсин расщепляет связи, образованные остатками фенилаланина, тирозина и глутаминовой кислоты.
Трипсин расщепляет связи между аргинином и лизином.
Химотрипсин гидролизует связи триптофана, тирозина и фенилаланина.
Гидрофобные взаимодействия, а также ионные и водородные связи относятся к числу слабых, тк энергия их лишь ненамного превосходит энергию теплового движения атомов при комнатной температуре(т е уже при данной температуре возможен разрыв связей ).
Поддержание характерной для белка конформации возможно благодаря возникновению множества слабых связей между различными участками полипептидной цепи.
Факторы, вызывающие денатурацию белков
Факторы, которые вызывают денатурацию белков, можно разделить на физические и химические.
Воздействие факторами денатурации применяют для стерилизации оборудования и инструментов, а также как антисептики.
Что происходит в процессе денатурации белков
Лучшие органические солнцезащитные кремы: критерии выбора
В процессе денатурации белка имеет место разрыв химических связей (дисульфидных, водородных, ван-дер-ваальсовых, электростатических и др.), которые стабилизируют высшие уровни организации белковой молекулы, что обуславливает изменение пространственной структуры белка. Следует отметить, то в большинстве случаев первичная структура белка в процессе денатурации не нарушается, поэтому после раскрутки цепи полипептидов (стадия нити), протеин может снова стихийно скручиваться, при этом образуя «случайный клубок», то есть переходит к хаотическому состоянию, отличного от нативной конформации.
Процесс денатруации белков происходит при температуре выше, чем 56 °С.
Типичными признаками необратимой денатурации белков является снижение гидрофильности и растворимости белков, увеличение оптической активности, изменение изоэлектрической точки, уменьшение устойчивости белковых растворов и молекулярной массы и изменение формы белковых молекул, увеличение вязкости и усиление способности к расщеплению ферментами, переход молекулы в хаотическое состояние, при котором наблюдается агрегация частиц белка и выпадение их в осадок.
Схема денатурации белка: а — нативная молекула; б — развертывание полипептидной цепи; в — стадия нити; г — случайный клубок
При непродолжительном действии денатурирующего агента (например, органического растворителя) возможно восстановление нативной структуры белка. Этот процесс называется ренатурацией. При ренатурации происходит восстанавлениене только структуры, но и биологических функций белка. С денатурацией связаны процессы переработки продуктов питания, изготовления одежды, обуви, консервирования и сушки овощей и фруктов. Результатом необратимой денатурацией протеинов является потеря способности к прорастанию семян при длительном хранении, особенно при неблагоприятных условиях. Процесс денатурации белков широко применяется в медицине, ветеринарии, фармации, клинике и биохимических исследованиях с целью осаждения протеина в биологическом материале с целью дальнейшей идентификации в нем низкомолекулярных и небелковых субстанций, с целью как установления наличия протеина, так и его количественного определения, для обеззараживания слизистых покровов и кожи, для конъюгации солей тяжелых металлов при терапии отравлений солями свинца, ртути, меди и т.п. или с целью профилактики подобных токсикозов на предприятии.
Процесс денатурации белков происходит также при приеме фармакологических препаратов танальбина и танина, на чем базируются их противовоспалительное и вяжущее действие. Вяжущие свойства танина базируются на его способности осаждать протеины с синтезом плотных альбуминатов, защищающих от раздражения тканей, в частности чувствительные нервные окончания. При этом уменьшается проявление воспалительной реакции, а также снижаются болевые ощущения и происходит непосредственное уплотнение мембран клеток. Препарат танальбин представляет собой продукт взаимодействия белка казеина с танином — в отличие от танина, данный препарат не оказывает вяжущего действия на слизистую оболочку желудка и ротовой полости. Только после попадания в кишечник он поддается процессу расщепления, выделяя при этом свободный танин. Применяется в медицине и ветеринарии как вяжущее лекарственное средство при хронических и острых болезнях кишечника, в частности у детей.
В практике фармацевтики использование процессов денатурации белка дает возможность контролировать качество протеиновых препаратов, например, в ампулах.
Последствия
После денатурации происходит переход нативной компактной структуры в рыхлую развернутую форму, упрощается проникновение к пептидным связям ферментов, необходимых для разрушения.
Конформация белковых молекул определяется возникновением достаточного количества связей между разными участками определенной полипептидной цепочки.
Белки, состоящие из достаточного количества атомов, которые находятся в непрерывном хаотичном движении, способствует определенным перемещениям частей полипептидной цепи, что вызывает нарушение общей структуры белков, снижение его физиологических функций.
Белки имеют конформационную лабильность, то есть предрасположенность к незначительным изменениям конформации, происходящим в результате обрыва одних и образования других связей.
Денатурация белка приводит к изменениям его химических свойств, способности вступать во взаимодействие с другими веществами. Наблюдается изменение пространственной структуры и участка, непосредственно контактирующего с иной молекулой, и всей конформацией в целом. Наблюдаемые конформационные изменения имеют значение для функционирования белков в живой клетке.
Механизмы денатурации
Практически любое заметное изменение внешних условий, например, нагревание или обработка белка щелочью приводит к последовательному нарушению четвертичной, третичной и вторичной структур белка. Обычно денатурация вызывается повышением температуры, действием сильных кислот и щелочей, солей тяжелых металлов, некоторых растворителей (спирт), радиации и др.
Денатурация часто приводит к тому, что в коллоидном растворе белковых молекул происходит процесс агрегации частиц белка в более крупные. Визуально это выглядит, например, как образование «белка» при жарке яиц.
Денатурированный белок что это
Этот вопрос регулярно поднимается на множестве популярных ресурсов, посвященных бодибилдингу. Ряд источников приписывают неденатурированному белку противораковую, иммуномодулирующую, антиоксидантную активность, улучшение показателей уровня сахара в крови и позитивное влияние на синтез белка в мышцах спортсмена [1,2,3], и конечно же, по всем этим показателям «обычный» денатурированный протеин показан в худшем свете. Неудивительно, что подобная информация активно обсуждается на форумах [4,5], а производители выпускают специальные серии протеина с соответствующей пометкой на упаковке [6].
Насколько обоснованы такие заявления? Давайте разбираться.
Белок и его структура
Белок, он же протеин, он же полипептид – это цепочка из аминокислот, которые соединены между собой пептидными связями [7]. Это так называемая первичная структура белка.
Рис. 1 Первичная структура белка
Аполипопротеин С1, участвующий в обмене холестерина, состоит из 57 аминокислот [8], а вот титин, один из важных белков мышц человека, имеет длину около 35 000 аминокислот [9].
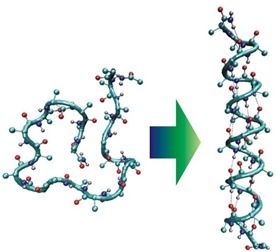
Следующем уровнем организации белковой молекулы является вторичная структура, которая стабилизирована другим типом связей – водородными [7]. В рамках вторичной структуры рассматриваются связи между близлежащими аминокислотами.
Рис. 2 Переход от первичной к вторичной структуре белка [10]
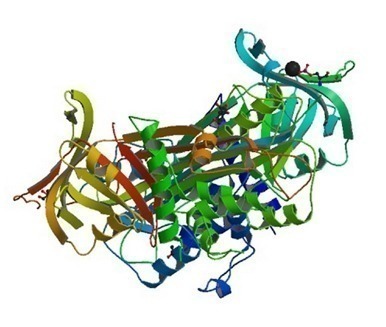
Когда же необходимо рассмотреть способ укладки всей белковой молекулы, в том числе и связи между относительно удаленными аминокислотами, то речь идет о третичной структуре. В поддержании такой структуры задействовано несколько видов химических связей – гидрофобные, водородные, электростатические и т.д. [11].
Рис. 3 Третичная структура белка. Овальбумин, один из белков куриного яйца [12]
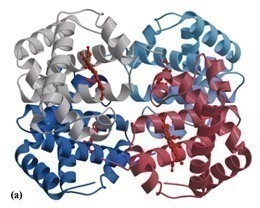
Некоторые протеины представляют собой комплекс из нескольких белковых цепей (в данном случае именуемых субъединицами), которые объединены вместе и в таком виде выполняют свои функции. Для описания таких комплексов используется понятие «четвертичная структура белка». Примером такого комплекса является гемоглобин, который переносит кислород в крови и состоит из 4 субъединиц 2 типов, по 2 субъединицы каждого типа.
Рис. 4 Четвертичная структура гемоглобина. 4 субъединицы выделены разными цветами [7]
Протеины становятся функциональными только после завершения формирования трехмерной структуры, когда все необходимые химические связи будут установлены и белок приобретет свой характерный вид.
Денатурация белка
В строгом биохимическом смысле денатурацией называют потерю белком своих функциональных свойств по причине нарушения трехмерной структуры. Денатурация не обязательно означает полное развертывание до цепочки и принятие неупорядоченной структуры, существует множество промежуточных состояний. Иногда критично нарушение буквально нескольких связей.
Рис. 5 Денатурация белка [14 с изменениями]
Однако важно заметить, что при денатурации не меняется первичная структура белка, то есть пептидные связи остаются целыми и сам белок не расщепляется на фрагменты. Сохраняется длина молекулы, аминокислотный состав и т.д.
Денатурация может произойти под воздействием высоких температур, кислот, щелочей и т.д. [7]. Классическим примером денатурации является изменение внешнего вида белковой части куриного яйца после варки, и очевидно, что такая денатурация в домашних условиях необратима [13].
Однако в ряде случаев восстановление трехмерной структуры протеина все же возможно, и этот процесс называется ренатурацией. Свойство ренатурации используется в многих лабораторных методиках работы с белками.
Если же первичная структура белка все же нарушена, то произошла так называемая деструкция [15].
Таким образом, денатурация означает лишь изменение укладки белковой молекулы в пространстве.
Белки и пищеварение
Ок, спортсмен выпил протеиновый коктейль или съел кусок мяса. Теперь рассмотрим что происходит с белками из подобных продуктов в желудочно-кишечном тракте. Поступление пищи в желудок стимулирует секрецию гормона гастрина, который, в свою очередь, усиливает секрецию соляной кислоты (HCl) и пепсиногена – предшественника фермента пепсина, который и будет расщеплять белки из пищи [7]. Как видим, в желудке образовалась кислая среда (pH 1.0-2.5, такие значения соответствуют очень высокой кислотности), а именно такая среда является фактором, способствующим денатурации белковой молекулы.
Существуют ли белки, способные выстоять под таким кислотным воздействием? Да, существуют. К примеру, это некоторые белки клеток самого желудка [16]. Однако лактальбумин, казеин, овальбумин и другие распространенные белки из продуктов питания к кислотоустойчивым не относятся и их ждет денатурация. Собственно, после денатурации пептидные связи, спрятанные прежде в глубинах трехмерной структуры, становятся доступны для атаки различными ферментами, которые и будут эти связи разрушать. Среди таких ферментов уже упомянутый пепсин из желудочного сока. После такой обработки пища поступает в тонкий кишечник, где расщепление осуществляют уже другие ферменты – трипсин, химотрипсин, карбоксипептидазы, аминопептидазы. Разница между этими ферментами состоит в комбинациях аминокислот, связи между которыми данные ферменты разрушают.
Здесь же, в тонком кишечнике, идет всасывание продуктов пищеварения. Это одиночные аминокислоты или короткие пептиды (обычно длиной 2-4 аминокислоты) [17,18,7].
Как видим, всасывания целостной большой белковой молекулы, которая могла бы выполнять иммуномодулирующие и другие упомянутые в начале статьи функции, не происходит – белок расщепляется на короткие фрагменты.
Некоторые белки, к примеру, кератин (один из белков волос и ногтей) все же перевариваются не полностью [7], проходят по кишечнику далее и покидают организм. Какого-то особого их всасывания тоже нет.
Однако некоторая разница между пищеварением денатурированного и неденатурированного белка есть. Так, на лабораторных животных было показано [19], что переваривание сырого мяса, по сравнению с термически обработанным, занимало больше времени и требовало больше ресурсов организма. Объясняется это различие как раз денатурацией белка под воздействием высокой температуры, к примеру, во время варки.
Протеины из линеек спортивного питания, такие как казеин, сывороточный, яичный протеин и другие, быстрее усваиваются организмом человека после обработки путем гидролиза [20, 21, 22]. Гидролиз включает в себя и денатурацию, и деструкцию, то есть расщепление белка на более короткие фрагменты, но деструкция уже выходит за рамки данной статьи.
Таким образом, существует зависимость между степенью обработки белка и скоростью его усвоения [23]. Неденатурированный белок будет перевариваться дольше. Однако добиться постепенного всасывания аминокислот и коротких пептидов можно гораздо проще – подобрав соответствующий тип спортивного питания. Так, сывороточный протеин абсорбируется относительно быстро, а казеин – медленно [24]. При этом организму не придется тратить энергию на дополнительную обработку пищевого продукта. Эти же ресурсы можно направить на более важные цели – построение мышц спортсмена.
Какие-либо обоснованные преимущества неденатурированного протеина для бодибилдера в современной научной литературе не упоминаются.
Вместе с тем, денатурация протеинов происходит в рамках технологических процессов производства спортивного питания [25, 26] и, как видим, приносит пользу для последующего усвоения спортсменом таких белков.
Заключение сравнения денатурированного и неденатурировванного белка
Подводя итоги, денатурация протеина увеличивает скорость его расщепления и экономит энергию организма. Исходя из этого, в бодибилдинге определенно выгоднее использовать денатурированный белок, входящий в состав привычных продуктов спортивного питания. Ассортимент таких товаров очень широк, а стоимость ниже, по сравнению с специфическими продуктами с неденатурированным белком.
Для размещения информации из данного обзора на своих ресурсах обязательно указать наш сайт proteininkiev.com в качестве источника.
Все права защищены PROTEININKIEV TM 2018.