диагноз аха у ребенка что
Шум в сердце у ребенка
Довольно часто случается, что после очередного осмотра ребенка педиатр говорит родителям: «У Вашего ребенка в сердце шум». Стоит ли беспокоиться или нет? Насколько это может быть опасно для Вашего ребенка? Надо ли обследоваться или можно подождать? Нужно ли какое-нибудь лечение? Что можно и чего нельзя?
Попробуем разобраться. Начнем по порядку
Беспокоиться? Нет уж, давайте вначале сходим к детскому кардиологу. Педиатр даст Вам направление, а в нем – ряд совершенно непонятных терминов и сокращений. Попытаемся их расшифровать.
Поглядит внимательно – нет ли цианоза (синюшности), одышки, деформации грудной клетки, кончиков пальцев и ногтей, отеков, патологической пульсации сосудов. Проперкутирует (постучит) – не расширены ли границы сердца. Пропальпирует (прощупает) периферические сосуды, область сердца, печень и селезенку. Внимательно выслушает сердце – как и где шумит, каковы при этом сердечные тоны, куда проводится шум, нет ли каких-то сопутствующих звуков, посчитает частоту дыхания и пульса. И, скорее всего, скажет, что у Вашего малыша нет признаков недостаточности кровообращения (или нарушений гемодинамики, или сердечной недостаточности, что, в общем, почти одно и то же). Это значит, что в данный момент сердечко ребенка справляется со своей работой хорошо. Ура? Ура. Но расставаться с доктором еще рано. Скорее всего, он порекомендует провести необходимые дополнительные исследования. Зачем? А чтобы определить, откуда взялся этот шум, как наблюдать за ребенком, чего опасаться и в каком случае начинать лечить.
Теперь путь наш лежит в кабинет функциональной диагностики
Электрокардиография (ЭКГ) – это метод графической регистрации электрических явлений, возникающих в сердце. Запись ЭКГ осуществляется с помощью специального аппарата – электрокардиографа. При этом электрические потенциалы усиливаются в 600-700 раз и регистрируются в виде кривой на движущейся ленте. Регистрация ЭКГ проводится с помощью электродов, накладываемых на различные участки тела. С помощью этого метода определяются различные нарушения ритма и проводимости сердца, а также перегрузки различных его отделов.
Звуковые характеристики шумов можно оценить не только путем простой аускультации, но и с помощью такого метода исследования как фонокардиография (ФКГ). Он основан на графической регистрации звуков, сопровождающих сердечные сокращения. Регистрируются в основном тоны и шумы сердца. Получаемое при этом изображение называют фонокардиограммой. Она существенно дополняет аускультацию и дает возможность объективно определить частоту, форму и продолжительность звуков, а также их изменение в процессе динамического наблюдения за больным. Используется этот метод для диагностики функциональных шумов и пороков развития сердца. Также он важен при нарушениях ритма, когда с помощью одной аускультации трудно решить, в какой фазе сердечного цикла возникли звуковые явления. Анализ фонокардиографии и диагностическое заключение по ней проводит только специалист. При этом учитываются аускультативные данные. Для правильной трактовки ФКГ применяют синхронную запись фонокардиограммы и электрокардиограммы. Метод хорош и абсолютно безопасен, но в настоящее время на смену ему приходит
И вот в руках у Вас результаты обследования. А там – снова термины
МАРС (или МАС) – малые аномалии развития сердца. Под малыми аномалиями развития сердца подразумеваются изменения в закладке и формировании структур сердца (произошедшие в эмбриональном периоде), не нарушающие нормального функционирования сердечно-сосудистой системы. К МАРС могут быть отнесены: открытое овальное окно (ООО), минимальные (до I степени) пролапсы клапанов, дополнительные хорды и трабекулы и т.д. Решение о том, отнести найденные аномалии анатомического строения сердца к МАРС или определить их самостоятельную патологию решает кардиолог. Так, например, открытое овальное окно без значимого сброса в раннем возрасте может быть отнесено к МАРС, тогда как открытое овальное окно со значительным сбросом, признаками перегрузки правого предсердия уже следует выделять как самостоятельную патологию, требующую тщательного наблюдения и коррекции.
ПМК – пролапс митрального клапана. «Пролапс» – в переводе с латинского языка означает «прогибание». Митральный клапан – двустворчатый клапан (состоит из двух створок), расположенный между левым предсердием и левым желудочком. Таким образом под пролапсом митрального клапана (ПМК) понимают прогибание створок митрального клапана в полость левого предсердия в момент сокращения желудочков сердца.
Пролапс митрального клапана может быть самостоятельным заболеванием или встречаться на фоне другой патологии (например, патологии соединительной ткани, при врожденных пороках сердца (ВПС), вегетососудистой дистонии (ВСД), эндокринной патологии и т.д.). Но при эхокардиографическом исследовании могут обнаружиться и некоторые врожденные пороки сердца, протекающие без недостаточности кровообращения. Чаще всего это небольшие дефекты межжелудочковой перегородки (ДМЖП), как правило расположенные в ее мышечной части, дефекты межпредсердной перегородки (ДМПП), незначительные стенозы легочной артерии и аорты и другие.
В любом случае, без повторного визита к кардиологу не обойтись. Только специалист в Вашей конкретной ситуации сможет определить, какого наблюдения требует именно Ваш ребенок, в каком случае без лечения можно обойтись, а когда оно уже необходимо, какие физические нагрузки можно разрешить, а от каких лучше воздержаться. Кстати, о физических нагрузках. Довольно часто родители считают, что найденные отклонения в строении и функции сердца – повод для ограничения ребенка в движении, освобождении от занятий физкультурой. И… ошибаются. Расти, правильно развиваться сердце будет, только выполняя дозированные, адекватные для данного организма нагрузки. И, наоборот, в условиях неумеренного щажения, гиподинамии ситуация может усугубиться, темп развития сердца, да и всего организма в целом замедлится. Главное для Вашего ребенка – сердечко нагрузить, но не перенапрячь. А работа врача в данном случае в том и состоит, чтобы подобрать желательный для ребенка режим занятий физкультурой, увеличить нагрузки постепенно и вовремя проконтролировать функции сердца. Кому-то для начала хороши занятия лечебной физкультурой, а кто-то может записаться в спортивную секцию. Решать же, кому что больше подойдет, будут родители и врач.
В случае, если обнаруженная патология требует хирургической коррекции, заниматься пациентом будет уже кардиохирург. И так же, как и кардиолог-терапевт, оценит состояние гемодинамики, примет решение о сроках и объеме необходимой операции. И опять же, хотя ситуация и куда более серьезна, поводов для отчаяния нет. Гигантскими шагами идет вперед кардиохирургия, в том числе и детская. Многие операции, считавшиеся уникальными еще десять лет тому назад, стали обычным явлением, а риск их проведения для пациента снизился в десятки раз. Стала возможной коррекция некоторых пороков без операции в условиях искусственного кровообращения – в этом заслуга молодой отрасли кардиохирургии – интервенционной кардиологии.
Теперь о том, где и как можно получить детскую кардиологическую помощь в г. Москве:
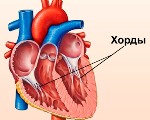
Дополнительная хорда сердца у ребенка
Дополнительная хорда сердца у ребенка — это малая аномалия развития, которая представляет собой тяж, расположенный внутри желудочка. Возникает из-за наследственной или впервые возникшей генетической мутации, нарушающей дифференцировку кардиальных тканей во внутриутробном периоде. Протекает бессимптомно либо проявляется кардиалгиями, перебоями в работе сердца, повышенной утомляемостью. План диагностических мероприятий включает ЭхоКГ, ЭКГ, постановку функциональных нагрузочных тестов. Лечение бессимптомных хорд не проводится, при развитии осложнений назначают патогенетические препараты, иногда требуется помощь детских кардиохирургов.
МКБ-10
Общие сведения
Впервые патология была описана в 1893 г. и носила название «мышечный тяж». Современный термин появился позднее благодаря расположению образования, фактически пересекающего полость желудочка. По данным эхокардиографии, частота обнаружения хорд колеблется от 0,5% до 68% в популяции, что обусловлено отсутствием единых критериев диагностики. У мальчиков аномалия встречается в 2-3 раза чаще. Поскольку формирование дополнительной хорды у детей происходит во время внутриутробного развития, тяжи могут выявляться в любом возрасте. Пики заболеваемости отсутствуют.
Причины
Аномальные тяжи являются одной из разновидностей дисплазии соединительной ткани сердца (ДСТС), поэтому четкие этиологические факторы их появления не установлены. В современной педиатрии считается, что возникновение малых аномалий связано с действием неблагоприятных факторов в раннем внутриутробном периоде развития плода. Среди основных причин патологии можно выделить следующие:
Патогенез
Основная теория заключается в том, что образование дополнительной мышечной трабекулы происходит в процессе эмбрионального развития ребенка. Тяжи формируются из внутреннего слоя миокарда при отшнуровке сосочковых мышц. При нарушении дифференцировки клеток часть из них идет на создание папиллярных структур, а оставшиеся клетки организуются в добавочные хорды и располагаются внутри полости желудочка.
Морфологические изменения при дисплазии характеризуются изменениями структуры коллагеновых и эластиновых волокон, нарушением нормального соотношения гликопротеидов, протеогликанов и фибробластов. При этом наблюдается патология пространственной организации белков и белково-углеводных комплексов. Ряд авторов отводят важную роль гипомагниемии в патогенезе хорд и вызываемых ими симптомов.
Классификация
Выделение вариантов внутрисердечных хорд — дискутабельный научный вопрос, поскольку на сегодняшний день существует несколько классификаций. Гистологические исследования секционного материала дают возможность разделить тяжи в сердце на 3 вида:
Среди фиброзно-мышечных до 4,7% составляют образования, которые содержат проводящие кардиомиоциты.
А.А. Корженков предложил разделить хорды на 5 вариантов по локализации. Самые частые из них: поперечные (до 60% случаев) и диагональные (30-35%). К редким разновидностям внутрисердечных тяжей относят продольные (2-3%), множественные (1-2%), с тремя и более точками прикрепления (до 1%). Дополнения классификации включают определение длины и толщины образования, его расположения относительно основных анатомических ориентиров.
Симптомы
Для добавочных хорд сердца у детей характерна вариабельность течения: от бессимптомных вариантов, выявляющихся при инструментальной диагностике по другому поводу, до явных признаков нарушений сердечной деятельности и общего состояния. По наблюдениям врачей, малые аномалии являются основной причиной наличия функциональных сердечных шумов, которые хотя бы раз в жизни диагностируются у каждого второго-третьего ребенка.
Около 50% больных с дополнительными хордами иногда испытывают боли в сердце. Ребенок жалуется на покалывание, ноющие или давящие ощущения, которые не имеют четкой связи с физическими или эмоциональными нагрузками. Примерно с такой же частотой возникают аритмии, которые ощущаются как сильное сердцебиение или, наоборот, замирание сердца на несколько секунд, что сопровождается ухудшением самочувствия.
У многих детей наблюдается плохая переносимость физических нагрузок, утомляемость после коротких спортивных занятий в школе. При интенсивных тренировках возможны обмороки, длительное усиленное сердцебиение, повышенный прилив крови и жара к голове. Иногда ребенок ощущает нехватку воздуха, вследствие чего он начинает делать быстрые и глубокие вдохи. Среди атипичных эквивалентов одышки называют частую зевоту, покашливание, першение в горле.
Поскольку ДСТС обычно комбинируется с другими стигмами дизэмбриогенеза, у ребенка могут быть нарушения формы черепа и лица, неправильный разрез глаз, асимметрия туловища и конечностей. Изредка добавочные хорды выступают одним из проявлений синдрома Марфана: в таком случае ребенок имеет характерное астеническое телосложение, обвисшую истонченную кожу и другие патогномоничные симптомы.
Осложнения
Дополнительные хорды в 73% случаев ассоциированы с синдромом ранней реполяризации желудочков, что повышает риск развития пароксизмальной наджелудочковой тахикардии. При наличии ДСТС в 4-6 раз чаще встречается феномен предвозбуждения желудочков (Вольфа-Паркинсона-Уайта), который провоцирует тяжелые аритмии. Прослеживается четкая закономерность: чем ближе к базальной части межжелудочковой перегородки расположен тяж, тем выше его аритмогенность.
Ребенка с дополнительной хордой в сердце намного чаще беспокоят синкопальные состояния, обусловленные пароксизмами нарушений сердечного ритма и расстройствами регуляции сосудистого тонуса. У 30% обнаруживают геморрагический синдром, который развивается на фоне мезенхимальной дисплазии. Он проявляется кровоточивостью десен, частыми носовыми кровотечениями, у девочек-подростков дополнительной жалобой становятся длительные и обильные менструации.
Диагностика
При стандартном клиническом обследовании у детского кардиолога обнаруживаются неспецифические признаки кардиопатологии. Пальпация и перкуссия не дают ценных сведений, а при аускультации врач зачастую выявляет у ребенка функциональные систолические шумы. Для визуализации малых аномалий и детальной оценки сердечной деятельности эффективны следующие диагностические методы:
Лечение дополнительной хорды сердца у ребенка
Если дополнительная хорда не сопровождается нарушениями работы сердца, в детской кардиологии придерживаются выжидательной тактики, периодически проводят повторные обследования. Большинству пациентов с дополнительной сердечной хордой не требуется специальное лечение. Наличие кардиалгий, аритмий и других симптомов — показание к назначению патогенетической и симптоматической терапии. При комбинированных дисплазиях сердечной ткани требуется консультация кардиохирурга.
Прогноз и профилактика
В большинстве случаев хорды существуют бессимптомно или малосимптомно, не влияют на повседневную жизнь пациента. Прогноз благоприятный, если у ребенка отсутствуют другие дисплазии или пороки сердца. При наследственных или мультифакторных нарушениях соединительной ткани прогноз ухудшается. Учитывая неясность этиопатогенетических особенностей ДСТС, меры профилактики не разработаны.
Публикации в СМИ
Аномалии развития сердца малые
Малые аномалии развития сердца (МАРС) — анатомические врождённые изменения сердца и магистральных сосудов, не приводящие к грубым нарушениям функций ССС. Ряд МАРС имеет нестабильный характер и с возрастом исчезает. Частота — 2,2–10% в популяции, у детей с различной сердечной патологией — 10–25%, увеличивается при наследственных заболеваниях соединительной ткани. Преобладающий возраст — дети первых 3 лет жизни. Этиология. Наследственно детерминированная соединительнотканная дисплазия. Ряд МАРС имеют дизэмбриогенетический характер. Не исключается воздействие различных экологических факторов (химическое, физическое воздействие).
Варианты. В литературе описано около 40 вариантов МАРС. Наиболее часто наблюдают • Эктопические трабекулы • Пролапс митрального клапана • Пролапс трикуспидального клапана • Открытое овальное окно • Длинный евстахиев клапан (заслонка) — нерудиментированная складка эндокарда (элемент эмбрионального кровообращения), расположенная в устье нижней полой вены со стороны полости правого предсердия, длиной от 1 до 2 см. Обычно случайно находят при ЭхоКГ • Аневризма межпредсердной перегородки — выпячивание межпредсердной перегородки в области овальной ямки, не вызывающее гемодинамических нарушений. Клинически при аускультации — систолические щелчки • Аневризма межжелудочковой перегородки — выбухание межжелудочковой перегородки в сторону правого желудочка. При аускультации — систолический шум и клики слева у основания грудины • Дилатация корня аорты и синусов Вальсальвы — расширение устья аорты (у детей в норме — 1,2–2,4 см) и синусов (в норме глубина — 1,5–3 мм). Аускультативно — непостоянные систолические «щелчки», иногда шум «волчка» на сосудах шеи.
Сопутствующая патология • Синдром Марфана • Синдром Элерса–Данло–Русакова • Первичный гипогонадизм • Синдром Бехчета • Врождённые пороки сердца (ВПС) • Аритмии сердца • Инфекционный эндокардит • Клапанная регургитация.
Диагностические критерии • Анамнестические данные (профессиональные вредности, алкоголизм матери в период беременности, заболевания соединительной ткани в семье и др.) • Признаки диспластического развития (внешние малые аномалии развития — короткая шея, высокое нёбо и др.) • Характерная аускультативная картина в зависимости от варианта МАРС • Изменения на ЭКГ • ЭхоКГ-критерии • Рентгенологические критерии.
Дифференциальная диагностика • ВПС • Большие аномалии развития сердца.
Функциональная значимость • Зависит от возраста пациента, варианта МАРС, наличия сопутствующих заболеваний • Маркёр дизэмбриогенетического развития сердца • Предрасполагают к развитию аритмий, клапанной регургитации, левожелудочковой дисфункции.
Лечение определяют вариант МАРС и сопутствующая патология.
Сокращение. МАРС — малые аномалии развития сердца
МКБ-10. Q20.9 Врождённая аномалия сердечных камер и соединений неуточненная
Примечание. Большие аномалии развития сердца — анатомические изменения сердца и магистральных сосудов, сопровождающиеся грубыми нарушениями функций ССС (например, пролапс митрального клапана с регургитацией III степени).
Код вставки на сайт
Аномалии развития сердца малые
Малые аномалии развития сердца (МАРС) — анатомические врождённые изменения сердца и магистральных сосудов, не приводящие к грубым нарушениям функций ССС. Ряд МАРС имеет нестабильный характер и с возрастом исчезает. Частота — 2,2–10% в популяции, у детей с различной сердечной патологией — 10–25%, увеличивается при наследственных заболеваниях соединительной ткани. Преобладающий возраст — дети первых 3 лет жизни. Этиология. Наследственно детерминированная соединительнотканная дисплазия. Ряд МАРС имеют дизэмбриогенетический характер. Не исключается воздействие различных экологических факторов (химическое, физическое воздействие).
Варианты. В литературе описано около 40 вариантов МАРС. Наиболее часто наблюдают • Эктопические трабекулы • Пролапс митрального клапана • Пролапс трикуспидального клапана • Открытое овальное окно • Длинный евстахиев клапан (заслонка) — нерудиментированная складка эндокарда (элемент эмбрионального кровообращения), расположенная в устье нижней полой вены со стороны полости правого предсердия, длиной от 1 до 2 см. Обычно случайно находят при ЭхоКГ • Аневризма межпредсердной перегородки — выпячивание межпредсердной перегородки в области овальной ямки, не вызывающее гемодинамических нарушений. Клинически при аускультации — систолические щелчки • Аневризма межжелудочковой перегородки — выбухание межжелудочковой перегородки в сторону правого желудочка. При аускультации — систолический шум и клики слева у основания грудины • Дилатация корня аорты и синусов Вальсальвы — расширение устья аорты (у детей в норме — 1,2–2,4 см) и синусов (в норме глубина — 1,5–3 мм). Аускультативно — непостоянные систолические «щелчки», иногда шум «волчка» на сосудах шеи.
Сопутствующая патология • Синдром Марфана • Синдром Элерса–Данло–Русакова • Первичный гипогонадизм • Синдром Бехчета • Врождённые пороки сердца (ВПС) • Аритмии сердца • Инфекционный эндокардит • Клапанная регургитация.
Диагностические критерии • Анамнестические данные (профессиональные вредности, алкоголизм матери в период беременности, заболевания соединительной ткани в семье и др.) • Признаки диспластического развития (внешние малые аномалии развития — короткая шея, высокое нёбо и др.) • Характерная аускультативная картина в зависимости от варианта МАРС • Изменения на ЭКГ • ЭхоКГ-критерии • Рентгенологические критерии.
Дифференциальная диагностика • ВПС • Большие аномалии развития сердца.
Функциональная значимость • Зависит от возраста пациента, варианта МАРС, наличия сопутствующих заболеваний • Маркёр дизэмбриогенетического развития сердца • Предрасполагают к развитию аритмий, клапанной регургитации, левожелудочковой дисфункции.
Лечение определяют вариант МАРС и сопутствующая патология.
Сокращение. МАРС — малые аномалии развития сердца
МКБ-10. Q20.9 Врождённая аномалия сердечных камер и соединений неуточненная
Примечание. Большие аномалии развития сердца — анатомические изменения сердца и магистральных сосудов, сопровождающиеся грубыми нарушениями функций ССС (например, пролапс митрального клапана с регургитацией III степени).
Последствия перинатального поражения центральной нервной системы с атонически–астатическим синдромом
Общая информация
Краткое описание
Союз педиатров России
Год утверждения (частота пересмотра): 2016 (пересмотр каждые 3 года)
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Этиология и патогенез
Наиболее частыми причинами последствий перинатального поражения ЦНС с атонически- астатическим синдромом являются перинатальные поражения центральной нервной системы гипоксически-ишемического генеза: церебральная ишемия II, III степени, внутричерепное кровоизлияние II, III степени. Поражение лобных долей, мозжечка, лобно-мосто-мозжечкового пути.
Наиболее часто геморрагический инфаркт и ишемия развиваются у плодов и новорожденных в области перивентрикулярных сплетений – субэпендимально в сочетании с поражением вещества мозга. Кровоизлияние может происходить также в боковые желудочки мозга и в субарахноидальное пространство. Помимо описанных изменений, морфологическим субстратом гипоксии, как правило, является полнокровие мозга, его общий или локальный отек.
В патогенезе гипоксически-травматических и гипоксически-ишемических энцефалопатий причины и следствия меняются местами, переплетаются в сложных «порочных кругах». Нарушение гемодинамики (макро- и микроциркуляции) приводят к многовариантным метаболическим сдвигам (нарушение кислотно-основного состояния и электролитного баланса, дестабилизация клеточных мембран, гипоксемия и тканевая гипоксия), а эти сдвиги в свою очередь усугубляют расстройства микроциркуляции.
У недоношенных детей повреждающее действие внутриутробной гипоксии потенцируется незрелостью сосудов головного мозга, дезадаптацией в интранатальном периоде.
Установлено, что повреждающее воздействие различных факторов может реализоваться как в форме быстрой гибели клетки (нейрональный некроз), так и в форме отсроченной, замедленной гибели – апоптоз.
Эпидемиология
Диагностика
• Раннюю диагностику формирующегося детского церебрального паралича рекомендуется проводиться на первом году жизни ребенка: при своевременном выявлении у него задержки моторного и психо-речевого развития, нарушений мышечного тонуса, повышении сухожильных рефлексов, несвоевременной редукции безусловных рефлексов и задержке формирования установочных реакций [6, 7, 18].
Комментарии: для проведения дифференциального диагноза с болезнями обмена веществ
Дифференциальный диагноз
Лечение
— Гинкго двулопастного листьев экстракт (Код АТХ: N06DX02) 0,02 на в 2 приема, курс 2 месяца.
— Витамины (В1, В6, В12)
Медицинская реабилитация
Клиническое значение малых аномалий развития сердца у детей
В последние годы большое внимание уделяется дисплазии соединительной ткани (ДСТ) у детей. Под ДСТ понимают врожденную аномалию соединительно-тканной структуры различных органов и систем, в основе которой лежит снижение содержания отдельных
В последние годы большое внимание уделяется дисплазии соединительной ткани (ДСТ) у детей. Под ДСТ понимают врожденную аномалию соединительно-тканной структуры различных органов и систем, в основе которой лежит снижение содержания отдельных видов коллагена и/или нарушение их соотношения, приводящее к снижению прочности соединительной ткани [12, 13, 24, 26].
В развитии ДСТ принимают участие эндогенные (хромосомные и генетические дефекты) и экзогенные (неблагоприятная экологическая обстановка, неадекватное питание, стрессы) факторы [12, 30, 43]. Особенность морфогенеза соединительной ткани заключается в том, что она участвует в формировании каркаса сердца практически на всех этапах онтогенеза, следовательно, влияние любого повреждающего фактора может привести к развитию ДСТ сердца [15].
В 1990 г. в классификации заболеваний сердечно-сосудистой системы Нью-Йоркской ассоциации кардиологов, а также в Омске, на симпозиуме, посвященном проблеме дисплазии соединительной ткани, был впервые выделен синдром ДСТ сердца, сопровождающий как дифференцированные, так и недифференцированные ДСТ. При синдроме ДСТ сердца в патологический процесс вовлекается его соединительно-тканный каркас — сердечные клапаны (атриовентрикулярные, полулунные, евстахиев клапан), подклапанный аппарат, перегородки сердца и магистральные сосуды.
В клинической практике, когда речь идет о морфологической основе изменений сердечно-сосудистой системы без гемодинамических нарушений, Ю. М. Белозеровым (1993) и С. Ф. Гнусаевым (1995) вместо термина «ДСТ сердца» был предложен другой — «малые аномалии развития сердца» (МАРС) [3, 8]. Согласно определению этих авторов, МАРС считаются анатомические изменения архитектоники сердца и магистральных сосудов, не приводящие к грубым нарушениям функций сердечно-сосудистой системы [9].
Классификация МАРС по С. Ф. Гнусаеву, 2001 (с изменениями)
предсердия и межпредсердная перегородка: пролабирующий клапан нижней полой вены, увеличенный евстахиев клапан более 1 см, открытое овальное окно, небольшая аневризма межпредсердной перегородки, пролабирующие гребенчатые мышцы в правом предсердии;
трикуспидальный клапан: смещение септальной створки в полость правого желудочка в пределах 10 мм, дилатация правого атриовентрикулярного отверстия, пролапс трикуспидального клапана;
легочная артерия: дилатация ствола легочной артерии, пролапс створок;
аорта: погранично узкий и широкий корень аорты, дилатация синуса Вальсальвы, двустворчатый клапан аорты, асимметрия и пролапс створок клапана аорты;
левый желудочек: трабекулы (поперечная, продольная, диагональная), небольшая аневризма межжелудочковой перегородки;
митральный клапан: пролапс митрального клапана, эктопическое крепление хорд, нарушенное распределение хорд передней и (или) задней створки, «порхающие» хорды, дополнительные и аномально расположенные папиллярные мышцы.
До сих пор нет единого мнения о клиническом значении МАРС, многие из которых имеют нестабильный характер, связанный с ростом ребенка. Так, возможно обратное развитие увеличенного евстахиева клапана, пролабирующих гребенчатых мышц в правом предсердии, пролапса митрального клапана (ПМК), закрытие открытого овального окна, нормализация длины хорд митрального клапана и диаметра магистральных сосудов. В ряде случаев МАРС изменяются не только в качественном, но и в количественном отношении [3]. Превышение установленного порогового уровня сердечной стигматизации у здоровых детей (более 3 МАРС), по мнению С. Ф. Гнусаева (1995), свидетельствует о возможном неблагополучии как в отношении факторов, влияющих на формирование здоровья, так и показателей, характеризующих его [8].
Учитывая, что МАРС являются вариантом висцеральных ДСТ, дети, как правило, имеют выраженный полиморфизм клинико-морфологических нарушений, зависящий от степени ДСТ и вовлечения в патологический процесс других органов и систем. Выявлена ассоциативная связь между числом внешних фенотипических маркеров ДСТ и МАРС [12, 16, 21, 22]. При этом имеют значение не только число внешних фенотипических маркеров, но и «диагностический вес» каждого из них. Отмечено, что дисплазии кожи и скелета наиболее часто сочетаются с МАРС [12].
Клиническая значимость патологии соединительной ткани у лиц с ДСТ подтверждается данными о высокой частоте нейровегетативных расстройств, изменений центральной нервной системы (энурез, дефекты речи, вегетососудистая дистония (ВСД)), нарушений психики [5, 12, 24]. Как правило, у таких пациентов всегда выявляется ВСД, что, вероятно, обусловлено наследуемыми (наследственными) особенностями структуры и функции лимбико-ретикулярного комплекса, определяющими аномальный характер нейровегетативных реакций [12]. Е. В. Буланкиной (2002) установлена отчетливая взаимосвязь между вегетативной дисфункцией и ДСТ [4]. При этом выраженность диспластических изменений сочеталась с тяжестью процессов дезадаптации регуляторных механизмов и снижением стрессовой устойчивости организма. Наиболее распространенными проявлениями вегетативной дисфункции являются цефалгии, вегетативные кризы, вегетовисцеральные пароксизмы, пре- и синкопальные состояния [12, 16]. Согласно данным С. Ф. Гнусаева (1995), у лиц с ПМК выявлена недостаточность сегментарных вегетативных структур [8]. Исследования Т. М. Домницкой (2000) позволили установить прямую зависимость между ПМК, аномально расположенными трабекулами (АРТ) и распространенностью невротических (невротические реакции, невроз навязчивых состояний, панические расстройства) и энцефалопатических (церебрастенический синдром, заикание, тики, нарушения сна, энурез, гипердинамический синдром, страхи) расстройств [10].
Нередко МАРС сопровождают такие патологические состояния, как нарушения сердечного ритма и проводимости, в том числе синдром ранней реполяризации, синдром слабости синусового узла, синдром Вольф–Паркинсон–Уайта, повышение электрической активности левого желудочка, блокада правой ножки пучка Гиса, экстрасистолия и пароксизмальная тахикардия [4, 6, 8, 34]. По данным Л. А. Балыковой и соавт. (2002), у 90% больных с нарушениями сердечного ритма с помощью эхографии были выявлены МАРС (преимущественно ПМК) [2]. Однако не все МАРС сопровождаются нарушениями сердечного ритма и (или) могут являться их причиной. К аритмогенным МАРС относятся фиброзно-мышечные аномально расположенные хорды (АРХ) и АРТ, ПМК и пролапс трикуспидального клапана (ПТК), аневризма межпредсердной перегородки, увеличенный и/или пролабирующий евстахиев клапан.
Наличие проводящих кардиомиоцитов в фиброзно-мышечных АРХ и АРТ формирует дополнительные проводящие пути, чем объясняется происхождение импульса, опережающего внутрижелудочковое проведение и вызывающего раннее возбуждение прилежащих к нему сегментов с последующей их более ранней реполяризацией [12, 15, 19, 20, 28]. Имеется гистологическое подтверждение наличия проводящих клеток в АРТ с диагонально-базальной, срединно-поперечной и продольной локализацией и в АРХ, соединяющих базальные септальные отделы и боковую стенку левого желудочка [3, 10, 33]. M. Suwa и соавт. (1986) отметили возрастание частоты желудочковых экстрасистол с увеличением толщины хорды. По мнению E. Chesler и соавт. (1983), появление желудочковых экстрасистол связано с миксоматозно измененными хордами, вызывающими механическое раздражение стенки левого желудочка [27]. Факт аритмогенности АРХ и АРТ также подтверждается исчезновением у пациентов экстрасистолии в случае их самостоятельного разрыва или оперативного рассечения либо при физической нагрузке, когда уменьшается степень их натяжения [8, 10, 12]. Довольно распространенным нарушением сердечного ритма при АРХ и АРТ является и синдром раннего возбуждения желудочков [6, 12].
Аритмии при ПМК и ПТК, по данным разных авторов, встречаются от 15 до 90% случаев [11]. Среди причин аритмий рассматриваются вегетативные дисфункции, механическая стимуляция эндокарда, дефицит внутритканевого магния, психологический стресс и миксоматозная дегенерация створок клапанов [3, 10–12, 18, 27, 29, 37, 39]. Установлена прямая корреляционная зависимость между частотой, а также степенью тяжести нарушений ритма и глубиной ПМК [1]. Ряд авторов полагают, что причиной развития аритмий при ПМК и ПТК может являться турбулентный поток, возникающий в результате регургитации через клапанное кольцо во время систолы желудочков, особенно при ПТК, когда происходит механическое раздражение зоны синусового узла [3, 8, 23]. Возможным механизмом развития желудочковых экстрасистол при ПМК большинство исследователей считают избыточное натяжение папиллярных мышц вследствие их аномальной тракции при пролабировании створок [12, 14, 25, 38].
Развитие аритмий может провоцировать пролабирующий евстахиев клапан и аневризма межпредсердной перегородки: условия для возникновения аритмий возникают в результате их холмистых движений и рефлекторного раздражения ими пейсмекерных образований в правом предсердии [42].
Согласно исследованиям О. А. Дианова (1999), нарушения сердечного ритма встречались у детей с погранично узкой аортой, у которых в 32,4% случаев регистрировалась суправентрикулярная и в 10,8% — желудочковая экстрасистолии, свидетельствующие о декомпенсации адаптации, особенно в условиях физической нагрузки [4].
По данным Ю. М. Белозерова, дети с МАРС отличаются сниженными возможностями кардиогемодинамики и демонстрируют плохую переносимость физических нагрузок [3]. По данным Н. А. Мазура, установлена связь между ПМК и синдромом внезапной смерти у взрослых. Накоплено достаточно сведений о том, что дети с МАРС относятся к группе риска по развитию инфекционного эндокардита.
Таким образом, существующие результаты исследований о том, что МАРС в ряде случаев являются основой кардиоваскулярной патологии у детей. В то же время неоправданным было бы преувеличение их роли в функциональных нарушениях сердечно-сосудистой системы. Очевидно, в каждом конкретном случае значимость структурных аномалий сердца должна рассматриваться индивидуально.
Принципы терапии детей с МАРС еще до конца не сформулированы. Однако на сегодняшний день можно предложить следующую тактику ведения детей с МАРС:
Общепризнанным является применение немедикаментозных методов лечения, включающих:
Вопрос о допуске к занятиям спортом решается индивидуально. При наличии ПМК необходимо учитывать семейный анамнез (случаи внезапной смерти у родственников), наличие жалоб на сердцебиения, кардиалгии; синкопальные состояния; изменения на ЭКГ (нарушения сердечного ритма, синдром укороченного и удлиненного QT) являются основанием для принятия решения о противопоказании спортивных тренировок. Это касается и наличия АРХ, АРТ с синдромом раннего возбуждения желудочков, которые, являясь аритмогенными МАРС, могут спровоцировать нарушения сердечного ритма у спортсменов в условиях физического и психоэмоционального напряжения.
Медикаментозное лечение включает применение:
В настоящее время терапия препаратами магния при МАРС приближается к патогенетической. Это обусловлено тем, что магний входит в состав основного вещества соединительной ткани и необходим для правильного формирования волокон коллагена. В условиях магниевой недостаточности нарушается способность фибробластов продуцировать коллаген [29, 31]. Кроме того, магний оказывает мембраностабилизирующее действие, удерживает калий внутри клетки, препятствует симпатикотоническим влияниям, что делает возможным его применение для лечения нарушений сердечного ритма [40, 41].
В работах О. Б. Степуры (1999), О. Д. Остроумовой и соавт. (2004) имеются сведения о достоверном уменьшении степени ПМК, симптомов ВСД, количества желудочковых экстрасистол на фоне терапии препаратами магния [17, 18].
Целесообразным может быть признано назначение следующих препаратов:
Магнерота, содержащего соль магния и оротовую кислоту. Последняя не только усиливает реабсорбцию Mg в кишечнике, но и обладает самостоятельным метаболическим действием. Детям назначают по 500 мг магнерота (32,8 мг магния 3 раза в день в течение 1 нед, затем 250 мг 3 раза в день в течение последующих 5 нед. Принимается препарат за 1 ч до еды).
Магне В6. Выпускается в таблетках (48 мг магния или в растворе для приема внутрь (100 мг магния). Детям с массой тела более 10 кг (старше 1 года) — 5–10 мг/кг/сутки в 2–3 приема. Детям старше 12 лет — 3–4 табл. в сут, в 2–3 приема. Продолжительность курса 6–8 нед.
Калия оротата. Детям препарат назначают из расчета 10–20 мг/кг/сут в 2–3 приема за 1 ч до еды или через 4 ч после еды. Продолжительность курса — 1 мес.
Следует проводить повторные курсы терапии этими препаратами (3–4 раза в год).
Для улучшения клеточной энергетикии миокарда применяют препараты, обладающие комплексным влиянием на метаболические процессы в организме, а также являющиеся активными антиоксидантами и мембраностабилизаторами:
Кроме указанных препаратов для улучшения метаболических процессов в соединительной ткани, миокарде и в организме в целом показано применение:
Показаны повторные курсы лечения (до 3 раз в год).
При наличии ВСД проводится комплексная длительная терапия по восстановлению баланса между симпатическим и парасимпатическим отделами вегетативной нервной системы (дифференцированная фитотерапия, вегетотропные препараты, ноотропы, вазоактивные препараты — кавинтон, вазобрал, инстенон, циннаризин и др.).
Таким образом, все вышесказанное позволяет сделать вывод, что МАРС, являясь висцеральным проявлением дисплазии соединительной ткани, составляют морфологическую основу функциональных изменений сердечной деятельности и нейровегетативных расстройств. Выбор индивидуальной программы курсового лечения способствует улучшению обменных процессов в соединительной ткани и профилактирует возможные осложнения ДСТ у детей и подростков.
По вопросам литературы обращайтесь в редакцию.
Н. А. Коровина, доктор медицинских наук, профессор
А. А. Тарасова, кандидат медицинских наук, доцент
Т. М. Творогова, кандидат медицинских наук, доцент
Л. П. Гаврюшова, кандидат медицинских наук, доцент
М. С. Дзис
РМАПО, Москва