диагноз фку что это
Фенилкетонурия
Общие сведения
Фенилкетонурия относится к наследственным заболеваниям из группы ферментопатий. Она связана с нарушением обмена ароматических аминокислот, а конкретно — фенилаланина. Если человек с этим заболеванием не соблюдает низкобелковую диету, то в его организме происходит накопление фенилаланина и продуктов метаболизма, обладающих токсическим действием на ЦНС, которое в свою очередь вызывает поражения нервных структур и приводит к нарушениям умственного развития. Возникает фенилпировиноградная олигофрения по аутосомно-рецессивному типу наследования, однако на сегодняшний день это одно из немногих наследственных заболеваний, которое поддается успешному лечению.
Распространённость не зависит от гендерного различия, но отличается у разных групп населения. Однако, риску летального исхода более подвержены мальчики возрастом до 1 года.
В европеоидной расе и среди жителей Америки фенилкетонурия встречается у 1 человека на 10-15 тыс. Наиболее высокая частота случаев зарегистрирована у граждан Турции: 1 из 2,60 тыс. Финляндия и Япония отличается наиболее низкой частотой встречаемости данного недуга не более 1 человека на 120 тыс. рождений. Сенсацией были данные исследований 1987 г, когда среди представителей цыганских популяций в Словакии был обнаружен сверхвысокий уровень фенилкетонурии, вызванный предположительно инбридингом: болезнь выявляли у каждого 4-ого ребенка.
Историческая справка
В 1934 г норвежским врачом Иваром Асбьёрном Феллингом была выявлена гиперфенилаланинемия. Она оказалась ассоциирована с задержкой умственного развития. У жителей Норвегии заболевание называлось в честь его открывателя — болезнь Фёллинга.
Методика успешного лечения фенилкетонурии впервые была разработана в стенах Бирмингемского детского госпиталя (Англия). Ее разработал Хорст Биккель со своей командой медиков в начале пятидесятых годов двадцатого века. Однако, больший успех терапия имела, когда удалось широко применять раннюю диагностику недуга, вызванного повышенным содержанием фенилаланина в кровяном русле новорождённых по методу Гатри, разработанному и внедренному в 1958-1961 годах.
Фенилкетонурия, что это за заболевание?
Название происходит от двух названий химических соединений – фенилаланина и кетонов, а также греческого слова uron означающего – моча. Это заболевание вызывает расстройства движений и тонуса мышц, а также отставание физического развития и прогрессирующее слабоумие, поэтому еще называется фенилпировиноградной олигофренией.
На начальных этапах фенилкетонурия никак себя не проявляет и протекает бессимптомно. Тревожными знаками становится манифестация симптомов в виде сонливости и плохо аппетита у детей 6-12 месяцев. Такие дети отличаются от родственников и ровесников слишком светлой кожей, блондинистыми волосами и голубым цветом глаз. Также характерным симптомом становится развитие сыпи, напоминающей дерматит или экзему. Отсутствие лечения приводит к заметной, значительно выраженной задержке умственного развития, поэтому очень важно выявить болезнь на первых годах жизни, пока не успели произойти необратимые патологические изменения.
Патогенез
Как незаменимая аминокислота – фенилаланин является протеиногенной и играет важную роль в построении белковых молекул всех живых организмов, обеспечивая стабилизацию белковых структур и фолдинг (нативную укладку), являясь составным звеном функциональных центров. Необходим для синтеза гормонов щитовидной железы (в большей мере — тироксина), а также адреналина и меланина.
Метаболический блок превращения фенилаланина в тирозин приводит к его накоплению и активации побочных путей его обмена (например, печенью), в результате чего в тканях организма аккумулируются его токсичные производные — фенилпировиноградная, фениломолочная и другие кетоновые кислоты, в норме которых практически не должно образовываться. Помимо этого, происходит синтез ортофенилацетата и фенилэтиламина – соединений также почти полностью отсутствующих при нормальном метаболизме, причем производные последнего являются психоделиками и психостимуляторами. Наличие их в избытке инициирует нарушение обмена жиров в структурах головного мозга. Считается, что именно этот фактор вызывает прогрессирующее снижение интеллекта и может привести в самой глубокой степени умственной отсталости — идиотии. На сегодняшний день остаются до конца невыясненными механизмы развития нарушений работы мозга, вызванные фенилкетонурией. Предположительно, этому способствует дефицит нейромедиаторов (серотонина, дофамина) в синапсах мозга на фоне прямого токсического действия фенилаланина и относительного снижения количества тирозина и прочих «крупных» аминокислот, способных конкурировать с фенилаланином в процессах переноса через гематоэнцефалический барьер.
Гиперфенилаланинемия приводит к нарушениям обмена липо- и гликопротеидов, аминокислотного равновесия как жидкостных сред, так и клеточных структур. В основе клинических проявлений также лежат нарушения метаболизма гормонов, обмена моноаминовых нейромедиаторов таких как катехоламины и серотонин.
Разлад функции печени выражен в виде диспротеинемии, генерализованной гипераминоацидемии, метаболического ацидоза, нарушения белковосинтезирующей и окислительной деятельности клеточных органелл.
Классификация
Различают типичную (классическую) и атипичные формы (варинатные, коферментзависимые, злокачественные — на них приходится примерно 10% случаев) фенилкетонурии в связи с генетической и клинической неоднородностью аномалий обмена фенилаланина, а также кофактора — биоптерина.
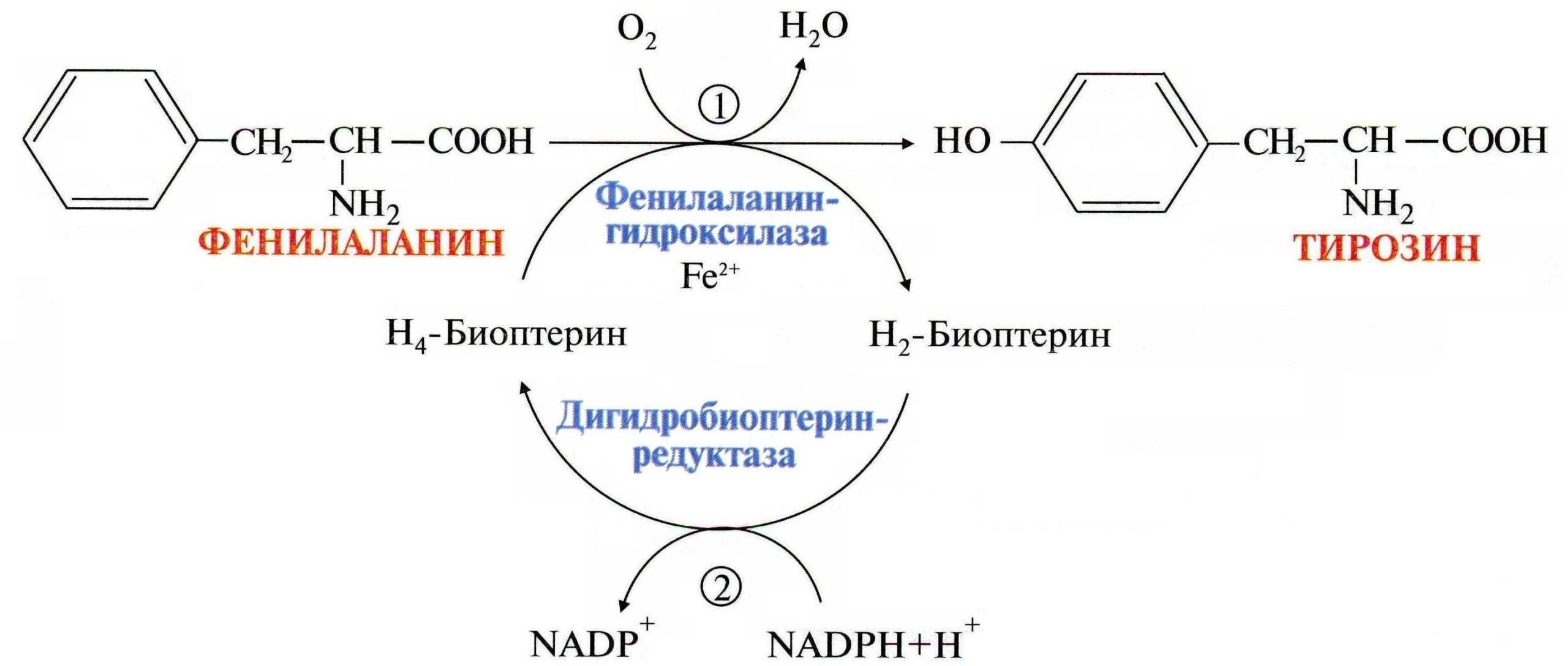
Причиной второй диеторезистентной атипичной формы фенилкетонурии является дефицит дигидроптеридинредуктазы в результате генного дефекта локализующегося на участке 4р 15.3 хромосомы. Открыл ее Смит в 1974 году. Энзимный дефект нарушает процесс восстановление активной формы тетрагидробиоптерина, принимающего участие в виде кофактора при гидроксилировании фенилаланина в тирозин, а также предшественников нейромедиаторов серотонинового и катехоламинового ряда, таких как L-ДОФА и 5-окситриптофан.
Фенилкетонурию 3 диеторезистентную описал Кауфман в 1978 г. (согласно источнику Википедия). Она отличается недостаточностью 6-пирувоил тетрагидроптерин синтетазы, принимающей участие в синтезе тетрагидробиоптерина.
Атипичные формы отличаются прогрессированием проявлений заболевания.
Другие формы патологии связаны с нарушением иных альтернативных путей метаболизма фенилаланина с формированием метилминдальной ацидурии и парагидроскифенилуксусной ацидурии.
Причины возникновения фенилкетонурии
Благодаря накоплению опыта в области диагностики и лечения фенилкетонурии с течением времени стало понятно, что причины возникновения этого наследственного недуга кроются в мутациях гена, кодирующего фенилаланин-4-гидроксилазу — 12q23.2. Тип наследования аутосомно-рецессивный.
Чаще всего болезнь вызвана резко сниженной или полностью отсутствующей активностью такого фермента печени как фенилаланин-4-гидроксилаза, которая в норме необходима для катализации превращения (гидроксилирования) фенилаланина в аминокислоту — тирозин.
Обмен фенилаланина и тирозина
Однако, примерно в 10% случаев гиперфенилаланинемии воздействую атипичные факторы, связанные с мутациями в иных генах, кодирующих ферменты, обеспечивающие синтез кофактора фенилаланингидроксилазы, известного как тетрагидробиоптерин (BH4).
Симптомы фенилкетонурии
Фенилкетонурия отличается достаточно ярко выраженной клинической картиной, включающей такие симптомы как:
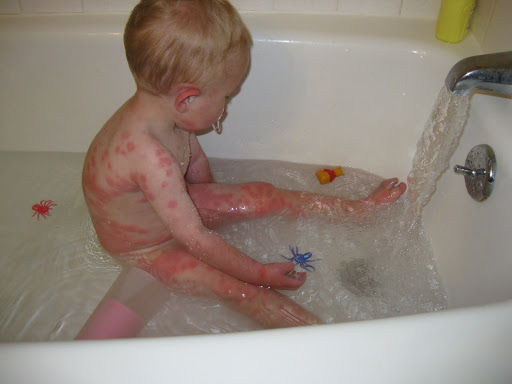
Экзема при фенилкетонурии
Психические нарушения
Фенилкетонурия вызывает значительные патологические изменения обменных процессов в головном мозге, что влечет за собой следующие нарушения:
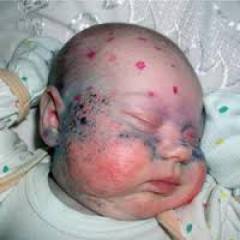
Как можно увидеть на фото больных фенилкетонурией телосложение их обычно диспластическое, размеры черепа уменьшены, отмечается гипогенитализм и нанизм.
Анализы и диагностика
В основе диагностики фенилкетонурии лежат лабораторные анализы крови и мочи, изучают биоптаты печени, а также проводят генетические исследования:
На 3-4 сутки жизни новорожденного наиважнейшим в обнаружении обменных врождённых заболеваний оказывается неонатальный скрининг посредством анализов крови. Этот этап делает возможным обнаружить фенилкетонурию и как можно раньше начать лечение, чтобы предотвратить необратимые последствия. В РФ таким детям устанавливается категория инвалидности до 18 лет.
Лечение фенилкетонурии
Наиболее благоприятным оказывается прогноз при ранней диагностике заболевания. Если же недуг выявляется поздно, то практически невозможно справиться с уже резвившимися необратимыми изменениями тканей мозга.
В основе лечения фенилкетонурии – строгая диета, ограничивающая животные и растительные белки, которая должна длиться минимум до полового созревания, а может и пожизненно. Постоянно нужно быть в контакте с лечащим врачом, который будет мониторить состояния и психологически поддерживать пациента. При отмене диеты регулярно проводят психологические тесты, электроэнцефалограмму и определяют уровень фенилаланина в кровяном русле. Процесс ослабления диеты начинают примерно в 8-10 лет, когда заканчиваются процессы миелинизации мозга.
В случаях некоторых (мягких) форм заболевания возможно лечение кофактором (тетрагидробиоптерином) при поражённом ферменте — фенилаланингидроксилазе. Перспективными считаются разработки новых подходов лечения фенилкетонурии — использования заместительной терапии с применением фенилаланинлиазы (PAL, пегвалиазы) — растительного фермента, завершающего метаболизм фенилаланина безвредными метаболитами, а также генотерапия, в основе которой введение в организм вирусного вектора с геном фенилаланингидроксилазой. Такие методы не смогли пока выйти из стен лабораторных исследований.
При атипичных формах, не поддающихся диетотерапии, лечение сводится к введению препаратов тетрагидробиоптерина либо его синтетических аналогов, к примеру, сапроптерина.
Наиболее перспективной методикой лечения данного тяжелого заболевания является генотерапия как классический образец успешной борьбы и организационной помощи при наследственных патологиях.
Часто задаваемые вопросы
Фенилкетонурия (ФКУ) – довольно редкое наследственное заболевание, связанное с нарушением обмена аминокислот. Организм больного фенилкетонурией человека не способен расщеплять аминокислоту фенилаланин, которая поступает с белковой пищей. В результате этого, в тканях накапливаются соединения, отравляющие нервную систему и головной мозг в частности. Развивается умственная отсталость (малоумие), вплоть до идиотии. В связи с этим болезнь получила и другое название – фенилпировиноградная олигофрения.
Однако из всех наследственных заболеваний фенилкетонурия, единственное, которое удается полностью нейтрализовать. Сегодня ребенка, рожденного с признаками ФКУ, можно вырастить абсолютно здоровым. Обезопасить мозг малыша удается с помощью специальной диеты, о которой мы расскажем ниже.
В разных странах частота этого заболевания отличается в разы. В России рождается один больной ребенок на 10 000. В некоторых регионах Великобритании этот показатель в два раза выше – 1:5000. Дети на Африканском континенте практически не болеют фенилкетонурией. Среди больных количество девочек почти в два раза превышает количество мальчиков.
Механизм развития заболевания
Причина возникновения этого заболевания связана с тем, что в печени человека не вырабатывается особый фермент – фенилаланин-4-гидроксилаза. Он отвечает за превращение фенилаланина в тирозин. Последний входит в состав пигмента меланина, ферментов, гормонов и необходим для нормальной работы организма.
Симптомы фенилкетонурии

Если же момент упущен, и ребенок употребляет в пищу белковые продукты, богатые фенилаланином, то начинают проявляться симптомы поражения центральной нервной системы. Поначалу изменения у больных фенилкетонурией незначительны. Их трудно заметить даже опытному педиатру. Это слабость и беспокойство. Малыш не улыбается и мало двигается.
К шести месяцам задержка развития становится более заметной. Ребенок слабо реагирует на происходящее, не узнает мать, не пытается сесть и перевернуться. Фенилаланин и его производные выводятся из организма с мочой и потом. Они вызывают специфический «мышиный» или затхлый запах.
Годовалый ребенок не умеет выражать голосом свои эмоции и переживания, имеет невыразительную мимику, не понимает речь родителей.
В возрасте трех лет и старше симптомы фенилкетонурии нарастают. У детей наблюдается повышенная возбудимость, утомляемость, нарушения поведения, психотические расстройства, умственная отсталость. Если не заниматься лечением фенилкетонурии, то состояние больного будет ухудшаться.
Диагностика фенилкетонурии

На сегодняшний день все новорожденные дети массово обследуются на наличие фенилкетонурии. На территории России этот вопрос регламентирует приказ Минздрава РФ №316 от 30.12.1993 г. Процедура получила название неонатальный скрининг и является эффективным способом выявления наиболее распространенных наследственных заболеваний, среди них и ФКУ.
Массовое обследование новорождённых это простой и достоверный метод диагностики. В роддоме у каждого ребенка берут несколько капель периферической крови из пяточки. Это делается натощак, через три часа после кормления. У доношенных детей анализ берут на четвертый день жизни, а у недоношенных на седьмой. У тех новорожденных, которые появились на свет не в родильных домах, важно взять анализ на протяжении первых трех недель.
Кровь наносят на специальный тест-бланк, который потом отправляют в лабораторию для проведения генетического исследования. Там на протяжении суток проводится анализ крови на содержание в ней аминокислоты — фенилаланина. Результаты теста заносятся в обменную карту ребенка в виде штампа: «На ФКУ и ВГ обследован».
Лечение фенилкетонурии
На сегодняшний день в нашей стране единственным эффективным методом лечения является диетотерапия. Разрабатываются препараты, которые позволят контролировать уровень фенилаланина в крови без соблюдения диеты. В этом направлении есть значительные успехи, но в продаже такие лекарственные средства появятся не раньше чем через 5-7 лет.
Некоторые формы фенилкетонурии поддаются лечению тетрагидробиоптерином, который является составляющей частью недостающего фермента фенилаланин-4-гидроксилазы. Атипичные формы ФКУ не лечатся с помощью диеты и требуют регулярного приема тетерагидробиоптерина или его заменителей.
Питание больного фенилкетонурией

Соблюдать диету требуется до 16-18 лет. Это обязательное условие. Желательно контролировать количество животных белков и в дальнейшем.
Если женщина, у которой в детстве были обнаружены признаки ФКУ, планирует забеременеть, то ей обязательно нужно вернуться к диете без фенилаланина. Таких ограничений необходимо придерживаться до зачатия, во время беременности и кормления грудью.
Все необходимые для роста и развития аминокислоты поступают в организм из специализированных лечебных продуктов. Обычно они представляют собой порошок – сухую смесь аминокислот. Их родителям больного малыша выдают бесплатно в медико-генетической консультации.
Грудные дети получают специальные смеси полностью очищенные от лактозы на основе гидролизата молочного белка.
Детей, больных ФКУ, можно кормить грудью. Но при этом кормящей матери нужно придерживаться специальной диеты.
В диете детей дошкольного и школьного возраста полностью исключают из меню белковые продукты. В списке разрешенных продуктов – овощи, фрукты, изделия из крахмала, растительные масла. При составлении дневного меню необходимо строго придерживаться возрастных норм фенилаланина.
| Возраст ребенка | Суточное количество фенилаланина (мк/кг массы тела) |
| Младше 2 мес. | 60 |
| 2-3 мес. | 60-55 |
| 3-6 мес. | 55-45 |
| 6-12 мес. | 45-35 |
| 1-1,5 года | 35-30 |
| 1,5-3 года | 30-25 |
| 3-6 лет | 25-15 |
| Старше 6 лет | 15-10 |
Необходимо помнить, что для растущего организма полноценное питание жизненно необходимо. Так в сутки ребенку требуется 120 мг тирозина на каждый килограмм массы. Поэтому дети и подростки с таким диагнозом должны получать аминокислоты для построения клеток и роста из дополнительных источников. Также обязательно назначают витаминно-минеральный комплекс. Особенно важно, чтобы ребенок получал норму витаминов С, В6 и B1, фолиевой кислоты, железа, кальция и магния. Количество калорий должно быть увеличено на 30% по сравнению с дневной нормой сверстников.
Группы продуктов при ФКУ
На основе этих продуктов можно составить полноценное меню, готовить ребенку вкусные, полезные и разнообразные блюда.
Родителям ребенка, больного ФКУ, важно уметь составлять диету и правильно рассчитывать количество фенилаланина. Для этого необходимо иметь под рукой весы, которые дают возможность взвешивать до десятой доли грамма.
Контроль уровня фенилаланина в крови

Для определения необходимо сделать анализ крови в лаборатории. До трехмесячного возраста это делают еженедельно.
Постепенно врач снижает количество анализов. С тех месяцев до года – один раз в месяц, с года до трех лет – один раз в два месяца. После трех лет частота проверок снижается до одного раза в три месяца. Существует специальная схема, но специалист может изменить ее, исходя из состояния больного.
Делать анализ желательно утром натощак. От качества и регулярности такого контроля и своевременных исправлений в диете зависит сохранение интеллекта.
Ответы на часто задаваемые вопросы
Как проявляется фенилкетонурия у новорожденных?
Новорожденные с диагнозом ФКУ ничем не отличаются от здоровых детей. И если болезнь вовремя выявить и остановить ее развитие, то и в дальнейшем такой ребенок останется абсолютно здоровым.
Как выглядят больные фенилкетонурией?
Какие смеси использовать для ребенка с фенилкетонурией?
Для того чтобы обеспечить детей всеми необходимыми веществами в достаточном количестве разработаны специальные смеси на основе незаменимых и заменимых аминокислот. В их состав также входят витамины и все необходимые микроэлементы.
Какова продолжительность жизни больного с фенилкетонурей?
Как лечить фенилкетонурию?

Такой метод диетотерапии является самым дешевым и действенным. На протяжении многих лет он помогает детям с этой болезнью вырасти здоровыми. В своем развитии они ничем не уступают сверстникам. Те, кому в детстве ставили диагноз «фенилкетонурия», учатся в школе, получают высшее образование, заводят семью и рожают здоровых детей.
Подводя итоги, отметим, что фенилкетонурия это тяжелое генетическое заболевание, которое может привести к психической инвалидности. Изменения происходят в нервной системе очень быстро и имеют необратимый характер. Однако можно не допустить развития болезни. Для этого необходима ранняя диагностика и специальная диета.
Какие бывают типы фенилкетонурии?
Дают ли инвалидность при фенилкетонурии?
Критерии установления инвалидности при фенилкетонурии:
Существует ли профилактика фенилкетонурии?

Каков прогноз при фенилкетонурии?
Прогноз зависит от формы заболевания и начала лечения, соблюдения диетических рекомендаций, медико-педагогической коррекции.
При фенилкетонурии I, при своевременном начале необходимых мероприятий, прогноз, как правило, благоприятный. Ребенок растет и развивается нормально. Если опоздать с лечением и диетой, то результат будет не таким хорошим.
При фенилкетонурии II и III прогноз серьезнее. Соблюдение диеты не приносит эффекта.
Фенилкетонурия – это наследственное нарушение аминокислотного обмена, обусловленное недостаточностью печеночных ферментов, участвующих в метаболизме фенилаланина до тирозина. Ранними признаками фенилкетонурии служат рвота, вялость или гиперактивность, запах плесени от мочи и кожи, задержка психомоторного развития; типичные поздние признаки включают олигофрению, отставание в физическом развитии, судороги, экзематозные изменения кожи и др. Скрининг новорожденных на фенилкетонурию проводится еще в родильном доме; последующая диагностика включает молекулярно-генетическое тестирование, определение концентрации фенилаланина в крови, биохимический анализ мочи, ЭЭГ, МРТ головного мозга. Лечение фенилкетонурии заключается в соблюдении специальной диеты.
МКБ-10
Общие сведения
Фенилкетонурия (болезнь Феллинга, фенилпировиноградная олигофрения) – врожденная, генетически обусловленная патология, характеризующаяся нарушением гидроксилирования фенилаланина, накоплением аминокислоты и ее метаболитов в физиологических жидкостях и тканях с последующим тяжелым поражением ЦНС. Фенилкетонурия впервые описана А. Феллингом в 1934 г.; встречается с частотой 1 случай на 10 000 новорожденных.
В неонатальном периоде фенилкетонурия не имеет клинических проявлений, однако поступление фенилаланина с пищей вызывает манифестацию заболевания уже в первом полугодии жизни, а в дальнейшем приводит к тяжелым нарушениям развития ребенка. Именно поэтому пресимптоматическое выявление фенилкетонурии у новорожденных является важнейшей задачей неонатологии, педиатрии и генетики.
Причины фенилкетонурии
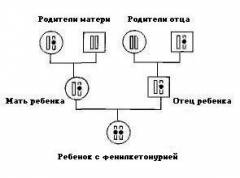
Фенилкетонурия является заболеванием с аутосомно-рецессивным характером наследования. Это означает, что для развития клинических признаков фенилкетонурии ребенок должен унаследовать по одной дефектной копии гена от обоих родителей, являющихся гетерозиготными носителями мутантного гена.
Чаще всего к развитию фенилкетонурии приводит мутация гена, кодирующего фермент фенилаланин-4-гидроксилазу и расположенного на длинном плече 12 хромосомы (локус12q22-q24.1). Это, так называемая, классическая фенилкетонурия I типа, составляющая 98% всех случаев заболевания. Гиперфенилаланинемия может достигать 30 мг% и выше. При отсутствии лечения данный вариант фенилкетонурии сопровождается глубокой умственной отсталостью.
Кроме классической формы, различают атипичные варианты фенилкетонурии, протекающие с той же клинической симптоматикой, но не поддающиеся коррекции диетотерапией. К ним относятся фенилкетонурия II типа (недостаточность дегидроптеринредуктазы), фенилкетонурия III типа (дефицит тетрагидробиоптерина) и другие, более редкие варианты. Вероятность рождения ребенка, больного фенилкетонурией, повышается при заключении близкородственных браков.
Патогенез
В основе классической формы фенилкетонурии лежит недостаточность фермента фенилаланин-4-гидроксилазы, участвующего в конверсии фенилаланина в тирозин в митохондриях гепатоцитов. В свою очередь, производный тирозина – тирамин является исходным продуктом для синтеза катехоламинов (адреналина и норадреналина), а дийодтирозин – для образования тироксина. Кроме этого, результатом метаболизма фенилаланина служит образование пигмента меланина.
Нарушение обмена аминокислот сопровождается нарушением миелинизации нервных волокон, снижением образования нейромедиаторов (дофамина, серотонина и др.), запускающими патогенетические механизмы задержки умственного развития и прогредиентное слабоумие.
Симптомы фенилкетонурии
Новорожденные с фенилкетонурией не имеют клинических признаков заболевания. Обычно манифестация фенилкетонурии у детей происходит в возрасте 2-6 месяцев. С началом кормления в организм ребенка начинает поступать белок грудного молока либо его заменителей, что приводит к развитию первых, неспецифических симптомов – вялости, иногда – беспокойства и гипервозбудимости, срыгивания, мышечной дистонии, судорожного синдрома. Одним из ранних патогномоничных признаков фенилкетонурии служит упорная рвота, которая нередко ошибочно расценивается как проявление пилоростеноза.
Ко второму полугодию становится заметным отставание ребенка в психомоторном развитии. Ребенок становится менее активным, безучастным, перестает узнавать близких, не пытается садиться и вставать на ножки. Аномальный состав мочи и пота обусловливают характерный «мышиный» запах (запах плесени), исходящий от тела. Часто наблюдается шелушение кожи, дерматиты, экзема, склеродермия.
У детей с фенилкетонурией, не получающих лечения, выявляется микроцефалия, прогнатия, позднее (после 1,5 лет) прорезывание зубов, гипоплазия эмали. Отмечается задержка речевого развития, а к 3-4 годам выявляется глубокая олигофрения (идиотия) и практически полное отсутствие речи.
Клинические проявления фенилкетонурии II типа характеризуются тяжелой степенью умственной отсталости, повышенной возбудимостью, судорогами, спастическим тетрапарезом, сухожильной гиперрефлексией. Прогрессирование заболевание может приводить к гибели ребенка в возрасте 2-З лет. При фенилкетонури III типа развивается триада признаков: микроцефалия, олигофрения, спастический тетрапарез.
Диагностика
В настоящее время диагностика фенилкетонурии (а также галактоземии, врожденного гипотиреоза, адрено-генитального синдрома и муковисцидоза) входит в программу неонатального скрининга, осуществляемого всем новорожденным. Основные и дополнительные методы диагностики:
Дифференциальный диагноз фенилкетонурии проводят с внутричерепной родовой травмой новорожденных, внутриутробными инфекциями, другими нарушениями обмена аминокислот.
Лечение фенилкетонурии
Дети, страдающие фенилкетонурией, находятся под наблюдением участкового педиатра и психоневролога; нередко нуждаются в помощи логопеда и дефектолога. Необходим тщательный мониторинг нервно-психического статуса детей, контроль уровня фенилаланина в крови и показателей электроэнцефалограммы.
Прогноз и профилактика
Проведения массового скрининга на фенилкетонурию в неонатальном периоде позволяет организовать раннюю диетотерапию и предотвратить тяжелые церебральные повреждения, нарушения функции печени. При раннем назначении элиминационной диеты при классической фенилкетонурии прогноз развития детей хороший. При поздно начатом лечении прогноз в отношении умственного развития неблагоприятный.
Профилактика осложнений фенилкетонурии заключается в проведении массового скрининга новорожденных, раннего назначения и длительного соблюдения диетического питания.
С целью оценки риска рождения ребенка с фенилкетонурией предварительное генетическое консультирование должны пройти супружеские пары, уже имеющие больного ребенка, состоящие в кровнородственном браке, имеющие родственников с данным заболеванием. Женщины с фенилкетонурией, планирующие беременность, должны соблюдать строгую диету до зачатия и во время беременности для исключения повышения уровня фенилаланина и его метаболитов и нарушения развития генетически здорового плода. Риск рождения ребенка с фенилкетонурией у родителей-носителей дефектного гена, составляет 1:4.