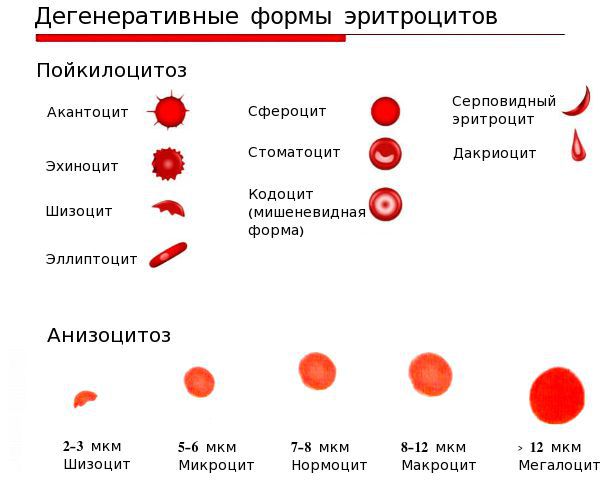
диагноз лдж у ребенка что
Что такое железодефицитная анемия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Головко О. А., терапевта со стажем в 12 лет.
Определение болезни. Причины заболевания
Основные причины развития ЖДА:
Группы риска по ЖДА:
Симптомы железодефицитной анемии
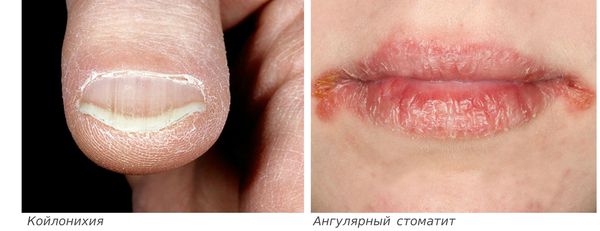
Сидеропенический синдром связан с недостатком железа в тканях и проявляется нарушениями со стороны кожи и слизистых оболочек:
Анемический синдром проявляется слабостью, быстрой утомляемостью, сонливостью днём и плохим засыпанием ночью, головокружениями, обмороками, частыми головными болями, шумом в ушах, мельканием «мушек» перед глазами, одышкой при физической нагрузке, увеличением частоты сердечных сокращений, неприятными ощущениями в области сердца, пониженным артериальным давлением.
При ЖДА может наблюдаться умеренное повышение температуры тела (до 37,5 ° С), которое исчезает после лечения железосодержащими препаратами.
Зачастую снижение содержания гемоглобина происходит постепенно, при этом многие органы адаптируются к анемии. В связи с этим жалобы больных не всегда соответствуют показателям содержания гемоглобина. Многие пациенты, особенно женщины, свыкаются с неважным самочувствием, приписывая его переутомлению, психическим и физическим перегрузкам.
Патогенез железодефицитной анемии
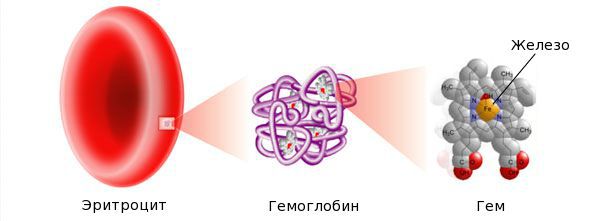
Железо — жизненно важный для человека микроэлемент, который входит в состав гемоглобина крови, миоглобина мышц, отвечает за транспорт кислорода в организме и протекание многих биохимических реакций.
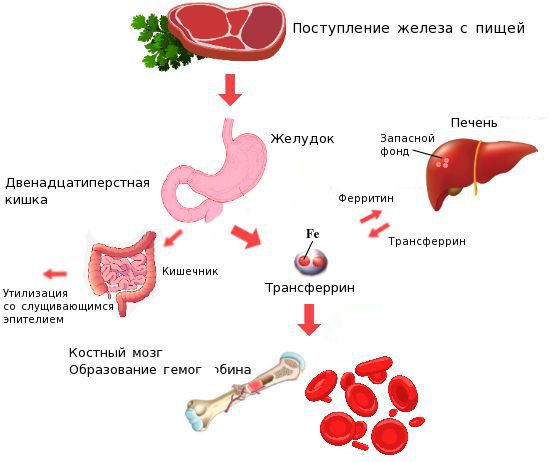
Железо поступает в организм в виде двухвалентного (мясная пища) и трёхвалентного (растительная пища) ионов. Первый всасывается легко, второй под действием соляной кислоты в желудке должен превратиться в двухвалентный. Далее он поступает в двенадцатиперстную кишку и начальные отделы тощей кишки, затем двухвалентное железо вновь переводится в трёхвалентное. В дальнейшем часть этого железа поступает в депо слизистой оболочки тонкой кишки, а другая всасывается в кровь, где соединяется с трансферрином (белком-переносчиком железа, синтезируемым в печени). Если содержание железа в организме избыточно, то оно задерживается в клетках кишечника и в дальнейшем удаляется из организма вместе со слущивающимся эпителием.
При снижении кислотности в желудке (атрофический гастрит, резекция желудка, приём препаратов, снижающих кислотность, гиповитаминоз С) нарушается ионизация железа в желудке, что ведёт к дальнейшему нарушению всасывания железа и развитию ЖДА. При резекции и хронических заболеваниях кишечника (дуоденит, хронический энтерит, целиакия) нарушается всасывание железа, что опять же приводит к развитию ЖДА.
Ферменты, содержащие железо, принимают участие в синтезе гормонов щитовидной железы и поддержании иммунитета, поэтому при дефиците железа нарушаются защитные и адаптационные силы организма и весь обмен веществ.
Классификация и стадии развития железодефицитной анемии
Выделяют три стадии железодефицитных состояний: прелатентный дефицит железа, латентный дефицит и железодефицитную анемию (ЖДА).
Для прелатентного дефицита железа характерно снижение запасов железа в костном мозге:
На этой стадии симптомов может не быть.
Латентный (скрытый) дефицит железа влияет на тканевой обмен. На этой стадии запасы железа начинают истощаться, но организм ещё не успел отреагировать снижением гемоглобина. Возникают первые проявления заболевания — человека может беспокоить повышенная утомляемость, слабость, одышка при физической нагрузке, ломкость ногтей, сухость кожи, выпадение волос. Но эти симптомы пока выражены незначительно.
Латентный дефицит железа характеризуется:
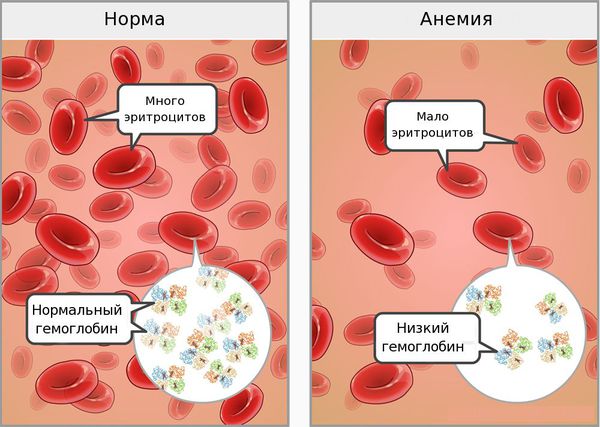
На третьей стадии (собственно ЖДА) снижается уровень гемоглобина и эритроцитов.
Для железодефицитной анемии характерно:
Для этой стадии характерна ярко выраженная клиническая симптоматика, хотя зачастую люди списывают эти проявления на переутомление.
В норме уровень гемоглобина в крови: у женщин — 120-140 г/л, у мужчин — 130-160 г/л.
Степени тяжести ЖДА (на основании снижения уровня гемоглобина Hb):
Осложнения железодефицитной анемии
У беременных с ЖДА повышается риск преждевременных родов и задержки роста плода. У детей недостаток железа приводит к задержке роста и интеллектуального развития.
Диагностика железодефицитной анемии
Минимальный объём исследований:
Биохимический анализ крови покажет снижение уровня сывороточного железа и ферритина, увеличение общей железосвязывающей способности сыворотки и растворимых трансферриновых рецепторов, снижение коэффициента насыщения трансферрина железом (НТЖ).
Лечение железодефицитной анемии
Лечение проводится железосодержащими препаратами, в основном для приёма внутрь и значительно реже для внутримышечного или внутривенного введения. Препараты нельзя принимать без назначения врача, так как переизбыток железа опасен своими последствиями — поражением зубов, развитием гепатита, цирроза печени, сахарного диабета и сердечно-сосудистых заболеваний. Также возможны тяжёлые аллергические реакции.
При анемии следует изменить рацион питания и включить в него продукты, содержащие железо в наиболее усвояемой форме — телятину, говядину, баранину, мясо кролика, печень, язык. Важно помнить, что из мяса усваивается до 30 % железа, из рыбы — 10 %, а из растительной пищи — всего лишь 3-5 %.
При анемии коррекция дефицита железа не может быть достигнута только изменением питания. Причина этого в том, что усвоение железа из пищи ограничено, а в препаратах оно содержится в большей концентрации.
При анемии лёгкой и средней степени тяжести препараты железа лучше принимать внутрь вместе с аскорбиновой или фолиевой кислотой, так как они улучшают всасываемость железа.
Если препараты железа невозможно применять внутрь (например, при непереносимости или нарушении всасывания железа в кишечнике), то их вводят внутримышечно или внутривенно. Инъекционные препараты железа используют только в стационаре, так как они могут вызывать шоковые реакции. Их нельзя применять во время беременности и лактации.
При тяжёлой анемии (гемоглобин менее 70 г/л) и по жизненным показаниям в условиях стационара проводят переливание эритроцитарной массы.
В качестве лечебно-профилактического средства пациентам, у которых нет сахарного диабета, можно использовать гематоген. В его состав входят железо, связывающее белки, получаемые из крови крупного рогатого скота, а также аскорбиновая кислота и необходимый комплекс белков. Однако это достаточно калорийный продукт — в 100 г гематогена содержится 350–500 килокалорий, об этом следует помнить, включая его в рацион.
Прогноз. Профилактика
Прогноз при ЖДА благоприятный. В большинстве случаев заболевание успешно лечится амбулаторно. Но если не анемию не лечить, то она может прогрессировать, ухудшая общее самочувствие. ЖДА сложно скорректировать в следующих случаях:
Для профилактики ЖДА следует:
Дефицит железа и его отрицательное влияние на развитие детей раннего возраста. Диетологические возможности постнатальной коррекции дефицита железа
Железодефицитные состояния (ЖДС) — важная проблема педиатрии. В первую очередь, это обусловлено широкой распространенностью данных состояний среди населения нашей планеты. По данным ВОЗ, дефицит железа (ДЖ) имеет около 1,5 млрд человек, и только половина этих случаев приходится на долю его явного дефицита, то есть железодефицитную анемию (ЖДА) [1–3].
В материалах United Nations Administrative Committee on Coordination/Sub-Committee on Nutrition and International Food Policy Research Institute. Fourth Report of the World Nutrition Situation отмечено, что в странах с низким социально-экономическим уровнем у детей, страдающих различными дефицитными состояниями, ДЖ является самым частым микронутриентным недостатком. В индустриализированных странах, несмотря на то, что дефицитные состояния в последние годы стали встречаться значительно реже, ЖДА остается самой распространенной формой анемии у детей раннего возраста [4, 5].
Наиболее «уязвимы» по развитию ЖДС дети раннего возраста, подростки и беременные женщины. Так, в России, по данным различных авторов, частота ЖДА колеблется от 6% до 40% среди детского населения [6–8] и от 15% до 56% у беременных женщин [9].
Такая высокая распространенность ЖДА среди лиц этих категорий обусловлена тем, что основными причинами развития ЖДС чаще всего являются алиментарные факторы (нарушение сроков введения продуктов прикорма, дефицит питания, нерациональное питание), интенсивный рост и повышенная потребность в железе [6–10]. У девочек-подростков к вышеназванным причинам следует добавить еще и потерю железа вследствие наступления менструаций. В работе Bruner A. B. et al. (1996) отмечено, что у девочек после десятилетнего возраста потребность в железе возрастает на 70% и ДЖ развивается у 25% девочек-подростков в США [11].
Особенно чувствительны к недостаточности железа дети второго полугодия и второго года жизни [10]. В исследовании, проведенном в Institute for Nutrition Research, University of Oslo (2004), показано, что в Норвегии частота выявления ЖДА у детей первого полугодия жизни составляет 3%, во втором полугодии увеличивается втрое и составляет 10%, незначительно увеличиваясь к двум годам до 12% [12].
Этот возрастной период с физиологических позиций рассматривают как критический период в жизни ребенка, который характеризуется бурным ростом, активным формированием адаптивного иммунного ответа. Именно этот период по времени совпадает с последней фазой «рывка» в развитии головного мозга, когда завершается процесс формирования гиппокампа, осуществляется активный дендритогенез, синаптогенез и миелинизация. Поэтому любой, даже самый незначительный дефицит нутриентов, перенесенный малышом в этот период, может иметь ряд негативных последствий для становления психомоторных, предречевых и речевых навыков, абстрактного мышления, памяти и поведения.
Результаты исследований последних лет показывают, что не только ЖДА, но и ДЖ без анемии может иметь долгосрочное отрицательное влияние на развитие умственных способностей и поведение ребенка, причем некоторые из этих эффектов могут быть необратимыми [11, 13, 14].
Основные понятия и критерии диагностики ЖДС
Развитие ДЖ в организме имеет определенную стадийность. Выделяют три последовательно развивающиеся стадии ЖДС: прелатентный дефицит железа (ПДЖ), латентный дефицит железа (ЛДЖ) и ЖДА [6, 15].
ПДЖ характеризуется только снижением содержания железа в депо при сохранении транспортного и гемоглобинового фондов. По мнению главного детского гематолога РФ Румянцева А. Г., отсутствие клинических проявлений и четких критериев диагностики позволяет считать, что это состояние не имеет практического значения [15].
ЛДЖ составляет 70% всех ЖДС и представляет собой функциональное расстройство с отрицательным балансом железа, а не болезнь. На этой стадии происходит обеднение депо железа, которое может быть охарактеризовано с помощью определения сывороточного ферритина (СФ). В норме концентрация ферритина в сыворотке тесно коррелирует с его запасами в депо, при этом концентрация ферритина, равная 1 мкг/л, соответствует 10 мкг железа в депо. Уровень СФ зависит не только от количества железа в тканях депо, но и от скорости высвобождения ферритина из тканей. На сегодняшний день СФ является единственным международно признанным маркером запасов железа в организме человека.
При обеднении депо снижается поступление железа к клеткам эритроидного ростка и ограничивается продукция эритроцитов. При ЛДЖ имеется характерная клиническая картина — сидеропенический синдром, но гемоглобин остается в пределах нормальных значений [10].
По рекомендации ВОЗ (1998) биохимическим маркером ЛДЖ служит уровень СФ, концентрация которого при данном состоянии меньше 12 мкг/л (у детей до 1 года
Н. М. Богданова, кандидат медицинских наук, доцент
Е. М. Булатова, доктор медицинских наук, профессор
Т. В. Габрусская
А. В. Верхососова, главный технолог ЗАО «Завод детских мясных консервов «Тихорецкий»»
СПбГПМА, Санкт-Петербург
ДЕФИЦИТ ЖЕЛЕЗА: ВЛИЯНИЕ НА ОРГАНИЗМ ДЕТЕЙ
Железодефицитная анемия — приобретенное заболевание из группы дефицитных анемий, сопровождаемое микроцитарной, гипохромной и норморегенераторной анемией, клинически проявляется в сочетании сидеропенического и анемического синдромов.
В детском возрасте она составляет 90% всех анемий.
О причинах возникновения, своевременной диагностике, методах лечения железодефицитной анемии, преимуществах и недостатках использования разных групп препаратов рассказывает Ирина Станиславовна Тарасова, д.м.н., доцент, ученый секретарь ФГБУ «Федеральный научно–клинический центр детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева».
Распространение железодефицитной анемии зависит от социально-экономических условий и уровня доходов населения, характера питания. Наибольшему риску подвержены дети грудного и раннего возраста, подростки, женщины детородного возраста, беременные и кормящие матери. По мнению экспертов Всемирной организации здравоохранения, когда в стране определяется железодефицитная анемия (ЖДА) более чем у 40% населения, то проблема перестает быть медицинской и требует принятия решения на государственном уровне.
По мнению экспертов ВОЗ, возникновению ЖДА способствует неправильное (неполноценное) питание, гораздо реже она развивается вследствие глистных инвазий или в результате хронических постгеморрагических анемий. Основными причинами развития железодефицитной анемии у детей и подростков является дефицит железа при рождении ребенка, алиментарный дефицит железа вследствие несбалансированного питания, повышенные потребности организма в Fe (бурный рост ребенка первые три года жизни и в период с 14 до 16 лет, занятия профессиональным спортом, женщины в периоды беременности и лактации). Потеря железа организмом, превышающия физиологические, проявляется при кровотечениях различной этиологии, менструальной кровопотере, при послеродовой анемии.
Алиментарно–зависимыми факторами в развитии дефицита железа у детей являются: недостаточное поступление Fe с пищей (грудное вскармливание в возрасте старше 4 месяцев, позднее введение прикорма, несбалансированность питания, вегетарианство), снижение всасывания железа организмом и увеличение его потери.
В результате дефицита железа в организме нарушается синтез Hb, что приводит к уменьшению эритроцитарного индекса — среднего объема эритроцитов (MCV) и содержания гемоглобина в эритроцитах (МСН). Резко уменьшается количество эритроидных клеток, содержащих гемосидерин.
Истощение запасов железа приводит к расстройствам окислительно-восстановительных реакций в тканях, что обуславливает поражение кожи, слизистых оболочек, дисфункции ЖКТ, снижения активности многих ферментов, содержащих железо.
Тканевой дефицит железа без признаков анемии, или латентный дефицит железа (ЛДЖ), — функциональное расстройство у детей, предшествующее ЖДА, при котором коэффициент Hb крови остается в норме (более 110 г/л), встречается в 2,5–3 раза чаще. Распространенность ЖДА — 4,5–5,3%, распространенность ЛДЖ — 7,9–17%.
Но если вовремя не заметить изменения в самочувствии ребенка, ЛДЖ перейдет в железодефицитную анемию. Диагностируется ЛДЖ по снижению коэффициента насыщения трансферринов (ниже 20%), по содержанию железа в сыворотке крови — ниже показателя 14 мкмоль/л.
Я ДЕФИЦИТ ЖЕЛЕЗА УЗНАЮ ПО…
При подозрении на ЛДЖ родители должны обратить внимание на следующие признаки:
В подростковом возрасте у девушек отмечаются нарушение менструального цикла, субфебрилитет.
Для сравнения — при ЖДА наблюдаются следующие измененные состояния в детском организме:
Отмечается и снижение переносимостиа физических нагрузок. При быстром развитии ЖДА компенсаторные механизмы не успевают сформироваться, а значит клинические проявления будут ярче выражены.
Чем еще чревата потеря железа организмом? В раннем возрасте она приводит к задержке психомоторного развития и нарушению когнитивных функций. Такие дети, как правило, плохо учатся в школе и имеют большие проблемы с поведением в подростковом возрасте. Дефицит железа может приводить к задержке полового развития, вызывать синдром хронической усталости, сказываться на иммунном статусе, вместе с тем увеличивается риск возникновения инфекционных заболеваний, нарушается работа желез внутренней секреции, увеличивается адсорбция тяжелых металлов.
КАК ДИАГНОСТИРОВАТЬ ЖЕЛЕЗОДЕФИЦИТНУЮ АНЕМИЮ
Диагностика ЖДА осуществляется тремя способами:
Наиболее актуальным, позволяющим дать более точный прогноз заболевания, является биохимия крови, когда в качестве общепризнанного маркера, позволяющего оценить запас железа в организме, используют сывороточный ферритин. Недостатком этого способа диагностики является его затратность (порядка 500 руб.). Чаще врачами общей практики, семейными врачами используются иные подходы, когда критериями, позволяющими диагностировать у ребенка ЖДА, является снижение концентрации гемоглобина (Hb) и гематокрита (Ht) при одновременном исключении каких–либо хронических заболеваний. К концу первого месяца лечения врач вправе оценить эффективность назначенной терапии. Повышение концентрации Hb на 10 г/л, а Ht на 3%, по сравнению с исходными, свидетельствует о том, что диагноз ЖДА поставлен правильно, следует продолжать лечение далее. В случае, если указанный эффект не получен, следует пересмотреть диагноз, врач обязан провести более углубленное исследование пациента.
Тяжесть ЖДА оценивается по показателям гемоглобина в сыворотке крови.
Оценить частотные характеристики дефицита железа помогло исследование, проведенное в 2016 г. ассистентом кафедры педиатрии Российской медицинской академии постдипломного образования (РМАПО), к.м.н. Еленой Борисовной Мачневой, в результате которого были обследованы 337 подростков — учащихся средних и старших классов общеобразовательных школ Москвы (11–17 лет), из них 193 — девушки и 144 — юноши. Внимание было сфокусировано именно на подростковой аудитории, т.к. особенности течения ЖДА и лечения у этой возрастной категории населения ранее изучены недостаточно. Согласно полученным результатам, общая распространенность железодефицитных состояний составила 20,2%, из них 5,3% — ЖДА. По данным гендерных различий, выяснилось, что 73,6% девушек и 83,6% юношей в ходе обследования оказались здоровыми, 20,2% девушек и 12,5% юношей испытывали ЛДЖ. Подверженными ЖДА оказались 6,2% девушек и 4,2% юношей. Когда только планировалось данное исследование, железодефицитные состояния было принято оценивать по коэффициенту насыщения трансферрина менее 16%, исходя из концентрации гемоглобина в сыворотке крови. Согласно проведенным исследованиям было выявлено три фактора риска:
РЕКОМЕНДАЦИИ В ЛЕЧЕНИИ
ЖДА и ЛДЖ очень хорошо поддаются лечению. Принципы лечения ЖДА основаны на следующих рекомендациях:
ЧЕМ ЛУЧШЕ ЛЕЧИТЬ ЖДА?
Применение солевых препаратов железа может сопровождаться осложнениями в виде токсичности для органов ЖКТ, что приводит к низкой комплаентности лечения железодефицитных состояний. 30–35% больных, начав лечение, отказываются от его продолжения. Солевые препараты железа имеют строгую дозировку: детям до 3 лет — 3 мг/кг, старше 3 лет — 45-60 мг/кг, подросткам — до 120 мг/кг.
Современные препараты на основе гидроксид-полимальтозных комплексов (ГПК) «Мальтофер» или «Феррум Лек» не вызывают таких осложнений и прекрасно переносятся. Каждая упаковка имеет удобный капельный дозатор, таким образом, препараты можно добавлять в детскую еду, что повышает приверженность к терапии. Выпускаются они и в виде сиропа, и в форме жевательных таблеток. Кроме того, препараты ГПК применяются в любом возрасте в дозировке 5 мг/кг. При их использовании отсутствует взаимодействие с другими лекарственными средствами и продуктами питания. При этом указанные препараты обладают антиоксидантными свойствами, не вызывают в процессе применения потемнения десен или зубов. Они удобны и безопасны в применении.
Парентеральное применение препаратов железа показано в тех случаях, когда нельзя применять препараты перорально или их применение неэффективно. В случае необходимости быстрого насыщения организма железом внутривенное или внутримышечное введение проводится 2–3 раза в неделю. При использовании парентеральных препаратов железа не рекомендуется превышать общий дефицит железа.
В настоящее время для профилактики дефицита железа в большинстве стран мира применяют соответствующие рекомендации.
Должны получать железо:
По материалам выступлений в рамках II городского съезда педиатров «Трудный диагноз в педиатрии»
Дефицит железа и когнитивные расстройства у детей
Риск развития железодефицитной анемии (ЖДА) наиболее высок у детей раннего возраста, подростков, а также у беременных женщин. Около 70–80% всех диагностируемых анемий связаны с дефицитом железа. У детей раннего
Риск развития железодефицитной анемии (ЖДА) наиболее высок у детей раннего возраста, подростков, а также у беременных женщин. Около 70–80% всех диагностируемых анемий связаны с дефицитом железа. У детей раннего возраста частота сидеропении достигает 73%, при этом вероятность перехода латентного дефицита железа в анемию очень высока [1]. Железо, в силу важности выполняемых им функций, признано эссенциальным, т. е. жизненно необходимым: оно является обязательным и незаменимым компонентом ферментных систем организма, обеспечивающих должный уровень системного и клеточного аэробного метаболизма. С участием этого микроэлемента в организме осуществляются такие биохимические процессы, как транспорт электронов (цитохромы, железосеропротеиды), транспорт и депонирование кислорода (миоглобин, гемоглобин), синтез ДНК, тканевое дыхание. Железо участвует в работе окислительно-восстановительных ферментов (оксидаза, гидроксилаза, супероксиддисмутаза). Депонируется железо при избытке поступления в организм в виде железосодержащих веществ (ферритин и гемосидерин). В то же время свободное железо обладает способностью образовывать свободные радикалы, которые могут повреждать такие важнейшие биологические структуры, как липиды, протеины и ДНК, т. е. являться прооксидантом и оказывать токсическое влияние на организм человека.
Самый важный регулирующий центр гомеостаза железа в организме человека находится на апикальной и базолатеральной мембранах эпителия двенадцатиперстной кишки. Апикальная мембрана энтероцита обращена в просвет кишечника и специализируется на транспорте в клетки гемового и двухвалентного железа. Наиболее интенсивно железо транспортируется через двухвалентный транспортер металла белок DMT1. Базолатеральная мембрана участвует в переносе железа, транспортированного в клетки кишечного эпителия, в плазму крови. Железо, не транспортированное в плазму, выводится из организма путем отшелушивания эпителия кишечника. Запасы железа хранятся в организме в виде ферритина и гемосидерина. При этом ферритин обнаруживается практически во всех клетках, представляя собой легкодоступный резерв железа в растворимой, нетоксичной форме. Наиболее богаты ферритином клетки-предшественники эритроцитов в костном мозге, макрофаги, ретикуло-эндотелиальные клетки печени. При дефиците железа в организме истощаются именно эти запасы. Показателями дефицита железа в организме служат снижение уровня сывороточного ферритина, уменьшение содержания железа в сыворотке крови, повышение ее железосвязывающей способности. Дефицит железа приводит к нарушению иммунитета, снижению работоспособности и ухудшает функционирование головного мозга.
Согласно современным исследованиям, наибольшее содержание железа после гемоглобина эритроцитов наблюдается в клетках головного мозга. Youdim и соавторы (1989) показали, что обмен железа в тканях головного мозга находится на более низком уровне, чем в печени, так как клетки головного мозга имеют низкую способность депонирования данного микроэлемента. Однако, в отличие от печени, головной мозг дольше удерживает железо, что препятствует истощению его запасов. В то же время на фоне ферротерапии железо быстрее накапливается в печени, нежели в головном мозге [3]. Железо в тканях головного мозга участвует в генерации импульсов в нервных синапсах, в процессах миелинизации нервных волокон, оказывает влияние на функции гипоталамуса [4]. В случае недостатка железа снижаются количество и чувствительность допаминовых рецепторов Д2, что ведет к нарушению метаболизма допамина в нервных синапсах, в результате чего уменьшается стимулирующий эффект на следующую клетку и сокращается количество проходящих импульсов [4, 5]. Эксперименты, проведенные John L. Beard (2001) на крысах, у которых наблюдался дефицит железа, показали, что недостаток железа сопровождается уменьшением концентрации экстрацеллюлярного допамина в полосатом ядре мозга, в связи с чем уменьшается активность транспортного белка допамина — ДАТ (допаминовый транспортер), активизирующего Д2-рецепторы на пресинаптической мембране [4]. Авторы пришли к выводу, что в условиях дефицита железа происходит перестройка допаминовых рецепторов и увеличение синтеза опиатных пептидов, блокирующих активность ДАТ, что со временем приводит к нарушениям поведения, моторики. Таким образом, дефицит железа может оказывать специфическое воздействие как на центральную нервную систему (нервные клетки, миелин), так и на процесс передачи нервных импульсов [6]. Результаты экспериментальных исследований показали, что дефицит железа, сопровождающийся снижением дофаминергической активности, может привести к изменению поведенческих реакций [7], познавательных функций, негативно повлиять на способность к обучению и память.
Дефицит железа определяется более чем у четверти всего населения земного шара [8]. В течение последних 20 лет проводились многочисленные исследования, посвященные влиянию дефицита железа на различные функции организма. Наиболее убедительными оказались результаты исследований B. Lozoff с коллегами [9, 10, 13], подтвердившие наличие отдаленных неблагоприятных эффектов сидеропении. С целью контроля использовался полный набор тестов, отражающих когнитивное, психоэмоциональное и двигательное развитие, а также проводилась оценка успеваемости в школе. Авторы показали, что подростки, которые в младенческом возрасте имели хронический, тяжелый дефицит железа, получали более низкие баллы при оценке их умственной и двигательной активности. После учета фоновых факторов различия оставались статистически достоверными при выполнении арифметических и письменных заданий, оценке моторной активности, а также некоторых особых когнитивных процессов (пространственная, избирательная память и др.). Многие из детей, в прошлом имевшие дефицит железа, оставались на второй год обучения или обращались за дополнительной помощью в учебе. Родители и учителя оценивали их поведение как проблемное, отмечали у детей беспокойство или депрессию, трудности в общении и проблемы, связанные с отсутствием внимания. Таким образом, тяжелый длительный дефицит железа в раннем возрасте может проявляться впоследствии задержкой развития и изменением поведенческих реакций. Таким детям требуется дополнительная помощь во время учебы в школе, что является важным аргументом в пользу профилактики дефицита железа в раннем возрасте. Учитывая, что развитие головного мозга, процессы его дифференцировки относятся преимущественно к перинатальному периоду и к первым годам жизни, необходима коррекция дефицита железа именно в раннем возрасте [14, 15].
Выбору препарата для коррекции сидеропении придается особое значение, поскольку длительность лечения может составлять от нескольких недель до нескольких месяцев. При этом важны не только эффективность, но и отсутствие побочных эффектов и осложнений, приверженность к проводимой терапии, особенно в педиатрической практике. Главными требованиями, предъявляемыми к препаратам железа для приема внутрь, используемым в детской практике, являются: достаточная биодоступность, высокая безопасность, хорошие органолептические характеристики, лекарственные формы, удобные для пациентов всех возрастов. Этим критериям в наибольшей степени отвечают препараты железа на основе гидроксид-полимальтозного комплекса (феррум лек, мальтофер). Нами были проведены обследования 101 ребенка с железодефицитным состоянием с ЖДА — 48, с латентным дефицитом железа (ЛДЖ)— 33), а также группы детей (20 человек) без сидеропении. В исследование были включены дети в возрасте от 4 мес до 5 лет, из них 60% мальчиков и 39,6% девочек. Подавляющее большинство детей (81%) были в возрасте 1–3 лет, средний возраст — 1 год 8 мес. Наблюдение осуществлялось в домах ребенка № 8 и № 24 Москвы. По этическим соображениям контрольную группу плацебо не набирали. При этом нарушения физического и психического развития (задержка развития) выявлялись с высокой частотой в обеих группах и мало отличались у детей с ЖДА (отставание в физическом развитии в 1-й группе выявлено у 48% детей, во второй — у 54%; отставание в психическом развитии отмечалось у 70% детей 1-й группы и у 66% малышей во 2-й группе) и ЛДЖ (отставание в физическом развитии в 1-й группе выявлено у 35% детей, у 47% — во 2-й; отставание в психическом развитии отмечалось у 48% детей 1-й группы и у 53 % — 2-й группы). Все дети с железодефицитным состоянием получали препараты железа. Период наблюдения составил от 3 до 12 мес. На фоне приема препаратов у испытуемых отмечалось уменьшение симптомов мышечной гипотонии, улучшилось состояние кожи и ее придатков, значительно изменились к лучшему показатели психического и физического развития. При этом не было выявлено побочных эффектов.
Н. А. Коровина, доктор медицинских наук, профессор
И. Н. Захарова, доктор медицинских наук, профессор
В. И. Свинцицкая
РМАПО, Москва