диагноз мдс что это такое
Диагноз мдс что это такое
Когда ставят диагноз «миелодиспластический синдром», то всегда помнят о том, что существует множество других болезней, способных ухудшить кровь и изменить костный мозг: это хронические инфекции (туберкулез, токсоплазмоз…), аутоиммунные заболевания (системная красная волчанка, ревматоидный артрит…), разнообразные опухоли. Вот почему пациента нужно всесторонне обследовать, а МДС является, скорее, диагнозом исключения, то есть его ставят тогда, когда все другие причины изменения крови исключены. МДС – болезнь пожилых, средний возраст пациентов составляет 70 лет.
Всем клеткам крови человека дает начало стволовая клетка. По мере взросления ее потомков выделяются 3 основных ветви, или ростка: красный росток (эритроидный), белый росток (лейкоцитарный) и тромбоцитный (тромбоцитарный). И хотя ростков всего три, весь процесс кроветворения очень сложен и многогранен. Воспроизводство крови подобно «оркестру», который в течение всей жизни человека, подстраиваясь под нужды организма, играет, тем не менее, по очень точным и сложным нотам.
Термин «миелодиспластический» состоит из трех частей: «миело-» – греческая приставка, обозначающая связь с костным мозгом, «дис-» – приставка, обозначающая «нарушение», и «-плазия» – конечная часть сложных слов, обозначающая «развитие». Термином «синдром» называют совокупность связанных между собой признаков. Таким образом, из самого названия следует, что в организме произошла какая-то поломка, которая привела к тому, что нарушено созревание (развитие) клеток костного мозга. Причины ученым еще предстоит выяснить, но из-за нарушения на тех или иных этапах взросления клеток кровь начинает меняться. Вначале страдает один росток крови, чаще всего эритроидный. У человека постепенно в крови снижается гемоглобин, больной начинает чувствовать слабость, нарастающее недомогание, привычная работа оказывается не по силам, а отдых не приносит облегчения. Это происходит потому, что, когда в крови уменьшается количество гемоглобина (основного переносчика кислорода) и вдыхаемый из воздуха кислород не попадает в органы и ткани, у них начинается кислородное голодание. Пациент чувствует слабость.
Диагноз «миелодиспластический синдром» (МДС) поставить довольно сложно. Здесь лечащий врач, как никогда, нуждается в помощи врачей-лаборантов: цитолога и цитогенетика с хорошей лабораторией. Врач-цитолог, глядя в микроскоп, тщательно анализирует костный мозг, капелька которого нанесена на специальное маленькое стекло и делает заключение о том, есть ли внешние признаки нарушения работы костного мозга. Этот метод относится к одному из самых технически простых, однако специалистов-цитологов, способных выявить и оценить «неправильные» клетки, в городе очень мало. Врач-цитогенетик с помощью сложной аппаратуры анализирует делящиеся клетки костного мозга и ищет типичные изменения в генах, которые очень важны для диагноза, прогноза, выбора лечения и контроля за ним.
Когда ставят диагноз МДС, то всегда помнят о том, что существует множество других болезней, способных ухудшить кровь и изменить костный мозг: это хронические инфекции (туберкулез, токсоплазмоз…), аутоиммунные заболевания (системная красная волчанка, ревматоидный артрит…), разнообразные опухоли. Вот почему пациента нужно всесторонне обследовать, а МДС является, скорее, диагнозом исключения, то есть его ставят тогда, когда все другие причины изменения крови исключены. МДС – болезнь пожилых, средний возраст пациентов составляет 70 лет.
Чем же опасен миелодиспластический синдром, кроме низкого гемоглобина? Одним из самых неприятных и опасных следствий является постепенное накапливание поломок в кроветворении, поскольку первая поломка в зрелых клетках «тянет» за собой другие поломки и уже в более молодых клетках. Со временем заболевают все более и более активные клетки, и возникает болезнь «острый лейкоз». Наблюдая за пациентами, а также анализируя картину их болезни, врачи научились примерно предсказывать его появление. Риск перехода МДС в острый лейкоз записывают специальными прогностическими индексами (IPSS, WPSS и другими), которые обычно указывают в диагнозе.
Миелодисплатический синдром существует в нескольких видах:
Мировая статистика показывает, что в зависимости от разных факторов пациенты с МДС живут от одного-двух месяцев до нескольких лет.
Диагноз мдс что это такое
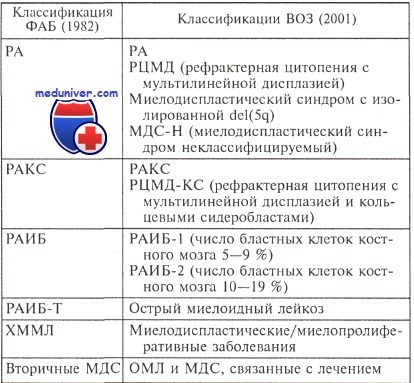
Согласно предложениям ВОЗ, в ФАБ-классификацию внесен ряд изменений.
Основными отличиями классификации ВОЗ от ФАБ-классификации являются:
• упразднение ФАБ-варианта РАИБ-Т, т. е. случаи с числом бластных клеток в крови и костном мозге >20 % отнесены к острым лейкозам. Таким образом, диагноз МДС устанавливают при числе бластных клеток в крови и костном мозге менее 20 %. Исключения составляют:
1) ОМЛ с t(8;21)(q22;q22), в результате которой образуется слитный ген AML1/ЕТО;
2) ОМЛ с inv(16)(p13q22) или t(16;l6)(p13;q22) с образованием слитного гена CBFb/MYH11;
3) острый промиелоцитарный лейкоз с t(15;17)(q22;q12) с образованием слитного гена PML/RARa и другие варианты острого промиелоцитарного лейкоза;
4) ОМЛ с перестройками (делецией/транслокацией) 11q23 с вовлечением гена MLL.
При выявлении у больных этих транслокаций и/или генов даже при числе бластных клеток в костном мозге менее 20 % устанавливается диагноз ОМЛ. Следует отметить, что в разных литературных источниках указывается разное число бластных клеток (> 5 или > 20 %), необходимое для установления варианта ОМЛ с перестройками 11q23.
• ФАБ-варианты МДС РА и РАКС с двух- или трехростковой дисплазией в классификации ВОЗ рассматриваются отдельно как с мультилинейной дисплазией.
• В связи с благоприятным прогнозом и характерными клинико-лабораторными особенностями выделен вариант МДС с изолированной аномалией del(5q).
• ХММЛ исключен из МДС и считается одним из вариантов миелодиспластических/миелопролиферативных заболеваний.
По определению классификации ВОЗ, основными признаками РА. являются анемия и дисплазия клеток эритроидного ростка. Число бластных клеток в костном мозге не превышает 5 %. Бластные клетки в крови не обнаруживаются. Число нейтрофилов и тромбоцитов у большинства больных находится в пределах нормальных значений. В гранулоцитарном и мегакариоцитарном ростках кроветворения признаки дисплазии отсутствуют или выражены незначительно.
Цитогенетические аберрации встречаются в 25 % случаев. В случаях отсутствия изменений кариотипа диагноз РА устанавливается при сохраняющихся изменениях гемопоэза в течение 6 мес. Частота РА составляет около 5—10 % от всех случаев миелодиспластических синдромов (МДС).
Сопоставление ФАБ- и ВОЗ-классификаций миелодиспластических синдромов (МДС)
К основным симптомам РАКС относятся анемия и дисплазия клеток эритроидного ростка с обязательным наличием 15 % и более кольцевых сидеробластов, содержащих не менее 10 железосодержащих гранул, расположенных вокруг ядра и занимающих не менее 1/3 его окружности. Бластные клетки в крови отсутствуют, а в костном мозге их число составляет
ВОЗ-классификация миелодиспластического синдрома (МДС)
| Варианты миелодиспластического синдрома (МДС) | Показатели периферической крови | Показатели костного мозга | |||
| Рефрактерная анемия | — анемия > 6 месяцев — бластов нет или единичные | — дисплазия только эритроидного ростка — 6 месяцев — бластов нет | — дисплазия только эритроидного ростка — > 15% кольцевых сидеробластов — 9 /л моноцитов | — дисплазия > 10% клеток в > 2 миелоидных клеточных линиях — 9 /л моноцитов | — дисплазия > 10% клеток в > 2 миелоидных клеточных линиях — 15% кольцевых сидеробластов |
| Рефрактерная анемия с избытком бластов-1 | — цитопения — 9 /л моноцитов | — одно- или мультилинейная дисплазия — 5-9% бластов — нет телец Ауэра | |||
| Рефрактерная анемия с избытком бластов-2 | — цитопения — 5-19% бластов — тельца Ауэра ± — 9 /л моноцитов | — одно- или мультилинейная дисплазия — 10-19% бластов — тельца Ауэра + | |||
| Неклассифицируемый миелодиспластический синдром (МДС) | — цитопения — бластов нет или единичные — нет телец Ауэра | — однолинейная дисплазия гранулоцитарного или мегакариоцитарного ростка — |
Алгоритм диагностики вариантов миелодиспластических синдромов включает в себя следующие этапы:
1) определение числа бластных клеток в костном мозге и крови. При их числе > 20 % устанавливается диагноз ОЛ;
2) в том случае, если количество нормобластов костного мозга превышает 50 %, число (%) бластных клеток рассчитывают от числа неэритроидных клеток (а не от общего числа ядросодержащих клеток костного мозга). Например, при числе нормобластов 60 %, а бластных клеток 10 %, истинное количество бластных клеток будет рассчитываться не от 100, а от оставшихся 40 неэритроидных клеток и составит 25 % (а не 10 %);
3) у остальных больных определяется абсолютное число моноцитов в крови, при увеличении их более 1,0*109/л следует проводить дифференциальную диагностику среди вариантов миелодиспластических/ миелопролиферативных заболеваний;
4) при отсутствии моноцитоза с числом бластных клеток в костном мозге 5—20 % устанавливается диагноз РАИБ;
5) при отсутствии моноцитоза, числе бластных клеток в костном мозге менее 5 % и анемии устанавливается диагноз РА (при дисплазии только клеток эритроидного ростка) или РЦМД (при мультилиней-ной дисплазии);
6) далее необходимо провести окраску препаратов на наличие сидерофильных гранул в нормобластах. При наличии кольцевых сидеробластов более 15 % от всех ядерных клеток определяется вариант РАКС (при дисплазии только клеток эритроидного ростка) или РЦМД-КС (при мультилинейной дисплазии);
7) в том случае, если у больных РА или значительно реже — РАКС при цитогенетическом исследовании обнаруживается изолированная делеция 5q и имеются характерные гематологические изменения, диагностируется МДС с изолированной del(5q);
8) при отсутствии моноцитоза и анемии, числе бластных клеток в костном мозге менее 5 % устанавливается диагноз МДС-Н.
Согласно классификации ВОЗ, вторичные МДС объединены со вторичными ОМЛ и рассматриваются в рамках ОМЛ как «острые миелоидные лейкозы и миелодиспластические синдромы, связанные с лечением». Как указывалось, эта группа заболеваний разделена на два подварианта в зависимости от этиологических факторов: первый — индуцированный ал-килирующими препаратами и/или лучевой терапией, второй — ингибиторами топоизомеразы II. Их диагностика бывает значительно затруднена, особенно у пациентов, продолжающих получать химиотерапию и/или лучевое лечение, при подозрении на развитие миелодиспластического синдрома с нормальным числом бластных клеток.
Нередко цитопения является противопоказанием к дальнейшей терапии первого заболевания, а отсутствие убедительных признаков миелодиспластического синдрома не позволяет проводить его лечение, в связи с чем диагноз миелодиспластического синдрома устанавливают только ретроспективно, после обнаружения увеличенного числа бластных клеток. В подобных ситуациях определяющую роль может играть цитогенетическое исследование, которое в 80—90 % случаев выявляет наличие неопластического клона.
При вторичном характере миелодиспластического синдрома, как и при первичном, отсутствуют какие-либо строго специфические клинические симптомы. Вторичные миелодиспластические синдромы отличаются прежде всего неблагоприятным прогнозом, а также частотой или выраженностью некоторых лабораторных признаков, реже — клиническими проявлениями (которые могут являться симптомами первого заболевания, а не МДС).
Характерными признаками вторичных миелодиспластических синдромов, по мнению авторов ФАБ-классификации, являются: гипоклеточный костный мозг, сочетание фиброза с повышенной клеточностью костного мозга, а также частые случаи обнаружения в костном мозге кольцевых сидеробластов. В крови и костном мозге могут определяться предшественники мегакариоцитов. Другие исследователи к типичным проявлениям вторичных миелодиспластических синдромов относят частые инфекционные осложнения, высокую частоту трехростковой дисплазии, макро- и овалоцитоз эритроцитов, наличие в крови нормоцитов, нейтрофилов со сниженным числом гранул и пельгероидные формы нейтрофилов.
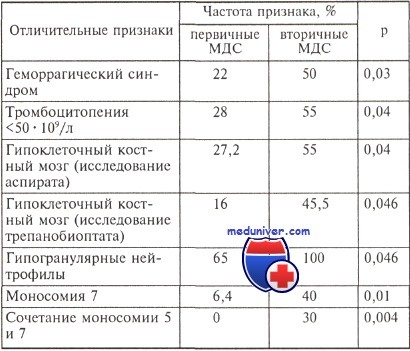
Достоверно различающиеся клинико-лабораторные признаки при первичных и вторичных миелодиспластических синдромов (МДС)
В костном мозге, как правило, выявляется менее 5 % бластных клеток, дисплазия трех ростков гемопоэза более выражена, чем при первичных миелодиспластических синдромов, в 25 % случаев первыми признаками вторичных миелодиспластических синдромов является увеличение числа базофилов в крови и/или костном мозге.
Как показали результаты нашего исследования, между первичными и вторичными миелодиспластическими синдромами (82 и 20 больных соответственно) был выявлен ряд статистически значимых различий.
Кроме того, при вторичных миелодиспластических синдромов отмечена меньшая общая выживаемость по сравнению с первичными (медианы 5,3 и 24,1 мес соответственно, р = 0,0001).
По данным ВОЗ, острые миелоидные лейкозы (ОМЛ) и миелодиспластические синдромы (МДС), связанные с применением алкилирующих препаратов и/или лучевой терапии, часто характеризуются первоначальным развитием миелодиспластических синдромов, представленных как «ранними», так и «продвинутыми» вариантами. Лишь незначительная часть больных доживает до развития острого лейкоза. Исходный диагноз острого лейкоза при этом подварианте устанавливают у меньшей части пациентов. Продолжительность периода от воздействия указанных мутагенных факторов до развития вторичного МДС/ОМЛ составляет в среднем 5—6 лет.
Бластные клетки часто экспрессируют ген MDR-1, который кодирует трансмембранную помпу, участвующую в выведении из клеток химиопрепаратов. Считается, что мутация данного гена является одной из причин лекарственной устойчивости опухолевых клеток.
ОМЛ и МДС, связанные с применением ингибиторов топоизомеразы II, развиваются в более ранние сроки (в среднем через 33—34 мес). Для этого подварианта характерно отсутствие отчетливого периода МДС, и у большинства больных исходно диагностируется острый лейкоз.
Таким образом, в классификации ВОЗ увеличилось число вариантов миелодиспластических синдромов, и каждому из них дана более детальная характеристика, внесен ряд исключений из определения миелодиспластического синдрома, выделена отдельная группа миелопролиферативных/миелодиспластических заболеваний и ОМЛ/МДС, связанных с лечением, для ряда заболеваний указаны дифференциально-диагностические клинические и лабораторные признаки, а также данные прогноза. Увеличение до 8 вариантов МДС в классификации ВОЗ, обусловленное новым пониманием биологии гемобластозов на основании морфологических, цитогенетических и молекулярно-биологических исследований, направлено на более индивидуальный подход к терапии.
После обсуждения в 1997 г. новой версии классификации миелодиспластических синдромов наибольшие сомнения гематологов вызвало уменьшение числа бластных клеток, определяющего границу между ОМЛ и МДС, поскольку основным аргументом этого изменения было отсутствие значимых различий между выживаемостью больных РАИБ-Т и ОМЛ. В связи с этим было опубликовано сравнение не результатов терапии, во многом обусловленных выбором программы лечения, а биологических особенностей, в частности, кариотипа, активности каспазы-3, уровня VEGF-, PNCA-позитивных клеток (как критерия пролиферативной активности) и некоторых других характеристик ОМЛ, РАИБ-Т и остальных ФАБ-вариантов миелодиспластических синдромов (РА, РАКС, РАИБ).
Результаты анализа показали значительно большее число достоверно отличающихся признаков между группами РАИБ-Т и ОМЛ, чем при сравнении РАИБ-Т с другими вариантами миелодиспластических синдромов. При исследовании апоптоза различными методами в аналогичных группах больных были получены достоверные различия между РАИБ-Т и ОМЛ, в то время как между РАИБ-Т и другими вариантами МДС они отсутствовали. При сравнении больных МДС и ОМЛ (279 и 523 пациента соответственно) выявлено множество различий, свидетельствующих о том, что МДС не являются начальным (предлейкемическим) этапом острого лейкоза.
Учитывая аналогичные аргументы, приводимые еще на предварительном этапе создания классификации ВОЗ, ее авторы согласились с условностью (особенно с клинической точки зрения) разделения МДС и ОМЛ, признаком которого служит только число бластных клеток, и указали на это в самой классификации.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Диагноз мдс что это такое
МИЕЛОДИСПЛАСТИЧЕСКИЙ СИНДРОМ. (ЧАСТЬ 2)
Клиника. Диагностика. Лечение.
(лекция для врачей и студентов)
Клиническая картина. Клиническая картина при различных формах МДС схожа и во многом определяется показателями периферической крови. Изменения периферической крови прямо зависят от степени нарушения созревания гемопоэтических клеток. Анемия постоянный и обязательный признак. Для нее характерны гиперхромия (высокий цветовой показатель) и макроцитоз. Уровень снижения гемоглобина может варьировать от умеренного до значительного. От степени и скорости нарастания анемии будет зависеть самочувствие больного. При медленном снижении гемоглобина организм успевает адаптироваться к гипоксии и количество жалоб у больных может быть минимальным. Если анемия развивается быстро, больные предъявляют жалобы на общую слабость, утомляемость, сердцебиение, одышку. Может утяжеляться течение ишемической болезни сердца, появляются признаки сердечной недостаточности.
Снижение количества зрелых гранулоцитов (нейтропения), а также их функциональная несостоятельность влекут за собой инфекционные осложнения. У 10 % больных развиваются стоматиты, гингивиты, пневмонии, инфекция мочевыводящих путей, абсцессы различной локализации, сепсис. У 20 % больных данной группы инфекционные осложнения становятся причиной смерти. Наиболее многочислены осложнения бактериальной природы, возбудителями которых являются Escherichia coli, Pseudomonas pyocyanea, Klebsiella pneumoniae, Staphylococcus aureus и Streptococcus fecalis. Также достаточно часто тяжелые инфекционные осложнения вызываются Pneumocystic carinii, Cryptococcus neoformous, Candida albicaus, Aspergillus fumigatus и цитомегаловирусом, что связано с функциональной неполноценностью Т-лимфоцитов при МДС.
Клинически значимая тромбоцитопения (приводящая к развитию геморрагического диатеза с петехиально-пятнистым типом кровоточивости) встречается у 15 % больных МДС. У половины из них кровотечение или кровоизлияния становятся причиной смерти. В некоторых случаях МДС, как правило у больных рефрактерной анемией, может отмечаться тромбоцитоз. Проявления гиперпластического синдрома в виде спленомегалии, гепатомегалии, лимфоаденопатии и специфического поражения кожи (лейкемиды) имеют место в основном у больных ХММЛ.
Спленомегалия встречается у 17 % таких больных, гепатомегалия у 13 %, а лейкемиды у 10 %.
Диагностика. Отправной точкой диагностического поиска являются, как правило, жалобы связанные со снижением уровня гемоглобина, подкрепляемые выявлением гиперхромной, макроцитарной анемии при исследовании периферической крови. Выявление при первичном осмотре, наряду с анемическими жалобами, явлений геморрагического диатеза и/или гиперпластического синдрома позволяют сформировать представление о
патологии системы крови еще до получения результатов лабораторных исследований. Наличие би- или трицитопении в периферической крови является абсолютным показанием для морфологического исследования костного мозга. При исследовании аспирата костного мозга у больных МДС в большинстве случаев определяется гиперплазия всех ростков кроветворения и обязательно выявляются признаки дисплазии клеток (смотри «Миелодиспластический синдром. Часть 1»). Максимальную информативность имеет гистологическое исследование костного мозга, получаемого методом трепанобиопсии. Гистологическое исследование позволяет обнаружить высоко специфичную для МДС морфологическую картину.
В качестве вспомогательного метода диагностики может быть использовано цитогенетическое исследование кариотипа гемопоэтических клеток. Различные хромосомные поломки выявляются у 48 % больных МДС. Частота аномалий кариотипа варьирует в зависимости от нозологического варианта МДС. Так у больных РА хромосомные поломки обнаруживаются в 30 % случаев, а у больных РАИБтранс в 60 %. Выявление хромосомных аномалий имеет большое значение для определения прогноза течения заболевания.
Наиболее часто встречающимся изменением кариотипа у больных РА является делеция (утрата) части длинного плеча пятой хромосомы (5q-). Данная аномалия чаще выявляется у женщин (соотношение мужчин и женщин среди заболевших составляет 1:5). Для больных с такой хромосомной поломкой характерны ярко выраженые морфологические аномалии мегакариоцитов (микромегакариоциты), тромбоцитоз периферической крови и достаточно благоприятное течение заболевания с низкой частотой трансформации в острый лейкоз.
Диагноз складывается из морфологически подтвержденного представления о наличии у больного миелодиспластического синдрома и окончательно формулируется (нозологическая форма) на основании количественных критериев миелограммы и гемограммы ( FAB- классификация):
Дифференциальный диагноз. Направление дифференциально-диагностического поиска будет зависеть от характера изменений гемограммы. Выявление гиперхромной, макроцитарной анемии как моносимптома или в сочетании с нейтропенией и/или тромбоцитопенией делает необходимым проведение дифференциального диагноза МДС с:
— витамин В12-дефицитной анемией;
— пароксизмальной ночной гемоглобинурии;
— гипопластическим и алейкемическим вариантами острого лейкоза;
— метастазами рака в костный мозг.
При выявлении в анализе периферической крови би- или трицитопении, бластов, промиелоцитов и миелоцитов, является абсолютным показанием для гистологического исследования костного мозга, сводящего вопрос о дифференциальном диагнозе к минимуму.
Лечение. Для лечение больных рефрактерной анемией (РА) используется заместительно-трансфузионная и симптоматическая терапия. Зависимость от трансфузий эритроцитарной массы может колебаться в широких пределах. При наличии глубокой тромбоцитопении и/или тяжелых проявлений геморрагического диатеза показаны трансфузии тромбоцитарной массы.
Длительная заместительная терапия эритроцитарной массой со временем приводит к избыточному накоплению железа в организме. В связи с этим, больным необходимо мониторировать уровень сывороточного железа. При увеличении его содержания свыше 30 мкмоль/л необходимо вводить десферал для профилактики гемосидероза внутренних органов.
Химиотерапия больным РА не проводится. Применение глюкокортикоидов, андрогенов, анаболических препаратов иногда имеет положительный эффект, но длительность выживания больных не возрастает. Кроме того, доказано, что при лечении препаратами этих групп увеличивается частота трансформации в острый лейкоз.
Рефрактерная анемия с кольцевыми сидеробластами (РАС) является самой доброкачественной формой МДС. Зависимость от гемотрансфузий у больных РАС невысока. В другой терапии они, как правило, не нуждаются и длительно сохраняют высокое качество жизни.
Единственным методом лечения больных РАИБ и РАИБтранс, позволяющим рассчитывать на излечение является аллогенная трансплантация костного мозга. При отсутствии донора, больным РАИБ и РАИБтранс показана химиотерапия. Лечение цитостатиками начинают у больных с количеством бластов в костном мозге свыше 10%. Применение интенсивной химиотерапии позволяет добиться ремиссии у 20-30 % больных, но, к сожалению, длительность ремиссии не превышает в среднем двух месяцев и не влияет на общую продолжительность жизни больного. В качестве базисного препарата для химиотерапии используется цитозар. Применяется также этопозид и рубомицин. Дозы и схемы введения различны. Проведение химиотерапии позволяет уменьшить зависимость больных от гемотрансфузий и продлить длительность жизни.
Больные ХММЛ в дебюте заболевания нуждаются только в трансфузионной и симптоматической терапии. При увеличении количества бластов возникают показания к цитостатической терапии. Базисным препаратом для проведения химиотерапии у больных ХММЛ является этопозид.
При развитии острого лейкоза у больных любой формой МДС как правило проводится полихимиотерапия принятая для данного варианта острого лейкоза. Следует отметить, что острый лейкоз, развившийся из предшествующего МДС, плохо поддается терапии. Ремиссию удается получить редко и она не продолжительна.
[an error occurred while processing this directive]