диоксид аммония что это
Что такое аммоний и где его используют
Содержание статьи
Аммоний – химическое вещество, образующееся в результате взаимодействия атомов азота и водорода (формула – NH4), активно использующееся в различных сферах деятельности человека. Аммоний обнаруживается в составе более сложных соединений и никогда в чистом виде. К таким соединениям относятся: хлорид аммония или нашатырь, при взаимодействии с водой образующий нашатырный спирт, сульфат аммония, аммоний ацетат, нитрат аммония.
В природе возникновение подобных соединений связано с вулканической активностью планеты, соли хлорида аммония присутствуют в почве и горных породах в местах разломов земной коры, в пещерах, вблизи часто извергающихся вулканов. Незначительное количество нашатыря образуется в процессе разложения продуктов жизнедеятельности животных. В промышленных масштабах аммоний получают в лабораторных условиях.
Использование аммония в промышленности
Сфера применения этого вещества чрезвычайно широка – от производства строительных материалов до пищевой промышленности.
Хлорид аммония получил название нашатыря, это вещество представляет собой белый мелкокристаллический порошок, хорошо растворимый в воде и не имеющий запаха, используется при производстве стали, в качестве удобрения в сельском хозяйстве, как лекарственный препарат, обладающий диуретическим действием, в медицине.
Сульфат аммония – это порошок без запаха и цвета, хорошо растворимый в воде и разлагающийся при нагревании до 250°С. Основные сферы применения: пищевая, химическая, горнодобывающая промышленность, производство кормов для животных, строительных материалов. Сульфат аммония обладает легким дезинфицирующим действием, используется в разработке вакцин.
Аммония ацетат – бесцветный или белый кристаллический порошок, получаемый при взаимодействии раствора аммиака с уксусной кислотой. Наиболее часто применяется в химической промышленности, при изготовлении и хранении изделий из кожи, в качестве консерванта при производстве некоторых продуктов питания.
Аммоний как пищевая добавка
Различные соединения аммония применяются в пищевой промышленности в качестве консерванта и пищевой добавки:
Е510 (хлорид аммония). Используется в основном в хлебобулочном производстве в качестве разрыхлителя теста, в пивоварении для ускорения процесса брожения пива. В ряде стран пищевая добавка Е510 запрещена, в России добавляется в дрожжи, приправы, соусы, мучные изделия.
Е517 (сульфат аммония). Применяется в качестве заменителя соли, эмульгатора, ускоряет процесс поднятия хлеба, улучшает качество муки, вещество разрешено к употреблению в пищу в России и странах ЕС.
Е264 (ацетат аммония). Способствует увеличению срока годности пищевых продуктов, предотвращает появление плесени, улучшает вкус, запрещен к употреблению в большинстве стран мира, в том числе в России.
Бихромат аммония
Не снимайте пометку о выставлении на переименование до окончания обсуждения.
Дата постановки — 25 декабря 2012.
| Бихромат аммония | |
 | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Дихромат аммония |
| Традиционные названия | Аммоний двухромовокислый |
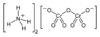
| Химическая формула | (NH4)2Cr2O7 |
| Физические свойства | |
| Молярная масса | 252,07 г/моль |
| Плотность | 2,115 г/см³ |
| Термические свойства | |
| Молярная теплоёмкость (ст. усл.) | 293 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | -1810 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 35,6 20 ; 115 100 ; |
| Классификация | |
| Рег. номер CAS | 7789-09-5 |
| SMILES | [O-][Cr](=O)(=O)O[Cr]([O-])(=O)=O.[NH4+].[NH4+] |
| RTECS | HX7650000 |
| Безопасность | |
| Токсичность | Токсичен. Летальная доза 2 грамма |
Бихромат аммония (дихромат) — кристаллическое вещество оранжево-красного цвета, хорошо растворимое в воде.
Содержание
Получение
Бихромат аммония получают взаимодействием оксида хрома(VI) с разбавленным раствором аммиака:
Физические свойства
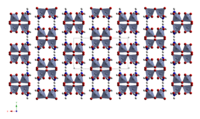
Оранжево-красные кристаллы принадлежат к моноклинной сингонии, пространственная группа C 2/c, параметры ячейки a = 1,327 нм, b = 0,754 нм, c = 0,778 нм, β = 93,70°, Z = 4.
Плотность 2,15 г/см³. Растворяется в воде и этаноле, не растворяется в ацетоне.
Химические свойства
Применение
Применяются в металлообрабатывающей, кожевенной, текстильной, химической, лакокрасочной, фармацевтической, керамической, спичечной промышленности.
Токсичность
Ссылки
Литература
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Полезное
Смотреть что такое «Бихромат аммония» в других словарях:
бихромат аммония — двухромовокислый аммоний … Cловарь химических синонимов I
Бихромат серебра — Общие Систематическое наименование Бихромат серебра Традиционные названия Хромовокислое серебро Химическая формула Ag2Cr2O7 Физические свойства … Википедия
Дихромат аммония — Дихромат аммония … Википедия
Хромат аммония — Общие Систематическое наименование Хромат аммония Традиционные названия Хромовокислый аммоний Химическая формула (NH4)2CrO4 Физические свойства Состояние … Википедия
двухромовокислый аммоний — бихромат аммония … Cловарь химических синонимов I
Ammonium dichromate — Бихромат аммония, (NH4)2Cr2O7 … Краткий толковый словарь по полиграфии
Хром — (Chrom, Chrome, Chromium; при О = 16 атомн. вес Cr = 52,1) принадлежит к числу элементарных веществ металлического характера. Однако, занимая по своему атомному весу шестое место в том большом периоде естественной системы элементов, который… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Фтористый хромил — Общие Систематическое наименование Фтористый хромил Традиционные названия Диоксид дифторид хрома Химическая формула CrO2F2 Физические свойства … Википедия
Дихромат рубидия — Общие Систематическое наименование Дихромат рубидия Традиционные названия Бихромат рубидия; двухромовокислый рубидий Химическая формула Rb2Cr2O7 Физические свойства … Википедия
Хромат калия — Хромат калия … Википедия
Аммоний двухромовокислый — очень опасный, но полезный в экономике реактив
Аммоний двухромовокислый — неорганическое соединение, 
Свойства
Порошкообразное вещество, состоящее из кристаллов ярко-красного или красно-оранжевого цвета. Водорастворимо, растворимость увеличивается с ростом температуры. Растворяется также в этиловом спирте и диметилсульфоксиде. Не растворяется в ацетоне. При нагревании разлагается с выделением азота, паров воды и выбросом раскаленных твердых частиц оксида хрома. Эта реакция выглядит очень эффектно и даже получила отдельное название «Вулкан Бёттгера» («вулкан на столе», «химический вулкан»). Раньше ее часто использовали для демонстрации в учебных заведениях, но из-за токсичности реактива сейчас она запрещена в школах большинства стран мира. Бихромат аммония горюч, взрывоопасен, токсичен.
 |  |
| Вытяжной шкаф ВА-104, комплектация «Люкс» | Аммоний двухромовокислый |
С точки зрения химии — сильный окислитель, химически активный реагент. Бурно реагирует при контакте с органическими материалами, восстановителями, горючими веществами (воспламеняет их). Вступает в реакции с галогеноводородами. Взаимодействие со щелочами переводит бихромат аммония (NH4)2Cr2O7 в хромат (NH4)2CrO4.
Меры предосторожности
Вещество относится к 1-му классу опасности. Фатальная доза для человека — единовременное принятие 2 г реактива. Частицы пыли в воздухе могут вызвать тяжелое отравление при их вдыхании. При регулярном и длительном контакте вызывает аллергии, раздражение органов дыхания и слизистых глаз, провоцирует развитие онкологических заболеваний, астмы, трудно заживающих язв на коже. Реактив вызывает мутагенные изменения. При проглатывании легко всасывается в кровь, вызывает заболевания печени и почек, органов дыхания, ЖКТ.
Соединение крайне опасно для окружающей среды, особенно для водных экосистем. Может накапливаться в живых организмах.
На производстве рабочее место должно быть оснащено общей принудительной вентиляцией. Сотрудники должны пользоваться защитной одеждой, резиновыми перчатками, респираторами и защитными очками. В лабораториях опыты проводят в вытяжном шкафу.
Хранят на крытых складах, в прохладных помещениях, вдали от горючих материалов, источников тепла, источников искр. При повышении температуры реактив начинает разлагаться, что может привести к взрыву герметичных контейнеров.
Дихромат аммония
| Дихромат аммония | |
|---|---|
  | |
 | |
| Систематическое наименование | Дихромат аммония |
| Традиционные названия | Аммоний двухромовокислый, бихромат аммония |
| Хим. формула | (NH4)2Cr2O7 |
| Молярная масса | 252,07 г/моль |
| Плотность | 2,115 г/см³ |
| Температура | |
| • разложения | 180 °C |
| Мол. теплоёмк. | 293 Дж/(моль·К) |
| Энтальпия | |
| • образования | -1810 кДж/моль |
| Растворимость | |
| • в воде | 35,6 20 ; 115 100 ; |
| ГОСТ | ГОСТ 3763-76 |
| Рег. номер CAS | 7789-09-5 |
| PubChem | 24600 |
| Рег. номер EINECS | 232-143-1 |
| SMILES | |
| RTECS | HX7650000 |
| Номер ООН | 1439 |
| ChemSpider | 23002 |
| Предельная концентрация | 10 мкг/м 3 воздуха |
| ЛД50 | 20..250 мг/кг |
| Токсичность | токсин, канцероген, аллерген, мутаген |
| Пиктограммы ECB |       |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Дихромат аммония— кристаллическое вещество оранжево-красного цвета, хорошо растворимое в воде.
Содержание
Получение
Дихромат аммония получают взаимодействием оксида хрома VI с разбавленным раствором аммиака:
Физические свойства
Оранжево-красные кристаллы принадлежат к моноклинной сингонии, пространственная группа C 2/c, параметры ячейки a = 1,327 нм, b = 0,754 нм, c = 0,778 нм, β = 93,70°, Z = 4.
Плотность 2,15 г/см³. Растворяется в воде и этаноле, не растворяется в ацетоне.
Химические свойства
Применение
Применяются в металлообрабатывающей, кожевенной, текстильной, химической, лакокрасочной, фармацевтической, керамической, спичечной промышленности.
Опасность
Биологическая опасность
В России для всех солей дихромовой кислоты класс опасности 1, максимальная разовая концентрация ПДК в воздухе рабочей зоны составляет 10 мкг/м 3 (1998 год). В США предельный пороговый уровень однократного воздействия составляет 50 мкг/м3 воздуха (ACGIH, 2000 год). Средневзвешенная концентрация за 8-часовой рабочий день в воздухе не более 0,5 мкг/м 3 (OSHA, 2006 год). В ЕС все соединения шестивалентного хрома подпадают под директиву RoHS. Для питьевой воды и пищи ВОЗ рекомендует максимальное содержание шестивалентного хрома не более 50 мкг/кг.
Вещество очень токсично для водных организмов, вызывает долговременные изменения в водной экосистеме. Накапливается в живых организмах.
Вследствие высокой токсичности солей шестивалентного хрома демонстрация зрелищного опыта «вулкан Бёттгера» запрещена в школах многих стран.
Химическая опасность
При нагревании в герметичных контейнерах взрывоопасен. В январе 1986 года двое рабочих погибли и 14 пострадали в США при взрыве нескольких сотен килограмм вещества во время сушки.
Пожарная опасность
Горюч, самовоспламеняется при 225°С. Является окислителем, реагирует с горючими материалами, воспламеняя их.
Дихромат аммония
| Дихромат аммония | |
 | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Дихромат аммония |
| Традиционные названия | Аммоний двухромовокислый |
| Химическая формула | (NH4)2Cr2O7 |
| Физические свойства | |
| Молярная масса | 252,07 г/моль |
| Плотность | 2,115 г/см³ |
| Термические свойства | |
| Молярная теплоёмкость (ст. усл.) | 293 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | -1810 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 35,6 20 ; 115 100 ; |
| Классификация | |
| Рег. номер CAS | 7789-09-5 |
| SMILES | [O-][Cr](=O)(=O)O[Cr]([O-])(=O)=O.[NH4+].[NH4+] |
| RTECS | HX7650000 |
| Безопасность | |
| Токсичность | Токсичен. Летальная доза 2 грамма |
Дихромат аммония— кристаллическое вещество оранжево-красного цвета, хорошо растворимое в воде.
Содержание
Получение
Дихромат аммония получают взаимодействием оксида хрома(VI) с разбавленным раствором аммиака:
Физические свойства
Оранжево-красные кристаллы принадлежат к моноклинной сингонии, пространственная группа C 2/c, параметры ячейки a = 1,327 нм, b = 0,754 нм, c = 0,778 нм, β = 93,70°, Z = 4.
Плотность 2,15 г/см³. Растворяется в воде и этаноле, не растворяется в ацетоне.
Химические свойства
Применение
Применяются в металлообрабатывающей, кожевенной, текстильной, химической, лакокрасочной, фармацевтической, керамической, спичечной промышленности.
Токсичность
Ссылки
Литература
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Полезное
Смотреть что такое «Дихромат аммония» в других словарях:
Дихромат натрия — Дихромат натрия … Википедия
Дихромат лития — Общие Систематическое наименование Дихромат лития Традиционные названия Бихромат лития; хромовокислый литий Химическая формула Li2Cr2O7 Физические свойства … Википедия
Дихромат рубидия — Общие Систематическое наименование Дихромат рубидия Традиционные названия Бихромат рубидия; двухромовокислый рубидий Химическая формула Rb2Cr2O7 Физические свойства … Википедия
Дихромат калия — У этого термина существуют и другие значения, см. хромпик. Дихромат калия … Википедия
аммония дихромат — amonio dichromatas statusas T sritis chemija formulė (NH₄)₂Cr₂O₇ atitikmenys: angl. ammonium dichromate rus. аммония дихромат ryšiai: sinonimas – diamonio heptaoksodichromatas … Chemijos terminų aiškinamasis žodynas
Бихромат аммония — Эту страницу предлагается переименовать в Дихромат аммония. Пояснение причин и обсуждение на странице Википедия:К переименованию/25 декабря 2012. Возможно, её текущее название не соответствует нормам современного русского языка и/или… … Википедия
Хромат аммония — Общие Систематическое наименование Хромат аммония Традиционные названия Хромовокислый аммоний Химическая формула (NH4)2CrO4 Физические свойства Состояние … Википедия
Список неорганических соединений по элементам — Основная статья: Неорганические соединения Список неорганических соединений по элементам информационный список неорганических соединений, представленный в алфавитном порядке (по формуле) для каждого вещества, водородные кислоты элементов (при их… … Википедия
Хромат таллия(I) — Общие Систематическое наименование Хромат таллия(I) Традиционные названия Хромовокислый таллий Химическая формула Tl2CrO4 Физические свойства Состояние ( … Википедия






