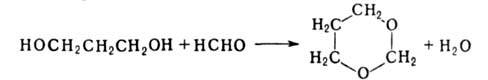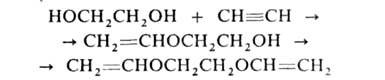диол это что в химии
Гликоли
Гликоли – органическое соединение с двумя гидроксильными группами ОН. Альтернативное название – двухатомные спирты или диолы. Общая формула вещества – CnH2n(OH)2. Простейший представитель класса двухатомных спиртов – этиленгликоль, молекула которого имеет структурную формулу НО−СН2−СН2−ОН.
Первооткрыватель класса диолов – французский ученый Шарль Вюрц, который внес большой вклад в органическую химию.
Впервые гликоли синтезировали сложным методом ученые Уильямс и Берло. Результатом их исследований стало появление двухатомного спирта с высокими эксплуатационными характеристиками. Жидкость с высокой температурой кипения и низкой температурой кристаллизации нашла применение в промышленности. С момента открытия гликоли активно используются в системах охлаждения двигателей внутреннего сгорания, холодильных установках и климатическом оборудовании.
Физические и химические свойства гликолей

Пропилен- и этиленгликоль хорошо растворяются в воде и органических растворителях – карбоновых кислотах, кетонах, аминах, спиртах. Низшие гликоли используются в качестве растворителей для большинства органических соединений кроме высших предельных и ароматических углеводородов.
Химические свойства диолов схожи с одноатомными спиртами. При взаимодействии с металлами и их солями образуют алкоголяты, при соединении с кислотами – простые и сложные эфиры. Каждая полярная гидроксильная группа вступает в химическую реакцию независимо друг от друга, что приводит к образованию смеси продуктов.
Получение гликолей
Впервые этиленгликоль был получен путем окисления этилена. Этот способ до сих пор используется в промышленности. Кроме того, для получения двухатомных спиртов также применяют:
Применение гликолей в промышленности

Самая распространенная концентрация гликоля в водном растворе, при использовании в качестве теплоносителя – 40 %. Испытания показали, что водный раствор двухатомного спирта с добавлением карбоксилатных ингибиторов коррозии сохраняет свои эксплуатационные свойства до 10 лет и более лет.
Использование водных растворов диолов с пакетом противокоррозионных присадок в качестве теплоносителя исключает появление паровых пробок в отопительной системе, уменьшает кавитацию, снижает риск эрозии металла трубок и радиатора. В комплексе это значительно увеличивает эксплуатационный ресурс оборудования.
Водные растворы гликолей с различной концентрацией используются промышленности:
В качестве теплоносителя обычно применяются растворы этиленгликоля (ЭГ, МЭГ), и пропиленгликоля (ПГ).
Двухатомные спирты
Двухатомные спирты (гликоли, или диолы) — что это за соединения
Спирты представляют собой класс органических веществ, в состав которых входит одна или несколько гидроксильных групп (—OH), связанных с атомом углерода (C) в углеводородном радикале (R—OH).
Двухатомные спирты (диолы, или гликоли) — органические соединения, содержащие в структуре молекулы две гидроксильные группы.
Основные формулы с примерами
Основные формулы гликолей:
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Диолы легко выстраиваются в гомологический ряд, сформулировать который можно с помощью гомологического ряда насыщенных углеводородов, заменяя в структуре их молекул два атома водорода на OH-группы.
Номенклатура гликолей
В номенклатуре ИЮПАК для названия двухатомных спиртов вместо окончания «-ол» используют «-диол» (пропандиол, этандиол и т. д.), а цифрами обозначают атомы углерода главной цепи, к которым присоединены две группы (OH).
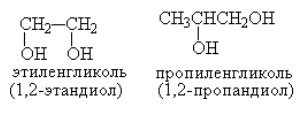
1,2-этандиол (этиленгликоль), 1,3-пропандиол, 1,2-пропандиол (пропиленгликоль), транс-1,2-циклогександиол и т. д.
Подобная систематическая номенклатура осуществляет дифференциацию 1,2-, 1,3-, 1,4-диол, т. к. от взаимного расположения OH-групп зависят химические и физические свойства веществ.
Пропиленгликоль представлен двумя изомерами:
При этом способность к вступлению в химическую реакцию и склонность к полимеризации у 1,2-пропиленгликоля выражены в меньшей степени, чем у 1,3-пропиленгликоля.
Гликоли, в структуре которых гидроксильные группы находятся возле разных атомов углерода, являются устойчивыми:
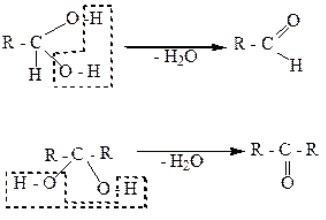
Геминальные диолы содержат две OH-группы возле одного углеродного атома, что обуславливает их неустойчивость. Такие гликоли легко разлагаются. В результате за счет гидроксильных групп отщепляется вода, и образуются альдегиды или кетоны:
Физические свойства гликолей
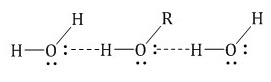
Гликоли чаще всего представляют собой густые, бесцветные, жидкости малой летучести, без запаха. Хорошо смешиваются с водой (особенно низшие диолы) и органическими растворителями (спиртами, кетонами, кислотами и аминами). Высокий показатель растворимости в воде объясняется образованием водородных связей между молекулами воды и спиртов — гидратацией:
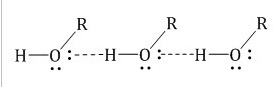
Для всех спиртов характерно образование межмолекуляр ных водородных связей, вызывающих при тяжение и ассоциацию молекул спиртов:
Из-за наличия двух гидроксильных групп диолы имеют более высокую температуру кипения и плотность в сравнении с соответствующими им одноатомными.
Большинство диолов имеют сладкий, а некоторые — горьковатый вкус.
Химические свойства гликолей и их применение
Гликоли участвуют в тех же химических реакциях, что и одноатомные спирты, но отличаются тем, что в реакцию вводится либо одна, либо обе спиртовые группы. Поэтому у них бывают два ряда производных: полные и неполные.
При взаимодействии этиленгликоля с натрием (Na) получаются гликоляты:
При этом водород в диолах замещается легче, чем в одноатомных спиртах.
В результате межмолекулярного отсоединения воды в реакции по перегону этиленгликоля с серной кислотой \((<\mathrm H>_2<\mathrm
С помощью реакции гидратации получают этиленгликоль — самый простой двухатомный спирт и самое востребованное химическое соединение в промышленности и быту.
Этиленгликоль (1,2-этандиол, 1,2-диоксиэтан) — органическое соединение, простейший двухатомный спирт. Представляет собой жидкость без цвета и запаха, прозрачную и немного маслянистую со сладковатым вкусом. Легковоспламеняемый и токсичный (3-й класс опасности).
Химическая формула этиленгликоля:
Способность этиленгликоля понижать температуру замерзания воды нашла широкое применение в качестве охлаждающего реагента систем охлаждения двигателей и компьютеров, антифризов и тормозных жидкостей. Из-за коррозийной активности применяется с ингибиторами.
Благодаря высокой гигроскопичности этиленгликоль используется в растворении и изготовлении красок для печати, производстве чернил для шариковых ручек и т. д. Крайне популярен этиленгликоль в производстве пленкообразующих материалов, лаков, волокон (лавсана, например), в органическом синтезе простых и сложных эфиров.
Виды спиртов по характеру углеводородного радикала
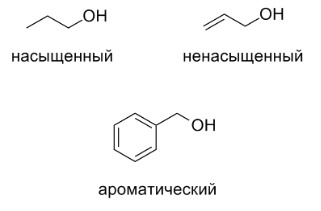
По структуре углеводородного радикала, связанного с атомом кислорода, спирты бывают следующих видов: предельные (насыщенные), непредельные (ненасыщенные), ароматические.
Предельные спирты
Предельные (насыщенные, алканолы) спирты — органические вещества, производные предельных углеводородов, в структуре которых атом водорода замещен на гидроксильную группу.
Для предельных спиртов характерна:
Изомерия — явление различия химических и физических свойств веществ при идентичности их количественного и качественного состава.
Начиная с бутанола, прослеживается изомерия углеродного скелета (1-бутанол: \(<\mathrm<СН>>_3-<\mathrm<СН>>_2-<\mathrm<СН>>_2-<\mathrm<СН>>_2-\mathrm<ОН>\) ; 2-метилпропанол-1: \(<\mathrm<СН>>_3-\mathrm<СН>(<\mathrm<СН>>_3)-<\mathrm<СН>>_2\mathrm<ОН>\) ), при которой наименование спирта записывается с использованием двух цифр. Первая из них показывает положение метильной группы, вторая — гидроксильной.
Непредельные спирты
Непредельные (ненасыщенные) содержат кратные (двойные и тройные) межуглеродные связи:
Непредельные спирты подразделяются на два основных типа:
Спирты первого типа неустойчивы и сразу же превращаются в соответствующие изомерные карбонильные соединения.
Ароматические спирты
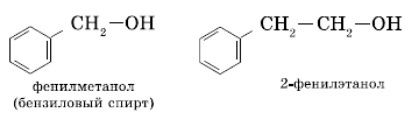
Ароматические спирты являются производными жирноароматических углеводородов, имеющими в структуре фенильный радикал (производную от бензола), иными словами — ароматическое кольцо и гидроксильную группу, не связанные напрямую, а через атомы углерода.
К ароматическим спиртам относятся фенилметанол (бензиловый спирт) и 2-фенилэтанол.
Ароматические спирты не следует путать с фенолами, у которых группа (OH) связана с бензольным кольцом без посредников.
Дополнительная (внутренняя) классификация
Спирты также дифференцируют по следующим признакам.
В зависимости от местонахождения OH-группы в молекуле:
По числу OH-групп в молекуле соединения:
По количеству углеродных атомов в структуре молекулы спирта:
Этиленгликоль: химические свойства и получение
Этиленгликоль C2H4(OH)2 или CH2(OH)CH2OH, этандиол-1,2 – это органическое вещество, предельный двухатомный спирт .
Общая формула предельных нециклических двухатомных спиртов: CnH2n+2O2 или CnH2n(OН)2
Строение этиленгликоля
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому этиленгликоль – жидкость с относительно высокой температурой кипения.
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Химические свойства этиленгликоля
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
1. Кислотные свойства
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии этиленгликоля с растворами щелочей реакция практически не идет, т. к. образующийся алкоголят почти полностью гидролизуется водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому этиленгликоль не взаимодействует с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Этиленгликоль взаимодействует с активными металлами (щелочными и щелочноземельными).
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии этиленгликоля с галогеноводородами группы ОН замещаются на галоген и образуются дигалогеналкан.
| Например, этиленгликоль реагирует с бромоводородом. |
2.2. Этерификация (образование сложных эфиров)
Многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, этиленгликоль реагирует с уксусной кислотой с образованием эфира: |
2.4. Взаимодействие с кислотами-гидроксидами
Этиленгликоль взаимодействует и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии этиленгликоля с азотной кислотой образуется нитроэтиленгликоль : |
3. Дегидратация
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. При высокой температуре (180 о С) протекает внутримолекулярная дегидратация этиленгликоля и образуется соответствующий ацетальдегид.
4. Окисление этиленгликоля
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Этиленгликоль можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества.
4.2. Окисление кислородом в присутствии катализатора
Этиленгликоль можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.).
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) этиленгликоль окисляется до щавелевой кислоты.
| Например, при взаимодействии этиленгликоля с перманганатом калия в серной кислоте образуется щавелевая кислота |
4.4. Горение этиленгликоля
При сгорании этиленгликоля образуется углекислый газ и вода и выделяется большое количество теплоты.
5. Дегидрирование этаниленгликоля
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования.
| Например, при дегидрировании этиленгликоля образуется этандиаль |
Получение этиленгликоля
1. Щелочной гидролиз дигалогеналканов
При взаимодействии дигалогеналканов с водным раствором щелочей образуются двухатомные спирты. Атомы галогенов в дигалогеналканах замещаются на гидроксогруппы.
| Например, при нагревании 1,2-дихлорэтана с водным раствором гидроксида натрия образуется этиленгликоль |
2. Гидрирование карбонильных соединений
| Например, при гидрировании этандиаля образуется этиленгликоль |
О=CН-CH=O + 2H2 → CH2(OH)-CH2OH
3. Гидролиз сложных эфиров
При гидролизе сложных эфиров этиленгликоля и карбоновых кислот образуются этиленгликоль и карбоновая кислота.
4. Мягкое окисление алкенов
Мягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи.
При этом образуются двухатомные спирты (диолы).
ГЛИКОЛИ
ГЛИКОЛИ (алкандиолы), двухатомные спирты жирного ряда общей ф-лы СnН2n(ОН)2. Группы ОН в молекулах могут находиться у одного атома С (геминальные гликоли), у соседних атомов (вицинальные) и т.д. Названия гликолей производят от названий соответствующих алканов или ал-кенов и соотв. суффиксов «диол» или «гликоль», напр. НОСН2СН2ОН-1,2-этандиол или этиленгликоль, НОСН2СН2СН2ОН-1,3-пропандиол или 1,3-пропиленгликоль (триметиленгликоль).
Наиб, практич. значение имеют этиленгликоль, пропиленгликоли, бутиленгликоли и нек-рые их производные, содержащие одну или более простых эфирных групп в молекуле (т.н. полигликоли, напр. диэтиленгликолъ), высокомолекулярные полиэтиленгликоли (см. Полиэтиленоксид).
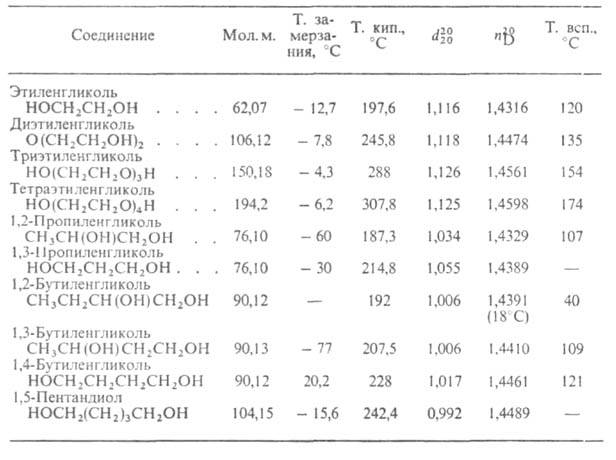
СВОЙСТВА ГЛИКОЛЕЙ
Низшие гликоли (С2-С7) смешиваются с водой, спиртами, альдегидами, кетонами, к-тами, аминами во всех соотношениях. Гликоли, особенно полигликоли, хорошо растворяют синтетич. смолы, лаки, краски, эфирные масла, каучуки. Ароматич. углеводороды растворяются в гликолях ограниченно, предельные алифатич. углеводороды не растворяются. Благодаря водородным связям гликоли образуют ассоциаты с водой (гидраты), аминами и др. При образовании гидратов значительно понижается т-ра замерзания водных р-ров гликолей. На этом св-ве основано применение их как антифризов.
С альдегидами и кетонами (кат.-FеС13, Н3РО4) гликоли дают циклич. ацетали (1,2-гликоль-1,3-диоксоланы, 1,3-гликоль-1,3-диоксаны), напр.:
Под действием щелочных катализаторов гликоли реагируют с ацетиленом с образованием виниловых и дивиниловых эфиров: напр.:
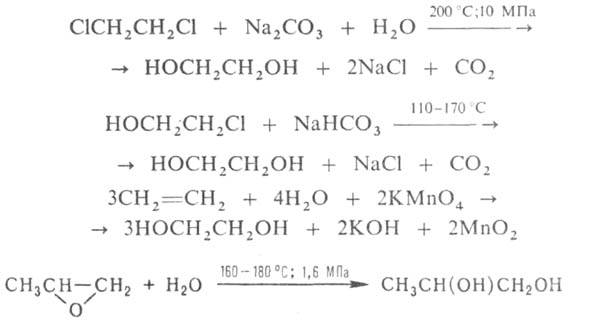
Кислородом гликоли окисляются до пероксидов, формальдегида, ацетона, муравьиной к-ты, сложных эфиров и др.; действием К2Сr2О7 или КМnО4-до СО2 и Н2О. Осн. методы синтеза гликолей:
Гликоли-р-рители, пластификаторы. Они применяются также для приготовления антифризов и гидравлич. жидкостей (этилен- и пропиленгликоли), для синтеза эфиров гликолей, полиэфирных смол, полиуретанов (1,2-пропиленгликоль, 1,4-бутиленгликоль), увлажнения разл. продуктов, напр. табака, казеина, желатины.
Токсичность гликолей убывает с увеличением мол. массы.
===
Исп. литература для статьи «ГЛИКОЛИ» : ДыментО.Н., Казанский К.С., Мирошников А. М., Гликоли и другие производные окисей этилена и пропилена, М., 1976; Kirk-Othmer encyclopedia, 2 ed., v. 10, N.Y., 1966. Б. Б. Чесноков.
Страница «ГЛИКОЛИ» подготовлена по материалам химической энциклопедии.
Диол это что в химии
Физические свойства гликолей
Низшие члены ряда – густые жидкости, высшие – кристаллические вещества. Температуры кипения гликолей выше, чем температуры кипения спиртов близкой молекулярной массы. Низшие гликоли хорошо растворимы в воде. Растворимость гликолей в воде выше, чем растворимость близких им по молекулярной массе спиртов. Эти факты объясняются двумя причинами. Во–первых, наличие двух спиртовых функций обусловливает большее число межмолекулярных водородных связей, образуемых молекулами гликолей, во–вторых, эти связи прочнее, так как одна спиртовая группа действует на другую как акцептор, увеличивая ее кислотность. Гликоли имеют сладковатый вкус, плотность большинства из них больше 1.
Химические свойства гликолей аналогичны свойствам одноатомных спиртов. Они могут вступать в химические взаимодействия как одной, так и двумя гидроксильными группами.
Гликоли обладают более высокой кислотностью по сравнению с одноатомными спиртами. Поэтому они также, как и последние, легко вступают во взаимодействие со щелочными металлами,
и в отличие от одноатомных спиртов, реагируют со щелочами
и некоторыми основными гидроксидами
Последняя реакция легко наблюдается как растворение Сu(OH) 2 с образованием синего раствора. Эта реакция является качественной на многоатомные спирты.
2) Образование полных и неполных эфиров с неорганическими и органическими кислотами.
Если в качестве этерифицирующих агентов используются ангидриды и хлорангидриды карбоновых кислот, то реакции этерификации диолов протекают необратимо:
Процесс окисления диолов протекает обычно по сложной схеме, включающей последовательные и параллельные реакции.
При этом, как и в случае одноатомных спиртов, по продуктам окисления можно судить о структуре диола. Так, если при окислении диола состава C4H8(OH)2 в продуктах окисления обнаруживается только уксусная кислота, то диол может иметь только формулу 2,3 – бутандиола.
Реакции дегидратации диолов могут иметь межмолекулярный или внутримолекулярный характер. Эти реакции относятся к реакциям нуклеофильного замещения. Поэтому для электрофильного отщепления “плохой” уходящей группы – OH требуется кислотный катализ.
Своеобразным типом дегидратации является пинаколиновая перегуппировка.
Пинаколиновая перегруппировка является типичной реакцией перегруппировки карбкатионов, которые образуются при протонировании пинаконов.