диспанкреатизм что это такое
Панкреатиты у детей
Проблема панкреатитов в детском возрасте на сегодняшний день не является новой, однако остается, пожалуй, наименее изученной страницей в детской гастроэнтерологии.
Проблема панкреатитов в детском возрасте на сегодняшний день не является новой, однако остается, пожалуй, наименее изученной страницей в детской гастроэнтерологии. Ее активное изучение началось после введения в повседневную практику ультразвукового исследования, которое позволило предположить относительно высокую частоту панкреатитов, в т. ч. и хронических, в структуре заболеваний органов пищеварения у детей. В 60–80-е гг. прошлого столетия эти вопросы интенсивно изучались в нашей стране и, пожалуй, много более интенсивно, чем за рубежом. В отечественной педиатрической литературе можно найти немало статей, посвященных панкреатитам у детей. Во главе этих исследований стояли А. В. Мазурин, А. М. Запрудной, И. В. Дворяковский, Н. Г. Зернов, Б. Г. Апостолов, Г. В. Римарчук, Ж. П. Гудзенко. В 1980 г. вышла книга Ж. П. Гудзенко «Панкреатиты у детей», которая так и осталась единственной монографией, посвященной данной теме. В настоящее время исследования проблемы панкреатитов в детском возрасте продолжаются как в нашей стране, так и за рубежом. Особый посыл для развития этого направления дали выделение и генетическая идентификация т. н. наследственного панкреатита. Тем не менее, многие вопросы, как теоретические, так и непосредственно практические, остаются неразрешенными. На многочисленных форумах по гастроэнтерологии этой проблеме уделяется относительно мало внимания, не в связи с отсутствием актуальности, но из-за отсутствия ощутимого прогресса.
Частота панкреатитов у детей с заболеваниями органов пищеварения по данным различных авторов колеблется от 5 до 25%. Такой значительный разброс связан как с диагностическими сложностями, так и с отсутствием четкого терминологического определения предмета изучения. В повседневной практике обычно фигурируют четыре диагноза, так или иначе вписывающихся в тему настоящего обсуждения: острый панкреатит, хронический рецидивирующий панкреатит, хронический латентный панкреатит, реактивный панкреатит (и/или вторичные панкреатиты). Первые два заболевания достаточно однозначны с диагностической и терминологической точек зрения, и их частота может быть достоверно определена.
Что касается хронического латентного панкреатита, то его диагностика весьма затруднена ввиду отсутствия критериев, доступных для повседневного использования. Основанием для такого диагноза обычно служит выявление уплотнения паренхимы поджелудочной железы (ПЖ) и/или ее неоднородность при ультразвуковом исследовании и отсутствие соответствующей клинической симптоматики. Однако соответствуют ли эти признаки хроническому панкреатиту во всех случаях — вопрос, дать ответ на который достаточно сложно. Широкое внедрение ультразвукового исследования в клиническую педиатрическую практику выявило достаточно большое число таких находок. Это послужило поводом для беспокойства, поскольку свидетельствовало о высокой частоте хронического латентного панкреатита у детей, а также дало повод усомниться в диагностической значимости подобной интерпретации результатов в связи с возможной гипердиагностикой. Вопрос же о реактивном панкреатите вызывает еще большее число споров.
В основе панкреатита лежит деструктивный процесс в ПЖ, сопровождающийся микроциркуляторными расстройствами (которые нередко предшествуют собственно деструкции), воспалительным процессом и, в большей или меньшей степени, фиброзом. На фоне последнего может формироваться экзокринная и/или эндокринная недостаточность ПЖ. Справедливости ради следует отметить, что панкреатическая недостаточность при панкреатитах у детей развивается относительно редко. Активный деструктивный процесс в ПЖ сопровождается феноменом «уклонения панкреатических ферментов в кровь», повышением их концентрации в крови вследствие разрушения ацинарных клеток и повышения проницаемости барьера между ацинусами и кровью. Данный феномен позволяет достоверно идентифицировать деструкцию в ПЖ и диагностировать острый панкреатит или обострение хронического рецидивирующего панкреатита.
В свете представленной общей схемы острый панкреатит (а также обострение хронического) представляет собой активный деструктивный процесс в ткани ПЖ. Хронический панкреатит характеризуется фиброзом ПЖ, на фоне которого время от времени под влиянием различных провоцирующих факторов развиваются деструктивные процессы, т. е. имеют место обострения. Хронический латентный панкреатит теоретически имеет право на существование как фиброз ПЖ, также связанный с периодическими эпизодами деструкции, не проявивший себя документированными обострениями. Предполагается, что деструкция ПЖ в этом случае протекает исподволь, что приводит к отсутствию типичной клинической картины и появлению первичного хронического латентного панкреатита. Данная концепция логична, однако о частоте данного состояния мы судим лишь по данным ультразвукового исследования. Компьютерная томография (не говоря о биопсии), которая могла бы дать нам более достоверную информацию, в массовых масштабах с этой целью применяться не может. Других же признаков латентного панкреатита нет и быть не может по определению (он же латентный!). Данное обстоятельство и составляет первую серьезную проблему, стоящую перед детскими гастроэнтерологами. Причем она же распространяется и на диагностику хронического рецидивирующего панкреатита вне обострения. И именно в связи с этим мы не имеем точной статистики панкреатитов у детей.
Второй вопрос — реактивный панкреатит. Под этим понятием часто скрываются два состояния, иногда различающихся, а иногда и совпадающих. Во-первых, речь может идти о вторичном панкреатите, явившемся следствием какого-либо заболевания, в т. ч. органов пищеварения. Во-вторых, речь может идти о состоянии, предшествующем деструкции ткани ПЖ в виде ее отека, что выявляется на ультразвуковом исследовании в виде увеличения размеров одного или нескольких отделов органа и соответствующих изменений ее паренхимы. Данное состояние чаще всего является вторичным, и термин «реактивный» в данном случае вполне уместен, но собственно «панкреатитом» оно не является. Кроме того, это состояние является обратимым при условии лечения основного заболевания и, может быть, некоторой вспомогательной терапии, направленной на улучшение микроциркуляции. Появление признаков цитолиза, т. е. гиперферментемия, говорит уже однозначно об остром панкреатите или обострении хронического, и в этом случае дополнительная терминология уже не требуется. Таким образом, следует определиться, подразумеваем ли мы под термином «реактивный панкреатит» панкреатит (именно панкреатит) вторичный или мы имеем в виду реактивное состояние ПЖ без деструкции (что в практике чаще всего и имеет место), когда более уместным может быть термин «диспанкреатизм». Однако эти вопросы следует решать централизованно на форумах детских гастроэнтерологов и далее говорить «на одном языке». Важность этой проблемы определяется прогнозом развития данного состояния, которое у одних пациентов на фоне адекватного лечения основного заболевания будет обратимым, но у части из них может развиться «истинный» панкреатит. Механизм данного процесса скорее всего связан с длительной ишемией ткани ПЖ на фоне микроциркуляторных нарушений.
Оставив в стороне терминологические споры, следует признать, что панкреатиты, в том числе панкреатиты хронические, в педиатрической практике являются реальностью. Последний (как любой хронический процесс) может иметь рецидивирующее или латентное течение, что является общепатологической закономерностью.
Также педиатр достаточно часто сталкивается с реактивным состоянием ПЖ, которое может эволюционировать как в сторону восстановления состояния органа, так и по пути его деструкции.
Причины развития панкреатита у детей многочисленны и могут быть объединены в несколько групп.
К этой же группе можно отнести развитие панкреатита при гельминтозах (описторхоз, стронгилоидоз, аскаридоз и др.), а также панкреатит при сепсисе.
Последнее заболевание является, безусловно, особым в приведенном списке. Фиброз при муковисцидозе связан в большой степени с особенностями функции фибробластов и имеет врожденный (генетический) характер, хотя фактор нарушения оттока из ПЖ также имеет важное значение. Можно ли расценивать процессы, протекающие в ПЖ при муковисцидозе, как панкреатит — вопрос спорный и требует отдельного обсуждения.
Данная группа в педиатрической практике является весьма многочисленной, особенно когда речь идет о т. н. реактивном панкреатите.
Особого внимания заслуживает панкреатит наследственного происхождения. Описанный в 1952 г. Comfort и Steiberg он в последние годы стал объектом пристального изучения во всем мире. В настоящее время установлено несколько мутаций нескольких генов, ответственных за развитие этого заболевания. При одном из вариантов наследственного панкреатита заболевание передается по аутосомно-доминантному типу с 80% пенетрантностью. В 1996 г. на хромосоме 7 q35 был выявлен ген, ответственный за его развитие, кодирующий катионический трипсиноген. На настоящий момент описано 8 мутаций в данном гене. Мутации D22G, K23R, N29I, N29T, R122H и R122C приводят к повышению аутоактивации трипсиногена, мутации N29T, R122H и R122C стабилизируют трипсин по отношении к его ингибиторам, в то время как мутации D22G, K23R и N29I не связаны с каким-либо известным эффектом. Мутация R122H удаляет точку аутолиза Arg122, мутации D22G и K23R подавляют активацию катепсином В. Во всех случаях этих мутаций нарушается баланс между протеазами и антипротеазами с повышением внутриклеточной протеазной активности и разрушением клеток. Наследственный панкреатит проявляется с первых лет жизни, а в более зрелом возрасте наличие перечисленных мутаций ассоциируется с 50-кратным повышением риска развития рака ПЖ. Кроме изменений в гене трипсиногена, за развитие панкреатитов также могут быть ответственны мутации в гене ингибитора трипсина (Serin Protease Inhibitor Kazal type 1 = SPINK1 или PSTI) на 5 хромосоме, а в гене муковисцидоза на 7 хромосоме. В этих случаях предполагается аутосомно-рецессивный тип наследования.
Вторичное нарушение функции ПЖ наблюдается при многих состояниях, включая синдром нарушенного кишечного всасывания. Так, при целиакии и лактазной недостаточности (ЛН) можно выявить различной степени выраженности вовлечение ПЖ в патологический процесс. По нашим данным, при целиакии в активной стадии заболевания поражение ПЖ наблюдается у 88% больных, в стадии ремиссии — у 79%, а при ЛН — в 76%. Повышение в крови активности трипсина, говорящее о деструктивном процессе в ПЖ, наблюдается у 37% детей в активной стадии целиакии и у 12% больных в стадии ремиссии. При ЛН высокая трипсиногенемия отмечалась только у 7% пациентов. Что касается повышенной экскреции триглицеридов с калом, указывающей на экзокринную недостаточность ПЖ, нами была выявлена обратная картина: низкая частота в активную стадию (18%) и более высокая — в стадии ремиссии (52%). При ЛН умеренная стеаторея за счет триглицеридов наблюдалась у 38% детей. Выявленная закономерность совпала с таковой при оценке частоты выявления признаков хронического панкреатита по данным ультразвукового исследования. Признаки хронического панкреатита не выявлялись в активной стадии целиакии, но встречались у 58% больных с целиакией в стадии ремиссии и у 32% больных детей с ЛН. Можно предположить постепенное формирование хронического панкреатита по мере течения процесса даже на фоне стойкой ремиссии целиакии со снижением экзокринной панкреатической функции.
Механизмы поражения ПЖ при целиакии непосредственно связаны с атрофическим процессом в тонкой кишке. Данная атрофия носит гиперрегенераторный характер, что проявляется значительным углублением крипт и повышенной митотической активностью в них. Вместе с увеличением числа собственно энтероцитов, в криптах увеличивается также число соматостатин-продуцирующих D-клеток в активную стадию целиакии с их нормализацией в стадию ремиссии. Гиперплазия D-клеток сопровождается повышением продукции соматостатина и, как следствие, подавлением активности I-клеток, продуцирующих холецистокинин, и S-клеток, продуцирующих секретин, что приводит к снижению функции ацинарных клеток ПЖ.
Другой механизм повреждения ПЖ при целиакии связан с нарушением ее трофики и, видимо, имеет более долговременные последствия. Тяжелая гипотрофия, независимо от причины, характеризуется нарушением функции всех органов, в т. ч. пищеварительных желез.
Трофические нарушения и снижение стабильности клеточных мембран, безусловно, способствуют развитию цитолиза достаточно чувствительных к различным неблагоприятным факторам ацинарных клеток ПЖ. Деструкция проявляется панкреатической гиперферментемией и является отражением, по существу, неявно (без четких клинических проявлений) острого панкреатита или обострения хронического панкреатита у больного с целиакией. В патогенезе указанных нарушений нельзя также исключить аутоиммунный механизм, так как известно о появлении в крови при целиакии аутоантител к различным органам, в том числе к клеткам ПЖ, хотя аутоагрессия в отношении ацинарных клеток пока остается недоказанной. Ишемия ткани ПЖ, сохраняющаяся длительное время, может быть причиной вялотекущего панкреатита с его хронизацией в дальнейшем. И хотя в стадии ремиссии целиакии происходит восстановление кишечного всасывания и нутритивного статуса, нормализуется число соматостатин-продуцирующих клеток, а уровень ряда трофических факторов даже повышается, ущерб, нанесенный ПЖ в активную стадию, остается не всегда поправимым. Это проявляется высокой частотой хронического панкреатита с экзокринной панкреатической недостаточностью на фоне благополучия по основному заболеванию.
Изменения ПЖ при лактазной недостаточности носят более легкий и транзиторный характер, однако возможность развития хронического панкреатита у этой группы детей также должна учитываться врачами при составлении плана обследования и лечения.
Пищевая аллергия также нередко сопровождается поражением ПЖ. По нашим данным, частота панкреатической гиперферментемии, которая указывает на возможность панкреатита, при пищевой аллергии у детей наблюдается примерно в 40% случаев, а частота экзокринной панкреатической недостаточности различной степени выраженности по результатам косвенных тестов (липидограмма кала) приближается к 60%. При этом частота поражения коррелирует с возрастом больного или, по существу, с длительностью заболевания. Повреждение ПЖ при пищевой аллергии связано с высвобождением значительного количества вазоактивных медиаторов с развитием, с одной стороны, прямого повреждения паренхимы и, с другой стороны, нарушением микроциркуляции в органе, его ишемией, вторичным повреждением и последующим склерозированием. Представленные механизмы демонстрируют возможность развития как острого, так и хронического процессов. Истинный острый панкреатит при пищевой аллергии у детей развивается редко, и описаны лишь единичные случаи. Чаще всего постепенно формируется хронический панкреатит, который может проявляться экзокринной панкреатической недостаточностью. При этом нарушение процессов переваривания способствует аллергии, т. к. различными путями повышает антигенную нагрузку. Таким образом, аллергия и повреждение ПЖ взаимно поддерживают друг друга, что подтверждается высокой частотой аллергии при хроническом панкреатите другого происхождения.
Диагностика панкреатитов, как уже указывалось выше, представляет сложности, когда речь идет о хроническом панкреатите вне обострения. Острый панкреатит и обострение хронического панкреатита характеризуются клинической картиной, в которой, как правило, имеют место боли в животе, рвота, общее тяжелое состояние с явлениями интоксикации. В типичных случаях боли интенсивные, локализуются в параумбиликальной области с иррадиацией в спину или носят опоясывающий характер, однако нередко болевая симптоматика у детей носит стертый характер без отчетливой локализации. Рвота, многократная в типичных случаях, может быть и однократной или даже отсутствовать. Характерным лабораторным маркером данного состояния является гиперферментемия с увеличением активности в крови амилазы, липазы, трипсина, эластазы 1 и ряда других ферментов. Следует отметить невысокое диагностическое значение амилазы. Более информативными являются уровни активности липазы и трипсина в крови. Определение эластазы 1 в крови считается точным маркером деструкции ткани ПЖ, однако ее определение в нашей стране производится лишь в некоторых лабораториях.
При ультразвуковом исследовании ПЖ наблюдается увеличение размера органа и признаки отека. По мере стихания остроты процесса размеры ПЖ уменьшаются и становятся явными признаки, обычно интерпретируемые как склеротические изменения, характерные для хронического панкреатита, в виде уплотнения и неоднородности паренхимы.
Экзокринная секреция ПЖ при панкреатитах у детей страдает относительно мало, однако ее оценка может помочь в диагностическом процессе и имеет большое значение для выработки тактики ведения больного, особенно в стадии ремиссии.
Для оценки экзокринной панкреатической секреции в повседневной практике могут использоваться такие хорошо известные методы, как копрограмма и липидограмма кала, так и относительно новые, включая определения активности эластазы 1 в стуле, ставшее в последние годы современным «золотым стандартом» для оценки функции ПЖ. Панкреатическая эластаза 1 в неизмененном виде достигает дистальных отделов кишечника и определяется иммуноферментным методом с применением моноклональных антител (Elastase 1 stool test). Была показана высокая информативность метода, который в этом отношении сопоставим с панкреозиминовым тестом. В то же время определение эластазы 1 в кале намного дешевле и проще в проведении. Нормой считается значения эластазы 1 в кале выше 200 мкг/мл кала. Более низкие значения указывают на панкреатическую недостаточность. Важно, что на результаты теста не влияют ни характер питания пациента, ни прием препаратов панкреатических ферментов.
С другой стороны, данный метод не позволяет оценить выраженность достаточно часто встречающейся относительной недостаточности ПЖ, показывая при этом нормальные значения эластазы 1 кала. Лишь сопоставляя эти данные с результатами косвенных тестов (копрограммы или липидограммы кала), можно сделать вывод о вторичном характере пищеварительной недостаточности. Исключением является только первичная липазная недостаточность, при которой на фоне выраженной стеатореи за счет триглицеридов будет наблюдаться нормальное значение фекальной эластазы 1.
Наконец, только данные косвенных методов исследования экзокринной функции ПЖ позволяют оценить адекватность заместительной терапии и подобрать дозу препарата.
Лечение обострения хронического рецидивирующего панкреатита начинается с назначения постельного режима и голода. Диета при этом является важным компонентом лечебного комплекса. Назначенный не более чем на одни сутки голод в дальнейшем заменяется постепенным введением продуктов из рациона диеты 5п, характеризующийся механическим, химическим и термическим щажением желудочно-кишечного тракта и исключением стимуляторов панкреатической секреции.
Терапия направлена на ликвидацию нарушений микроциркуляции в ПЖ, обеспечение ее функционального покоя, замещение нарушенных функций и снижение агрессивности повреждающих факторов.
В связи с этими задачами пациентам назначают инфузионную терапию, направленную на ликвидацию микроциркуляторных расстройств и детоксикацию. В состав этой терапии входят также препараты, обладающие антиферментной активностью, такие как Апротинин, а также препараты, влияющие на микроциркуляцию, — Трентал, Курантил, Даларгин.
Функциональный покой ПЖ обеспечивается:
Высокой эффективностью обладают препараты-аналоги соматостатина (октреотид), которые стали в настоящее время ключевыми в лечении острого панкреатита и при обострении хронического. Соматостатин, вырабатывающийся, в основном, в органах пищеварения и центральной нервной системе, является одним из важнейших нейромедиаторов в организме человека и животных, регулирует (подавляет) секреторные процессы, в т. ч. в ПЖ, пролиферацию, сократимость гладкой мускулатуры, моторику органов пищеварения, кишечное всасывание и многие другие процессы.
В состав комплексной терапии на первом этапе интенсивной терапии также могут входить глюкокортикоидные гормоны и антибиотики.
Важной задачей для нормализации состояния ПЖ является обеспечение оттока панкреатического секрета, основным путем решения которого является назначение спазмолитиков и прокинетиков. Среди спазмолитиков особое место занимает мебеверин (Дюспаталин), в связи с его двойным эффектом: выраженным спазмолитическим, с одной стороны, и предотвращением гипотонии сфинктеров, с другой. Среди прокинетиков предпочтительным является тримебутин (Тримедат), обладающий модулирующим действием на моторику органов пищеварения.
Оптимальным путем коррекции экзокринной панкреатической недостаточности у детей с хроническим рецидивирующим панкреатитом является назначение микросферических препаратов (Креон 10 000) в дозе 3–6 капсул в сутки, быстро устраняющее стеаторею. При этом после длительной (в течение 1–2 месяцев) терапии оказывается возможной отмена препарата, что указывает на высокую компенсаторную способность ПЖ ребенка. Что касается лечения больного при обострении хронического рецидивирующего панкреатита, наш опыт показывает целесообразность кратковременного (при отсутствии признаков панкреатической недостаточности) назначения панкреатических ферментов на фоне расширения диеты после периода интенсивной терапии в дозе, адекватной объему и характеру питания, обычно — до 4 капсул Креона 10 000 в сутки.
Безусловно, неотъемлемой задачей терапии панкреатита является устранение причин, вызвавших его развитие. Эта задача становится особо важной при реактивных состояниях ПЖ в связи с потенциальной их обратимостью. Дополнительно могут назначаться препараты, улучшающие микроциркуляцию (Курантил, Трентал и т. п.)
Хирургическое лечение требуется в случае прогрессирования деструкции, развитии панкреонекроза и неэффективности консервативной терапии.
Несмотря на определенный успех проводимого лечения, требуется приложить еще немало усилий для повышения его эффективности. Важной перспективной задачей является снижение активности и стимуляция обратного развития склеротических изменений в паренхиме ПЖ, на сегодняшний день практически не решаемой.
В целом, проблема панкреатитов у детей требует дальнейшего изучения на современном уровне знаний и технических возможностей, включая аспекты терминологии и связанной с ней эпидемиологии, этиологии и патогенеза, а также диагностики и лечения. Имеющиеся в этом направлении достижения лишь подчеркивают многообразие еще нерешенных проблем.
С. В. Бельмер, доктор медицинских наук, профессор Т. В. Гасилина, кандидат медицинских наук РГМУ, Москва
Современные аспекты диагностики и лечения панкреатической недостаточности у детей
П.Л.Щербаков, доктор медицинских наук, профессор НЦЗД РАМН, РГМУ, Москва
Последняя четверть ХХ века ознаменовалась прогрессом в детской гастроэнтерологии, что привело к значительным достижениям в диагностике, лечении и профилактике заболеваний органов пищеварения у детей.
Однако, несмотря на значительные успехи в этой области, хронические заболевания органов пищеварения являются наиболее частой патологией, встречающейся как у взрослых, так и у детей. Распространенность болезней пищеварительного тракта за последние 10 лет возросла с 90 до 160 на 1000. В структуре болезней детского населения преобладают хронические воспалительные заболевания верхних отделов органов пищеварения (эзофагиты, гастриты, дуодениты, язвенная болезнь двенадцатиперстной кишки). Результаты эпидемиологических исследований, проведенных в нашей стране, показали широкую распространенность этих заболеваний во всех регионах России, особенно в районах с высоким уровнем антропогенной загрязненности. В детском возрасте встречаются практически все заболевания, с которыми в дальнейшем сталкиваются гастроэнтерологи. Значимость этой патологии обусловлена не только ее широкой распространенностью, но и социально-экономическими аспектами: длительной потерей трудоспособности взрослых больных, высоким риском малигнизации при воспалительных заболеваниях желудочно-кишечного тракта. Именно поэтому выяснение причин увеличения частоты этих заболеваний, расшифровка патогенеза, совершенствование методов диагностики и разработка принципов рационального лечения являются одними из приоритетных научных задач гастроэнтерологии.
Одно из ведущих мест среди болезней органов пищеварения занимают поражения поджелудочной железы, отличающиеся многообразием и полиэтиологичностью. Но, несмотря на большое разнообразие причинных факторов, клиническая картина различных состояний, связанных с нарушением функционирования этого органа, во многом сходна.
Значительную часть больных с поражением поджелудочной железы составляют пожилые и престарелые лица, однако в последнее время поражения поджелудочной железы все чаще встречаются и у детей различного возраста.
Нарушение деятельности поджелудочной железы, не сопровождающееся, как правило, воспалительной реакцией, однако имеющее определенную клиническую симптоматику, получило название панкреатической недостаточности.
Различают первичную и вторичную панкреатическую недостаточность. Первичная панкреатическая недостаточность развивается вследствие воздействия так называемых немодифицируемых факторов, на которые человек (пациент или врач) воздействовать и влиять не может. К ним относятся такие заболевания, как кистозный фиброз поджелудочной железы, врожденное нарушение проходимости панкреатического протока, синдром Shwachman, изолированный дефицит липазы, изолированная недостаточность трипсина, наследственный рецидивирующий панкреатит.
В педиатрической практике чаще встречается вторичная, или относительная, недостаточность поджелудочной железы (ранее называемая панкреатопатией, диспанкреатизмом), провоцируют ее, как правило, прием необычной пищи, ее избыточное количество, или временные расстройства функционирования поджелудочной железы. Вторичная панкреатическая недостаточность может сопровождать различные воспалительные заболевания ВОПТ.
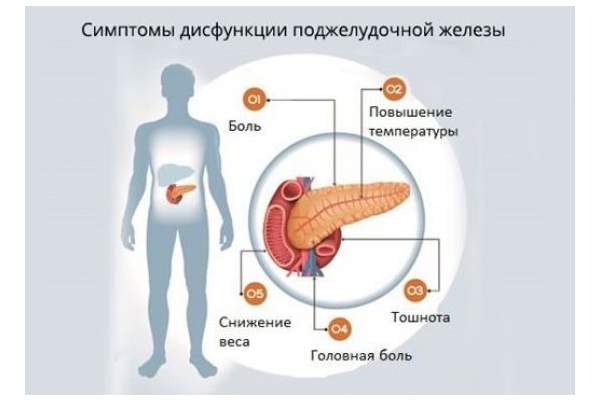
Клиническими проявлениями панкреатической недостаточности являются признаки нарушения деятельности поджелудочной железы – боль в животе, изменение аппетита (уменьшение или полное исчезновение), тошнота, урчание в животе, метеоризм и флатуленция, стеаторея. Интенсивность и выраженность этих признаков зависят от степени поражения поджелудочной железы.
Диагностировать нарушение деятельности поджелудочной железы и панкреатическую неодостаточность в частности невозможно только клиническими методами обследования. В арсенале гастроэнтеролога имеется целый ряд инструментальных методов, позволяющих оценить состояние поджелудочной железы.
В норме после введения стимуляторов секреция поджелудочной железы и активность ферментов увеличиваются в 2-3 раза, а при недостаточности функции поджелудочной железы остаются стабильным.
Ультразвуковое исследование. При УЗИ выявляются диффузное или локальное увеличение размеров железы, изменение эхоплотности паренхимы в виде гиперэхогенности, возможны чередование участков гипер- и гипоэхогенности, неровность контуров. Могут выявляться кистозные образования.
«Золотым стандартом» для инструментальной диагностики заболеваний поджелудочной железы является эндоскопическая ретроградная панкреатохолангиография. Однако эта методика имеет ряд противопоказаний, нередко она провоцирует обострение панкреатита и проводить ее следует только в условиях специализированных клиник.
Верификацию диагноза и достоверную оценку состояния поджелудочной железы можно проводить только по результатам специфических тестов и анализов, определяющих функциональные особенности деятельности поджелудочной железы и ее нарушения. Существует большое количество различных тестов определения состояния поджелудочной железы, наибольший клинический интерес из них представляют следующие.
Провокационные тесты
Данные тесты до сих пор не потеряли своей актуальности и вполне могут быть использованы в клинической практике при оценке состояния поджелудочной железы. Тесты проводятся с применением лекарственных препаратов, стимулирующих деятельность поджелудочной железы, секретина, панкреозимина, прозерина, глюкозы.
Тест с глюкозой (двойная нагрузка с глюкозой) заключается в регистрации уровня амилазы при введении глюкозы, стимулирующей вырабатывание панкреатического сока. Перед исследованием из рациона ребенка в течение 3—5 дней исключается пища, богатая жирами. В день исследования ребенок принимает натощак 10%-ный раствор глюкозы из расчета 1 г/кг массы тела, но не более 50 г на прием. Повторный прием такой же дозы раствора глюкозы назначают через час. Уровень амилазы проверяют натощак и через каждые 30 мин после нагрузки глюкозой в течение 2-3 ч.
При наличии воспалительных изменений в поджелудочной железе после первой или второй нагрузки глюкозой отмечается гиперамилаземия, при этом уровень амилазы постепенно снижается к концу исследования. Снижение уровня амилазы после нагрузок глюкозой свидетельствует об истощении функциональных возможностей поджелудочной железы.
Исследование внешнесекреторной функции поджелудочной железы непрямыми методами
Йодлиполовый тест. Принцип метода состоит в том, что при приеме внутрь йодлипол, состоящий из жирового вещества (липола) и йода, под действием панкреатической липазы превращается в свободный йод, выделяющийся с мочой. По концентрации йода в моче судят об активности панкреатической липазы. При недостаточности панкреатической липазы йод в моче не обнаруживается или регистрируется только в разведении 1:2.
При остром поражении поджелудочной железы уровень амилазы в сыворотке крови достигает максимума ориентировочно через 12 ч.
«Золотым стандартом» оценки состояния поджелудочной железы является Секретин-Панкреозиминовый тест (SPT). При этом определяется уровень бикарбонатов и ферментов после внутривенного введения секретина и панкреозимина, (прямая стимуляция поджелудочной железы). При нормально функционирующем органе уровень определяемых показателей составляет:
Сывороточный эластазный тест (SET) обладает чувствительностью 96% и специфичностью 96%. Особенно чувствителен этот тест для определения острого панкреатита («золотой стандарт») или обострения хронического панкреатита. При проведении исследования нормальный уровень эластазы I в сыворотке крови не превышает 3,5 ng/ml. При нарушении функции органа он выше 35 ng/ml. Этот тест может использоваться для диагностики острого панкреатита (даже через несколько дней после клинической манифестации приступа) после проведенной ретроградной панкреатохолангиографии (РПХГ) (даже при отсутствии клинических признаков панкреатита).
Нормальный уровень эластазы в кале не должен снижаться менее чем на 200 мкг/г. Уровень эластазы от 200 до 100 мгк/г оценивается как умеренная недостаточность поджелудочной железы. Если уровень эластазы I в кале снижается менее 100 мкг/г, значит, у больного выраженная панкреатическая недостаточность. Этот тест может использоваться для скрининга и мониторинга недостаточности поджелудочной железы у детей.
Таким образом, для успешной и своевременной диагностики заболеваний поджелудочной железы необходимо использовать комплекс исследований, включающий в себя наряду с тщательными клиническими наблюдениями за больным ребенком ряд функциональных и инструментальных методов, позволяющих наиболее полно изучить степень поражения поджелудочной железы в целях назначения адекватной комплексной терапии.
При недостаточности поджелудочной железы применяются различные лекарственные средства, содержащие ферменты. Традиционно для этого используется панкреатин – препарат, приготовленный из поджелудочной железы животных [3]. Однако в условиях интенсивного кислотообразования в желудке наступала его частичная инактивация и препарат не оказывал ожидаемого лечебного эффекта. В дальнейшем с развитием фармацевтической промышленности, знаний о механизме процессов пищеварения появились новые формы препаратов, содержащих панкреатин в виде таблеток, драже, гранул с защитной оболочкой и микросфер, помещенных в капсулу. В настоящее время ферментные препараты, используемые в клинической практике, должны отвечать определенным требованиям. Основные требования: нетоксичность; хорошая переносимость; отсутствие существенных побочных реакций; оптимум действия в интервале рН 5-7; устойчивость к действию соляной кислоты, пепсинов и других протеаз; содержание достаточного количества активных пищеварительных ферментов; иметь длительный срок хранения.[2].
В зависимости от состава ферментные препараты можно разделить на несколько групп [4]:
Все эти лекарственные вещества содержат ферменты поджелудочной железы, но они не взаимозаменяемы. Различные группы этих препаратов имеют четкие и строгие показания к применению. При нарушении показаний и правил приема можно не только не достичь желаемого результата, но и вызвать различные побочные реакции.
Первая группа ферментов направлена в основном, на компенсацию нарушений деятельности слизистой оболочки желудка. Содержащиеся в них пепсин, катепсин, пептидазы расщепляют практически все природные белки. Эти препараты используются преимущественно при гипоацидном гастрите. Их не следует назначать при заболеваниях, связанных с повышенным кислотообразованием: язвенной болезни, гастритах ассоциированных H.pylori, так как высвобождающийся под их влиянием гистамин может вступать в антагонизм с препаратами, входящими в стандартные схемы лечения этих болезней.
Большинство препаратов, включенных в группу панкреатических энзимов и регулирующих преимущественно функцию поджелудочной железы, используются как в терапевтических целях при значительных нарушениях процесса пищеварения и образования панкреатического сока, так и для профилактического лечения.
Даже в рамках одной группы препараты отличаются по количественному составу входящих в них компонентов. Различие структуры панкреатических энзимов обосновывает разнообразие их клинического применения [3]. Так, мезим-форте®, содержащий 4200 ЕД амилазы, 3500 ЕД липазы и 250 ЕД протеаз, чаще используется для коррекции дисфункции поджелудочной железы, возникающей при погрешностях в питании, при приеме новых, чаще жирных, жареных, продуктов. Этот препарат следует назначать всем путешественникам, особенно переезжающим на значительное расстояние от своего привычного места обитания. Вторичная панкреатическая недостаточность легко может возникнуть при изменении микроэлементного и солевого составов продуктов питания или воды. И в этом случае легкие, «профилактические» энзимные препараты окажут свое действие. Однако ферменты, содержащие активное начало в небольших количествах, выпускаются в виде таблеток, применение которых ограничено у детей различного возраста. Таблетки покрыты специальной кислотоустойчивой оболочкой, при разрушении которой (во время дробления) препарат быстро инактивируется в желудке. Поэтому делить таблетки для назначения детям разного возраста совершенно бесполезно.
Выход из создавшейся ситуации существует в виде группы высокоактивных ферментных препаратов, таких, как панцитрат, креон, пангрол, концентрация липазы в которых достигает 10 000 – 40 000 ЕД. Все эти препараты представлют собой капсулы, внутри которых содержаться минитаблетки или мини-микросферы. [6,7]. Эти капсулы можно раскрыть, а их содержимое разделить соответственно массе тела каждого конкретного ребенка. Следует иметь в виду, что мини-таблетки некоторых препаратов (панкреаза, панцитрат) покрываются специальной кислотоустойчивой оболочкой, содержащей кополимеры метакриловой кислоты, которые, по некоторым данным, могут стать причиной развития фиброзной колонопатии при длительном приеме препаратов [5, 8].
Креон®, выпускаемый в трех видах, в зависимости от активности по липазе, составляющей 10 000 ЕД, 25 000 ЕД и 40 000 ЕД, сначала был синтезирован специально для лечения муковисцидоза. Следует отметить, что в отличие от других препаратов “терапевтического” ряда креон даже при длительном применении не вызывает образования стриктур толстой кишки и какого-либо нарушения функции нижележащих отделов пищеварения, так как мини-микросферы, имеющие диаметр всего 1,2 мм, покрыты фталатом гидроксипропилметилцеллюлозы, не вызывающим нарушения структуры толстой кишки. Находясь в капсулах в виде мини-микросфер, креон можно легко дозировать для детей разного возраста, предварительно высыпав содержимое капсулы на клетчатую бумагу.
Желатиновые капсулы, содержащие мини-микросферы, значительно меньше традиционных капсул, содержащих мини-таблетки или микросферы, что облечает их проглатывание у детей разного возраста. Однако при невозможности проглотить целиком капсулу препарата ее содержимое можно высыпать непосредственно в ложку в начале еды. Мини-микросферы, покрытые специальной оболочкой, имеют диаметр не более 1,2 мм, активно перемешиваются с химусом, что обеспечивает их быстрое и полное переваривание. Креон с активностью 25 000 ЕД способен практически полностью заменить экзокринную деятельность поджелудочной железы, обеспечив организм человека необходимыми ферментами. Креон с активностью 10 000 ЕД используется для коррекции ферментопатий, развившихся в результате перенесенных заболеваний других органов и систем организма.
Решить вопрос о том, какой фермент лучше давать – “корректирующий” или “лечебный”, только определив уровень эластазы в каловых массах при проведении FET (фекального эластазного теста).
Таким образом, каждая группа ферментных препаратов имеет свои, строго ограниченные показания для использования. Применение препаратов по способствует нормализации процессов пищеварения и улучшению состояния больного. Неправильное использование различных групп ферментов дискредитирует эти препараты, так как они не дают положительного эффекта или даже ухудшают состояние пациента.