диссеминированный опухолевый процесс что это
Диссеминированное заболевание легких — диагностика, компьютерная томография
ДИССЕМИНИРОВАННЫЙ ПРОЦЕСС В ЛЕГКИХ — ЧТО ЭТО ТАКОЕ?
Диагностика диссеминированных процессов в легких – это самая сложная область пульмонологии. Диссеминированным называется заболевание, которое проявляется более-менее однотипным распространением (диссеминацией) патологического процесса на большую часть легочной ткани. Такое распространение процесса по легким, как правило в виде очагов, сетчатых изменений или смешанного типа, диагностируется как с помощью рентгенографии, так и с помощью компьютерной томографии (КТ).
Сложность диагностики диссеминированных заболеваний заключается в том, что похожая рентгенологическая картина может наблюдаться при огромном количестве болезней самого разного происхождения. До 80% пациентов с легочной диссеминацией получают при первичной диагностике неверные диагнозы. Кроме того, многие заболевания легких, сопровождающиеся диссеминацией, протекают бессимптомно, что также оттягивает верную диагностику. У некоторых пациентов между началом заболевания и правильно поставленным диагнозом проходит несколько лет, а кому-то правильный диагноз не выставляется вовсе.
ДИССЕМИНИРУЮЩИЙ ПРОЦЕСС В ЛЕГКИХ — ВАРИАНТЫ ПАТОЛОГИИ
Какие болезни легких способны проявляться диссеминацией на КТ и рентгенографии?
1. Альвеолиты
1. 1. Идиопатический фиброзирующий альвеолит
1. 2. Экзогенный аллергический альвеолит
1. 3. Токсический фиброзирующий альвеолит
2. Гранулематозы
2. 1. Саркоидоз легких
2. 2. Гематогенно — диссеминированный туберкулез легких
2. 3. Гистиоцитоз
2. 4. Пневмокониозы (силикоз, силикатозы, бериллиоз и др. )
2. 5. Пневмомикозы (актиномикоз, кандидоз, криптококкоз легких и др.)
3. Диссеминации опухолевой природы
3. 1. Бронхиолоальвеолярный рак
3. 2. Карциноматоз легких
3. 3. Раковый лимфангиит
4. Редкие формы диссеминированных процессов в легких
4. 1. Идиопатический гемосидероз легких
4. 2. Синдром Гудпасчера
4. 3. Альвеолярный протеиноз
4. 4. Лейомиоматоз легких
4. 5. Первичный амилоидоз легких
5. Интерстициальные фиброзы легких при поражениях других органов и систем
5. 1. Васкулиты или/и интерстициальные пневмониты при диффузных
болезнях соединительной ткани
5. 2. Кардиогенный пневмосклероз при недостаточности кровообращения
5. 3. Интерстициальный фиброз при хроническом активном гепатите
5. 4. Интерстициальный фиброз при лучевых поражениях
5. 5. Интерстициальный фиброз как исход «шокового легкого»
Как видите, список очень длинный, а ведь здесь далеко не все диссеминированные болезни!
О чем нужно задуматься, если у Вас в легких обнаружен диссеминированный процесс? Прежде всего, об исключении самых опасных болезней – туберкулеза и рака легкого! Не является ли диссеминация туберкулезной или опухолевой природы?
МНОЖЕСТВЕННЫЕ МЕТАСТАЗЫ В ЛЕГКИХ — САМЫЙ ОПАСНЫЙ ДИССЕМИНИРОВАННЫЙ ПРОЦЕСС
Прежде всего, врачам при обнаружении диссеминированного заболевания легких необходимо исключить злокачественную опухоль. Это может быть как метастатическая диссеминация рака (гематогенный, лимфогенный карциноматоз), так и первичная диссеминированная опухоль легкого — бронхиолоальвеолярный рак. Множественные метастазы в легкое чаще всего встречаются при раке молочной железы, почек, яичников, кишечника, желудка и матки. При правильном анализе результатов компьютерной томографии (КТ) врач-рентгенолог в большинстве случаев способен отличить метастазы от других вариантов диссеминации.
КАК ОТЛИЧИТЬ ОДНО ДИССЕМИНИРОВАННОЕ ЗАБОЛЕВАНИЕ ОТ ДРУГОГО?
Если по рентгенографии или флюорографии выставлен диагноз «диссеминированной процесс легких», необходимо сделать компьютерную томографию (КТ), чтобы выяснить, какое именно заболевание лежит в основе найденных изменений. Дифференциальная диагностика диссеминированных болезней органов дыхания — одна из самых сложных областей рентгенологии. Чтобы достоверно выявить различия между многочисленными вариантами патологии, врач-рентгенолог (радиолог) должен хорошо разбираться в пульмонологии и иметь глубокие знания по лучевой диагностике легочных болезней. Увы, такие знания есть далеко не у всех врачей. Диагностикой диссеминированных болезей профессионально занимаются врачи-рентгенологи (радиологи) специализированных легочных стационаров, например, Санкт-Петербургского НИИ Фтизиопульмонологии. Они способны из множества «похожих» признаков выделить те существенные, которые указывают на правильный диагноз.
ВТОРОЕ МНЕНИЕ ПРИ ДИССЕМИНИРОВАННОМ ПРОЦЕССЕ
Нередко возникает ситуация, когда даже КТ не вносит полной ясности в диагноз. Например, врачи могут сомневаться, что у пациента: саркоидоз или метастазы в легких, диссеминированный туберкулез или грибковая инфекция, и т.п. В таких случаях полезно получить дополнительное мнение высококвалифицированного рентгенолога, который повторно проанализирует снимки и выскажет свое мнение. Подобное экспертное мнение поможет Вашему лечащему врачу уточнить диагноз и назначить правильное лечение. Если Вы живете вдалеке от крупных центров, снимки можно отправить специализированному радиологу по интернету, например через службу Национальной телерадиологической сети. Полученное в результате второе мнение по КТ легких с подписью и печатью опытного специалиста снизит риск неверного диагноза.
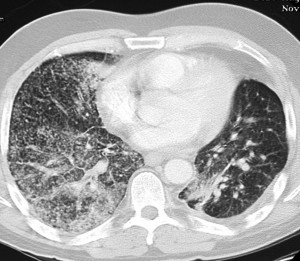
КТ при бронхиолоальвеолярном раке. Множественные хаотичные очаги, чередующиеся с участками уплотнения по типу матового стекла, фокусами альвеолярной консолидации.
КТ легких при саркоидозе. Множественные очаги, расположенные вдоль центрального интерстиция и плевральных листков, с характерной картиной «четок».
Диссеминация в легких
Под диссеминированными процессами в легких понимается довольно обширная группа заболеваний и патологических состояний (более 100, известных современной медицине), при которых в дыхательном органе диагностируют множественные воспалительные очаги и(или) фиброзные изменения, расположенные, как правило хаотично и с обеих сторон. Патологические изменения могут затрагивать практически все легочные сегменты, а могут быть сконцентрированы только в определенных местах, например, вокруг бронхов, в периферических отделах легких и т.д.
Первично диссеминированные заболевания легких выявляются по результатам аппаратных медицинских обследований (КТ, рентген). На посрезовой компьютерной томографии легких (МСКТ) в высоком разрешении очаги диссеминации и фиброза визуализируются лучше всего. Врач-рентгенолог может оценить объем поврежденной легочной ткани, выявить фиброзные тяжи (соединительнотканные спайки и рубцы), скопление жидкости и(или) гноя в альвеолярных пузырьках, сопутствующие патологии дыхательных путей, артерий, лимфатической системы.
В этой статье мы подробнее расскажем о легочной диссеминации и заболеваниях, при которых этот симптом наблюдается.
Что такое диссеминация в легких?
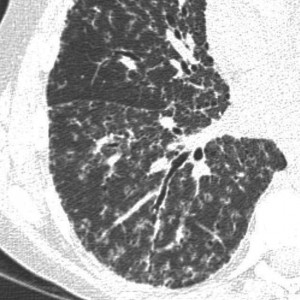
Диссеминация представляет собой множественные патологические очаги (уплотнения) диаметром 1-10 мм. На КТ-сканах они выглядят как светлые пятна, в то время как в норме легочная ткань визуализируется практически однородным темным цветом. Очаги могут быть абсолютно разными по размеру, форме (эллипсообразные, с неровными краями) и морфологии. Нередко вокруг очагов обнаруживается перифокальное воспаление. Они могут сливаться и в таком случае напоминают инфильтративные процессы при пневмонии. Диссеминация также проявляется в виде очаговых микро повреждений с кровью и отеками.
При диссеминирующих процессах в легких дыхательный орган частично (в зависимости от объема поражения) перестает выполнять свою главную функцию — дыхание и транспортировка кислорода к другим органом, в частности к сердцу и головному мозгу. При тотальном диссеминированном поражении легких пациент может погибнуть.
Симптомы легочной диссеминации
Как и большинство легочных заболеваний, диссеминированное поражение легких не обладает специфическими симптомами, по которым было бы точно поставить диагноз. При диссеминации пациентов могут беспокоить стандартные респираторные симптомы:
Причины легочной диссеминации
При обнаружении диссеминации в легких, важно точно установить причину и выявить специфику патологического процесса. Причинами патологических процессов, в зависимости от формы, плотности и характера распространения очагов могут быть:
Отметим, что к одним только возбудителям инфекционно-воспалительных заболеваний легких, которые могут вызвать диссеминированное поражение легких, относится обширная группа вирусов, бактерий и грибков (mycobacterium tuberculosis, SARS-CoV-2, сoccidioides immitis) и др. Иногда выявить точную причину диффузных воспалительных очагов и фиброза не представляется возможным. Если заболевание обладает признаками, сходными с туберкулезом или пневмонией, или имеется выраженный фиброз, но даже после медицинских обследований причина остается не ясна, то такие патологические изменения называют «идиопатическими», а тактика лечения подбирается индивидуально на основании полученных данных и анамнеза пациента.
Поэтому диссеминированные заболевания легких считаются довольно сложными в диагностике. КТ легких значительно информативнее обычной рентгенографии, однако даже этот метод изолированно от лабораторных анализов, не позволяет получить достаточно сведений для назначения терапии. Если у пульмонолога или врача-рентгенолога есть подозрения на злокачественный процесс, пациенту может быть рекомендована биопсия.
Для каких заболеваний характерен симптом легочной диссеминации?
Рассмотрим наиболее распространенные заболевания, которые могут проявляться диссеминированным патологическим процессом в легких.
Туберкулез
Туберкулез легкий представляет собой довольно распространенное, опасное и тяжелое заболевание. Его возбудителем являются бактерии — палочки Коха, которые легко передаются контактным и воздушно-капельным путем, могут годами жить в уличной пыли и даже в легких человека, не вызывая никаких симптомов.
Болезнь проявляется тогда, когда иммунная система человека не может самостоятельно сдержать активную фазу и рост микобактерий mycobacterium tuberculosis. Бактериальное поражение легких при туберкулезе обычно визуализируется как множественные воспалительные очаги — гранулемы.
В центре туберкулезных гранулем расположены очаги некроза. Вокруг них формируются уплотнения — легочные альвеолы заполняются жидким субстратом, в котором содержатся сами бактерии клетки эпителия и плазмы, мертвые лимфоциты, крупные клетки Лангханса, макрофаги.
На начальных стадиях туберкулез прогрессирует практически бессимптомно, со временем пациент начинает отмечать слабость, ухудшение общего самочувствия, кашель и изменение дыхания.
При этом на аускультации редко отмечается что-то подозрительное. Анализ мокроты не показывает микобактерии. Диагностика туберкулеза возможна по результатам рентгенографического обследования и кожной туберкулиновой пробы.
Гранулематозы и диффузно расположенные «матовые стекла» на КТ не являются специфическим признаком туберкулеза. Первые обнаруживаются и при саркоидозе, а вторые — при пневмониях и других заболеваниях.
Для лечения туберкулеза пациенту назначается курс антибактериальной терапии. Важно предотвратить фиброз (рубцевание легких), поскольку такие изменения могут носить необратимый характер.
Пневмокониоз
Пневмокониозы – это диссеминированное поражение легких, причиной которого является вдыхание строительной или промышленной пыли. Чаще всего патологические процессы протекают с выраженным развитием первичного диффузного фиброза, при котором легочные альвеолы «склеиваются», поскольку в них разрастается соединительная ткань.
Пневмокониоз тоже носит гранулематозный характер. На КТ-сканах отчетливо видны множественные узелковые уплотнения разной плотности. Такие уплотнения следует проверять на предмет того, является ли процесс доброкачественным, нет ли онкологической угрозы.
Пневмокониоз относится к так называемым «профессиональным» заболеванием. Чаще всего от него страдают:
Силикоз — распространенное и тяжелое заболевание легких, при котором диагностируют множественный диффузный фиброз и узелковые уплотнения. В результате у больного существенно сокращается функциональный объем легких. Возникает из-за продолжительного вдыхания пыли со свободным диоксидом кремния (содержится в кварцевом песке и окружающем воздухе). Поэтому в группе риска находятся пескоструйщики, работники соответствующих (абразивоструйных) предприятий, жители «песчаных» регионов.
Асбестоз — хроническое заболевание легких, при котором также манифестируется множественный легочный фиброз. Возникает из-за вдыхания асбестовой пыли или волокон асбеста. В группе риска находятся работники асбестодобывающих и асбестоперерабатывающих предприятий.
Пневмонии и осложнения пневмоний
Пневмонии – группа воспалительных заболеваний легких. На фоне этого заболевания у пациента могут возникнуть более опасные осложнения, для которых также характерна диссеминация: острый респираторный синдром (ОРДС), интерстициальное поражение легких, симптом «булыжной мостовой», «сотовое легкое», отек легких, фиброз и др.
При пневмонии со множественными диффузно расположенными локусами поражения существенно снижается жизненная емкость легких, поскольку воспалительные очаги и инфильтраты крупные, альвеолы заполнены жидким экссудатом, а не воздухом.
Пневмония с диссеминацией может быть следствием кандидоза легких, пневмокониоза и других заболеваний. Необходимо точно установить причину патологических изменений. Иногда необходимо также исключить злокачественный процесс (по результатам лабораторной диагностики).
Саркоидоз
Саркоидоз легких – это онкологическое заболевание. Его основными признаками на КТ являются диссеминация и медиастинальная лимфаденопатия. Диссеминация на сканах выражена не так ярко как при прогрессирующем туберкулезе, однако определенное сходство есть. Диагностику затрудняет легочный фиброз. Вместе с дессиминированнным поражением дыхательного органа присутствуют васкулиты, периваскулиты, перибронхит.
Множественные очаги (от 2 мм до 1 см) часто расположены вдоль бронхососудистых пучков, междольковых щелей, костальной плевры, в междольковых перегородках (перилимфатический тип диссеминации). При саркоидозе гранулематоз часто (около 35% случаев) обнаруживают не только в легких, но и в бронхах. При этом их слизистая оболочка может быть не изменена – на поражение бронхов при саркоидозе указывают отек, гиперемия, участки утолщения эпителия.
На ранних сроках саркоидоз развивается бессимптомно, на более поздних пациента начинают беспокоить непродуктивный кашель, проблемы с дыханием (без явных причин), дискомфорт и жжение в области спины, в тяжесть в груди.
Текст подготовил
Котов Максим Анатольевич, главный врач центра КТ «Ами», кандидат медицинских наук, доцент. Стаж 19 лет
Если вы оставили ее с 8:00 до 22:00, мы перезвоним вам для уточнения деталей в течение 15 минут.
Если вы оставили заявку после 22:00, мы перезвоним вам после 8:00.
ПЕРСПЕКТИВЫ ЛЕЧЕНИЯ МЕСТНОРАСПРОСТРАНЕННЫХ И ДИССЕМИНИРОВАННЫХ ОПУХОЛЕЙ
По вопросам, близким к освещаемой теме, в БМЭ опубликованы статьи Лучевая терапия, Опухоли, Противоопухолевые средства, Химиотерапия опухолей и др.
Лечение больных с местнораспространенными и диссеминированными опухолями представляет очень трудную задачу, поскольку радикальное удаление опухоли в этих случаях бывает невозможным. Попытки решить проблему лечения больных с местнораспространенными опухолями с помощью сверхрадикальных операций, вплоть до полной эвисцерации органов малого таза при раке прямой кишки, комбинированных гастрэктомий при раке желудка, не дали благоприятных результатов. Большинство онкологов выступают за умеренный радикализм, выполнение экономных и органосохраняющих оперативных вмешательств и применение комбинированного лечения. В последние годы появилось большое число исследований, посвященных разработке методик комбинированного лечения, основанных на использовании различных вариантов предоперационного облучения, локальной гипертермии и противоопухолевых средств с целью улучшения результатов оперативных вмешательств.
Задачи предоперационного лучевого воздействия при операбельных и неоперабельных опухолях принципиально различны. Если в первом случае лучевая терапия направлена на частичную девитализацию клеток опухоли, к-рые во время оперативного вмешательства могут рассеиваться по раневой поверхности и кровеносным сосудам, то при неоперабельных опухолях лучевая терапия — единственно возможный способ лечения больных, позволяющий в ряде случаев добиться выраженной регрессии опухоли и произвести оперативное вмешательство.
Предоперационное облучение снижает степень злокачественности опухоли за счет инактивации ее низкодифференцированных элементов, воздействует на микро-диссеминаты или очаги опухоли при ее мультицентриче-ском росте, а также создает возможность ликвидации субклинических метастазов рака в анатомических зонах, не подлежащих оперативному вмешательству. Лучевая терапия в послеоперационном периоде целесообразна лишь при отсутствии уверенности в том, что операция была радикальной. В этих случаях лучевую терапию осуществляют не ранее чем через 10—12 дней после операции.
При комбинированном лечении опухолей предоперационное облучение в значительной мере определяет конечные результаты лечения, т. к. от разовой и суммарной доз, их пространственного распределения зависит лучевая нагрузка на ткани, участвующие в процессах заживления послеоперационной раны. Большое значение имеет и реакция органов, включенных в поле облучения. Весьма актуален вопрос о продолжительности облучения, поскольку имеется прямая зависимость между длительностью воздействия и биологическим эффектом. Максимальный противоопухолевый эффект и минимальное повреж-
дение нормальных тканей обеспечиваются при построении плана лечения с выбором оптимальных разовой и суммарной очаговых доз, техники и режима облучения.
В связи с необходимостью максимального сокращения продолжительности облучения, а также интервала между облучением и оперативным вмешательством были разработаны методики комбинированного лечения, основанные на принципе крупного фракционирования разовой дозы излучения. Облучение крупными фракциями максимально сокращает сроки лучевого лечения и интервал между облучением и операцией, что позволяет произвести оперативное вмешательство до наступления лучевых реакций со стороны окружающих здоровых тканей и способствует заживлению тканей первичным натяжением.
Крупнофракционное предоперационное облучение показано больным, у к-рых операбельность опухоли не вызывает сомнений и отсутствуют общие противопоказания к оперативному вмешательству. Облучение целесообразно проводить ежедневно. Оптимальные разовые и суммарные очаговые дозы: при раке гортани и легкого разовая доза 500 рад (5 Гр), суммарная — 2000 рад (20 Гр), при раке молочной железы соответственно 600 рад (6 Гр) и 2400 рад (24 Гр), пищевода и желудка — 400 рад (4 Гр) и 2000 рад (20 Гр), мочевого пузыря — 600 рад (6 Гр) и 1800 рад (18 Гр), прямой кишки — 650 рад (6,5 Гр) и 1950 рад (19,5 Гр).
Оперативное вмешательство осуществляют в первые 3 дня после завершения крупнофракционного облучения. Характер оперативного вмешательства определяется стадией заболевания, локализацией первичного опухолевого очага, общим состоянием больного и не зависит от предоперационного облучения. Правильно проведенное предоперационное облучение не создает никаких дополнительных трудностей в процессе оперативного вмешательства и не способствует увеличению частоты послеоперационных осложнений.
Крупнофракционное предоперационное облучение позволяет улучшить результаты оперативного вмешательства. В частности, при раке желудка (T3N0M0) это воздействие позволяет достичь 5-летней выживаемости в 41,2% случаев, тогда как при проведении только оперативного вмешательства без предоперационного облучения этот показатель составляет 18—25%.
Разработана методика сочетанного предоперационного облучения с использованием шлангового аппарата АГАТ-В-5 и нейтронтерапевтического аппарата А НЕТ при раке прямой кишки с локализацией опухоли в нижнеампулярном отделе и анальном канале, при эндофитном и диффузно-инфильтративном росте опухоли, низкодифференцированных аденокарциномах, перстневидноклеточном и коллоидном раке в стадии T2_3N0M0. В связи с относительно низкой радиочувствительностью этих опухолей требуются более высокие поглощенные дозы. Внутриполостное облучение позволяет повысить очаговую дозу за счет оптимального распределения доз, максималь
но щадящего окружающие здоровые ткани. Для внутри-долостного облучения опухолей прямой кишки с помощью аппарата АГАТ-В-5 разработан комплект эндостатов, отличающихся линейными размерами и объемом торцевой части, что позволяет подбирать эндостат индивидуально в соответствии с размерами опухоли.
Накоплен значительный опыт применения у больных с местнораспространенными опухолями расщепленного курса лучевой терапии. Метод является щадящим, удовлетворительно переносится больными, обеспечивает на первом этапе лечения подведение к опухоли терапевтически полноценной дозы излучения, а также при достижении выраженного эффекта позволяет провести радикальную операцию. При недостаточной регрессии опухоли лучевая терапия может быть продолжена. Степень регрессии опухоли является основным критерием при оценке эффективности методик предоперационного лучевого воздействия на местнораспространенные опухоли. При наличии у больного несмещаемой или ограниченно смещаемой опухоли, прорастающей в окружающую клетчатку и смежные органы, отсутствии явных признаков отдаленного метастазирования и абсолютных противопоказаний к радикальному оперативному вмешательству показано комбинированное лечение с пролонгированным предоперационным облучением и отсроченным оперативным вмешательством.
Схема лечения включает три последовательных этапа: предоперационную лучевую терапию, затем для максимальной реализации эффекта облучения следует перерыв продолжительностью 3—4 нед., на завершающем этапе лечения при выраженном эффекте облучения производят оперативное вмешательство. Лучевому воздействию подвергаются первичная опухоль, окружающая клетчатка, смежные органы, на к-рые распространяется опухоль, зоны регионарного метастазирования. Для больных раком прямой кишки разовая доза составляет 400 рад (4 Гр), суммарная очаговая доза — 4000 рад (40 Гр). При выраженном терапевтическом эффекте через 4 нед. после окончания облучения выполняют экстирпацию прямой кишки. При лечении больных с местнораспространенным раком гортани оптимальным является облучение опухоли в разовой дозе 200 рад (2 Гр) ежедневно 5 раз в неделю до суммарной очаговой дозы 3500—4000 рад (35—40 Гр). Операцию выполняют через 3—4 нед. после окончания облучения, ее объем зависит от распространенности процесса.
Пролонгированное облучение и отсроченное оперативное вмешательство показаны больным раком кардиального отдела желудка, распространяющимся на пищевод и сопровождающимся тяжелой дисфагией, кахексией, метаболическими нарушениями. Облучение проводят через день в разовой дозе 300 рад (3 Гр) до суммарной очаговой дозы 3000—3500 рад (30—35 Гр). Выраженный терапевтический эффект, заключающийся в уменьшении опухоли, исчезновении симптомов непроходимости, нормализации метаболических нарушений, создает благоприятные условия для типичной, расширенной или комбинированной гастрэктомии.
Перечисленные выше методики наиболее просты и доступны. Однако значительная часть больных с радио-резистентными опухолями нуждается в применении специальных методик предоперационной лучевой терапии для достижения достаточного эффекта, позволяющего выполнить радикальную операцию. В последние годы разрабатываются методики комбинированного лечения опухолей, основанные на различных способах управления радиочувствительностью с помощью физических и химических агентов. В качестве мишени, обеспечивающей такого рода направленные селективные воздействия, избраны наиболее радиорезистентные гипоксические клетки злокачественных новообразований.
Не менее актуальной остается проблема лечения онкологических больных с диссеминированными опухолевыми процессами III — IV стадии. В этих случаях необходимо общее воздействие, и поэтому основное значение придается противоопухолевым лекарственным средствам, т. е. химиотерапии. Расширению возможностей химиотерапии опухолей способствуют создание новых, более эффективных противоопухолевых средств, разработка оптимальных их комбинаций и, наконец, рациональное
Ряд онкологов используют метод противолучевой защиты организма, заключающийся в создании экзогенной гипоксии обедненной кислородом газовой смесью. Вдыхание такой смеси во время сеанса облучения снижает лучевые повреждения здоровых тканей, что позволяет повысить эффективную дозу облучения опухоли. Это имеет большое значение при необходимости выполнения в последующем сложных оперативных вмешательств.
Для усиления лучевого воздействия на гипоксические зоны опухоли применяют электронакцепторные соединения, к к-рым относится метронидазол. Метронидазол способствует усилению лучевого повреждения опухолевых клеток и повышает показатель выживаемости после радикальных операций у больных раком гортани, прямой кишки и остеогенной саркомой. Максимальная его концентрация в крови (130 мкг/мл и выше) достигается через 4 часа после приема внутрь и поддерживается в течение 6 час., что является оптимальным для облучения опухоли. При крупнофракционном предоперационном облучении опухоли метронидазол целесообразно назначать перед 1, 3 и 5-м сеансами. В связи с токсичностью продуктов метаболизма метронидазола, максимальный уровень к-рых в крови достигается к 8—9-му часу после приема препарата, сразу после окончания сеанса лучевой терапии больному дают обильное питье, вводят внутривенно 1000 мл изотонического солевого р-ра, 500 мл гемодеза, фуросемид. Благодаря мерам, направленным на ускорение выведения из организма продуктов метаболизма метронидазола, значительно уменьшается частота возникновения и выраженность побочных нейротоксиче-ских реакций.
В клинической онкологии находит применение высокоэффективный метод управления радиочувствительностью — локальная гипертермия, или избирательный перегрев опухолевой ткани, создаваемый с помощью СВЧ-и УВЧ-аппаратуры. Наиболее чувствительны к гипертермии гипоксические клетки опухолей. Уже накоплен большой опыт лечения больных с меланомой кожи, опухолями полости рта, гортани, пищевода, молочной железы, кожи и прямой кишки с включением в схему предоперационного облучения предварительного нагревания опухоли до 42—44°. При этом существенно улучшаются непосредственные и отдаленные результаты лечения. Напр., у больных с местнораспространенным раком прямой кишки лучевая терапия в разовой дозе 400 рад (4 Гр) до суммарной очаговой дозы 4000 рад (40 Гр) после предварительного нагревания опухоли позволила улучшить результаты лечения. Полная и частичная регрессии опухоли наблюдались у 71,2%, при облучении без гипертермии полной регрессии не было, частичная отмечена у 33,3%. Показатели эффективности этого метода значительно превышают известные в клинической практике результаты лучевого лечения местнораспространенного рака прямой кишки.
Предоперационное облучение в комбинации с оперативным вмешательством позволило получить реальное увеличение 5-летней выживаехмости больных с местнораспространенными опухолями, а также добиться излечения определенной части больных, подвергавшихся ранее только паллиативным методам лечения. В настоящее время онкологические диспансеры оснащаются отечественными лучевыми и гипертермическими установками, что позволяет широко внедрять эти методы в практику лечения больных с местнораспространенными опухолями различных локализаций.
сочетание химиотерапевтических, хирургических и лучевых методов, а в ряде случаев использование модификаторов биологических реакций, т. е. методов иммунотерапии.
Введение в практику каждого нового противоопухолевого препарата, как правило, знаменует собой определенный этап, расширяющий возможности лечения онкологических больных. Так, внедрение в клиническую практику в конце 70-х — начале 80-х гг. производных платины позволило улучшить результаты лечения больных раком яичников, злокачественными опухолями яичка, раком мочевого пузыря, предстательной железы, полового члена, плоскоклеточным раком головы и шеи, остеогенной саркомой. Наибольшее практическое применение получила цис-диаминодихлорплатина (цисплатин, пла-тидиам). Этот высокоактивный препарат, несмотря на его побочные эффекты (тошнота, рвота, возможно нефроток-сическое и нейротоксическое действие), в настоящее время прочно вошел в число тех 15—20 препаратов, к-рые составляют обязательный минимальный набор противоопухолевых лекарственных средств для проведения химиотерапии на современном уровне.
Оправдано использование цисплатина в составе лекарственной комбинации (циклофосфан + адриамицин + цисплатин). При раке яичников III—IV стадии эта комбинация позволила получить выраженный клинический эффект у 71% больных (из них полная регрессия опухоли произошла у 30% больных, 4-летняя выживаемость к-рых составила 71,5%).
Успешное лечение семиномы яичка в свое время было одним из первых ярких успехов химиотерапии, однако результаты лечения несеминомных герминогенных опухолей яичка оставались неудовлетворительными. Комбинированная химиотерапия, в частности лекарственные комбинации, включающие производные платины, изменила перспективы лечения этих больных. Современная комбинированная химиотерапия в сочетании с оперативным вмешательством (удаление первичной опухоли, заб-рюшинных лимф, узлов, а в ряде случаев и уменьшившихся после химиотерапии легочных метастазов) позволяет излечить 70—80% больных со злокачественными опухолями яичка. По данным нек-рых исследователей, в частности Эйнхорна (L. H. Einhorn, 1981), Гобби (P. G. Gobbi, 1985), этот процент еще выше. Шансы на излечение больных с герминогенными опухолями яичка имеются даже в поздних стадиях заболевания.
По опыту Всесоюзного онкологического научного центра АМН СССР, использование сочетаний противоопухолевых средств, включающих производные платины (наиболее популярной из них является PVB — цисплатин + винбластин + блеомицин), позволило получить положительный эффект у 80% больных с несеминомными герминогенными опухолями яичка III—IV стадии (из них полная регрессия опухоли наступила у 30% больных, 4-летняя выживаемость к-рых составила 68%).
Современная интенсивная химиотерапия рака молочной железы чаще всего основана на использовании сочетаний противоопухолевых средств, включающих антрациклины. Показания к гормонотерапии определяются наличием в опухоли рецепторов стероидных гормонов. При диссеминированном раке молочной железы контролировать процесс удается у 60% больных, однако и у них через определенный промежуток времени, не превышающий обычно 2 года, возникает лекарственная устойчивость опухоли и ее рост возобновляется. Включение цисплатина в химиотерапию позволяет получить эффект у 47,5% больных в прогностически наиболее неблагоприятной группе больных с диссеминированным раком молочной железы; в ряде случаев удается преодолеть лекарственную резистентность к комбинациям, содержащим адриамицин.
Привлекли к себе внимание и другие производные платины, в т. ч. производные платины второго поколения, такие как американский препарат карбоплатин. Последний практически не обладает нефротоксичностью и не вызывает такой выраженной тошноты и рвоты, как цисплатин. Кроме того, в последнее время получены данные об эффективности этого препарата при мелкоклеточном раке легкого и раке яичников, что делает его особенно перспективным.
Заслуживают внимания также другие производные платины второго поколения, проходящие в настоящее время клиническое и предклиническое изучение за рубежом: спироплатин, к-рый лучше переносится больными, чем цисплатин; ипроплатин, эффективный при раке яичников у больных, получавших прежде алкилирующие препараты. В СССР активно исследуются оксоплатина и циклоплатам.
Антрациклины используются в клинической практике при раке молочной железы, опухолях костей, саркомах мягких тканей, гемобластозах, мелкоклеточном раке легкого и др. Наибольшее практическое значение среди этих препаратов до настоящего времени имеет адриамицин, к-рый входит в большинство используемых схем комбинированной химиотерапии. Поиски среди антра-циклинов препаратов, не обладающих кардиотоксичностью, привели к созданию карминомицина (оказавшегося, однако, более узким по спектру противоопухолевого действия, чем адриамицин), активно изучаемого в настоящее время в ряде стран, в том числе и в СССР, 4-эпидо-ксорубицина (фарморубицина) и аклациномицина. Близки к антрациклинам антрацендионы, в частности мито-зантрон, эффективный при раке молочной железы. Антрациклины — адриамицин и фарморубицин — активны у 40—45% больных раком молочной железы, включение этих препаратов в состав лекарственных комбинаций позволяет получить эффект у 60% больных с диссеминированным опухолевым процессом.
К активным противоопухолевым препаратам более узкого спектра действия относятся блеомицин, советский блеомицетин и новый японский антибиотик (также относящийся к группе флеомицинов) пепломицин. Эти препараты используются в основном при комбинированной химиотерапии опухолей яичника, лимфогранулематоза и других лимфом. Следует отметить, что советский блеомицетин обладает меньшей по сравнению с блеомицином легочной токсичностью. В последние годы вошли в практику советский спиробромин, близкий к проспидину и обладающий противоопухолевой активностью при острых лейкозах, неходжкинских лимфомах, раке гортани, а также производное этиленимина — фотрин.
Новые препараты растительного происхождения, в первую очередь эпиподофиллотоксины и, в частности, этопозид (вепезид, VP-16), применяют при мелкоклеточном раке легкого, опухолях яичка, гемобластозах.
Активный поиск новых препаратов в группе алкалоидов барвинка розового привел к использованию, кроме розевина (винбластина), винкристина и виндезина. Последний привлекает к себе особое внимание в связи с сообщениями о его противоопухолевой активности при раке легкого.
Наряду с новыми препаратами в современной комбинированной химиотерапии используются и прежние, хорошо зарекомендовавшие себя препараты из группы алки-лирующих агентов (циклофосфан, сарколизин и др.), производные нитрозомочевины, антиметаболиты (метотрексат, меркаптопурин, фторурацил, фторафур, тиогуанин, цитозар). В последние годы возрастает интерес к применению высоких доз цитозара, высоких и сверхвысоких доз метотрексата под защитой лейковорина. Не утратили значения нек-рые препараты с узким спектром действия, такие как диметилтриазеноимидазолкарбоксамид (ДТИК, детисен), активный при меланоме, саркомах мягких тканей и лимфомах; натулан, применяемый при гемобластозах и в комбинированной химиотерапии мелкоклеточного рака легкого; оливомицин и особенно дактиномицин, входящий во многие лекарственные комбинации, используемые при опухолях у детей.
Антиэстрогены быстро вытесняют эстрогены и андрогены из комплекса лечебных средств, эффективных при раке молочной железы. Удобство применения и хорошая переносимость тамоксифена по сравнению с эстрогенами при одинаковом терапевтическом эффекте позволяют практически отказаться от использования эстрогенов у больных раком молочной железы, находящихся в менопаузе, и существенно ограничить показания к применению андрогенов.
Изучаются возможности использования антиандроге-нов при раке предстательной железы. Новым перспективным направлением в лечении рака предстательной железы в последних стадиях является использование аналогов рилизинг-гормона гипофиза. Эти препараты вызывают снижение уровня тестостерона в сыворотке крови, имитируя эффект кастрации и эффект, возникающий при применении эстрогенов или орхиэктомии.
Использование аминоглютетимида, блокирующего превращение холестерона в прегненолон и предупреждающего тем самым синтез стероидных гормонов корой надпочечников, позволило практически отказаться от адрена-лэктомии в комплексном лечении рака молочной железы.
Гестагены, традиционно используемые при раке эндометрия, стали применять и при раке молочной железы, однако вместо масляной взвеси оксипрогестерон-капро-ната все шире используется водорастворимый медрокси-прогестерон-ацетат, обладающий тем преимуществом, что его можно назначать и перорально.
Целью современной химиотерапии ряда диссеминированных опухолей является не только достижение клинической ремиссии, но и увеличение продолжительности жизни. Успехи химиотерапии сделали реальным излечение больных при нек-рых опухолевых заболеваниях. В число излечимых солидных опухолей, кроме семиномы яичка и хорионэпителиомы матки, теперь вошли и опухоли яичка смешанного строения (несеминомы), опухоль Вильмса; среди гемобластозов, кроме лимфомы Беркитта, острые лимфолейкозы у детей и лимфогранулематоз.
Доказана также возможность излечения при раке яичников и мелкоклеточном раке легкого, но пока лишь у небольшого процента больных. При этих опухолях оправдана интенсивная, или, как ее иногда называют, агрессивная, химиотерапия, т. к. установлено, что, только достигнув полной клинической ремиссии, можно продлить жизнь больному, а в нек-рых случаях добиться излечения.
Так, опыт лечения 176 больных с мелкоклеточным раком легкого в отделении химиотерапии Всесоюзного онкологического научного центра АМН СССР показал, что лучшим среди изученных до настоящего времени терапевтических режимов является комбинированная химиотерапия по схеме ЦАМ (циклофосфан + адриабластин + метотрексат) в сочетании с облучением регионарной зоны в суммарной очаговой дозе 3000—4000 рад (30—40 Гр). Доказано, что лечение по схеме ЦАМ в сочетании с лучевой терапией эффективно у 94% больных, причем в 67% случаев достигается полная регрессия опухоли, в то время как при использовании только химиотерапии по схеме ЦАМ общая эффективность составляет 87%, а число полных регрессий — 27%.
Известно, что у больных с мелкоклеточным раком легкого, проживших после достижения полного клинического эффекта более 2V2 лет без признаков заболевания, как правило, в дальнейшем не наступает рецидива заболевания. Из 104 больных с локализованной формой мелкоклеточного рака легкого, лечившихся во Всесоюзном онкологическом научном центре АМН СССР, 15 жили более 2 лет, причем 5 из них живут св. 5 лет без признаков заболевания, т. е. могут считаться излеченными.
Продлению безрецидивного периода у больных с мелко-клеточным раком легкого с полной регрессией опухоли после химиотерапии и лучевой терапии способствует использование иммунорегулятора Т-активина (смесь полипептидов с молекулярной массой 1000—6000, экстрагированная из ткани вилочковой железы телят), полученного в лаборатории молекулярной иммунологии 2-го ММИ.
Успехи химиотерапии мелкоклеточного рака легкого позволили поставить вопрос о так наз. неоадъювантном лечении; изучается целесообразность дополнительного оперативного вмешательства у больных с мелкоклеточным раком легкого, у к-рых химиотерапия обеспечила значительное уменьшение опухоли. Это яркий пример изменения представлений о месте химиотерапии и хирургии в системе комплексного лечения онкологических больных. При опухолях, высокочувствительных к химиотерапии, операция может дополнять успешное лекарственное лечение. Напр., при метастазах злокачественных опухолей яичка удаление оставшихся после успешной химиотерапии метастазов в легких или забрюшинных лимф, узлах ведет к излечению дополнительно еще 15% больных, у к-рых отмечалась лишь частичная регрессия метастатических опухолей.
В настоящее время привлекает к себе большое внимание вопрос о паллиативных операциях при опухолях, чувствительных к химиотерапии. Циторедуктивные операции, направленные на уменьшение массы опухоли, являются обязательным этапом в комплексном лечении рака яичников III—IV стадии, опухоли Вильмса, эмбриональной рабдомиосаркомы. Анализ результатов комбинированной химиотерапии рака яичников III—IV стадии показал, что только у тех больных, у к-рых остаточная опухоль после оперативного вмешательства не превышала в диаметре 2 см, реально достижение полной клинической ремиссии в результате химиотерапии с перспективой излечения.
В последние годы химиотерапия стала неотъемлемым компонентом комплексного лечения рака молочной железы, остеогенной саркомы, саркомы Юинга, ретинобла-стомы, нейробластомы. Если в 70-е гг. привычным было представление, что адъювантная послеоперационная химиотерапия улучшает результаты оперативного лечения рака молочной железы у молодых женщин с метастазами в 3 и более подмышечных лимф, узлах, то в последние годы доказана целесообразность профилактической послеоперационной химиотерапии и у больных раком молочной железы при более ранних стадиях заболевания.
Успехи химиотерапии, однако, не должны препятствовать объективной оценке ее возможностей и трезвому взгляду на трудности и несовершенство этого метода лечения. До настоящего времени не улучшились возможности химиотерапии при таких часто встречающихся опухолях, как рак желудочно-кишечного тракта, немелкоклеточный рак легкого, рак шейки матки. Не решена проблема первичной и особенно приобретенной устойчивости опухолей к химиотерапевтическим препаратам. Нередко после первоначальной регрессии опухоль перестает реагировать на химиотерапию и вновь быстро прогрессирует, несмотря на смену препаратов и терапевтических режимов. Нет ясности в вопросе о том, сколько времени следует проводить химиотерапию после достижения полной регрессии опухоли, т. е. всегда ли нужна поддерживающая химиотерапия и какова ее оптимальная продолжительность. Напр., при опухолях яичка в последнее время появилась тенденция к отказу от длительного поддерживающего лечения, ограничению лекарственного лечения четырьмя интенсивными курсами комбинированной химиотерапии.
Оценивая современные возможности и ближайшие перспективы лечения онкологических больных, совещание экспертов ВОЗ (Женева, декабрь 1985 г.) пришло к выводу, что использование усовершенствованных методов лечения, в т. ч. методов химиотерапии и иммунотерапии, может повысить к 2000 году 5-летнюю выживаемость больных с наиболее часто встречающимися злокачественными опухолями на 10—30%. При этом особое значение приобретает создание новых противоопухолевых препаратов, в т. ч. их поиск среди веществ природного происхождения с попыткой модификации молекул, получение комплексов цитостатиков с моноклональными антителами, разработка новых режимов комплексного лечения с использованием модификаторов биологических реакций.
Библиогр.: Баженова А. П., Островцев Л. Д. и Хаханашвили Г. Н. Рак молочной железы, М., 1985; Блохин H. Н. и ПереводчиковаН. И. Химиотерапия опухолевых заболеваний, М., 1984; БулбукГ. А. Иммунотерапия опухолевых заболеваний, Кишинев, 1983; Втюрин Б. М., Д ыбырнэ Г. А. и Клим К. Н. Хирургическое лечение рака головы и шеи, Кишинев, 1981; Зацепин С. Т. Сохранные операции при опухолях костей, М., 1984; ЗедгенидзеГ. А., Куликов В. А. иМардынский Ю. С. Лучевая диагностика и лучевая терапия рака мочевого пузыря, М., 1984; Мельников Р. А. и др. Комбинированное лечение рака желудочно-кишечного тракта, Кишинев, 1983; Павлов А. С. и С т и о п Л. Д. Злокачественные опухоли носоглотки и их лучевое лечение, М., 1985; Cancer chemotherapy, ed. by F. M. Muggia, v. 7, Hague а. о., 1983; Cancer treatment and research, ed. by W. L. McGuire, Boston a. o., 1984; Carter S. K., Glatsein
E.a. Livingston R. B. Principles of cancer treatment, N. Y. a. o., 1982; E inhorn L. H. Testicular cancer as a model for a curable neoplasm, Cancer Res., v. 41, p. 3275, 1981; Kos-zarowski Т., Kulakowski A. a. LewinskiT. Cancer surgery, Baltimore — Munich, 1982; Sauer H. u. Wil-m a n n s W. Internistische Therapie malingner Erkrankungen, Munchen u. a., 1985; Treatment of cancer, ed. by К. E. Hainan, L., 1982.
Академик H. Н. Блохин, акад. АМН СССР H. Н. Трапезников, проф. Н. И. Переводчикова, д. м. н. А. Ф. Цыб, д. м. н. Б. А. Бердов