дистрибутивный шок что это
Диагностика и лечение шока у новорожденных детей
Общая информация
Краткое описание
Российское общество неонатологов
Клинические рекомендации
Диагностика и лечение шока у новорожденных детей
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Выделяют несколько основных видов шока: дистрибутивный шок, кардиогенный шок и гиповолемический шок, который в практике неонатолога, как правило, связан с кровопотерей. В соответствии с этиологической классификацией существует также болевой шок, анафилактический шок, ожоговый шок и другие, однако эти виды шока редко встречаются в неонатальной практике. Особенностью новорожденных является возможность развития некоторых видов шока, нехарактерных для взрослых и детей более старшего возраста (шок на фоне закрытия ОАП при дуктус-зависимом ВПС, шок при фиброэластозе, шок фето-фетальном синдроме, шок при персистирующей легочной гипертензии и др). Кроме того, некоторые врожденные нарушения метаболизма, сопровождающиеся гипераммониемией или гипергликемией, могут также симулировать клинику септического шока.
Особенности наиболее часто встречающихся видов неонатального шока.
Лечение следует начинать вне зависимости от подозреваемой стадии шока.

Этиология и патогенез
ЭТИОЛОГИЯ ШОКА
Клиническая картина
Cимптомы, течение
Диагностика
СВ правого желудочка. Объем крови, выброшенной правым желудочком за минуту. Величина кровотока оценивается на уровне бифуркации легочной артерии. Нормальные показатели соответствуют показателям СВ левого желудочка. В связи с тем, что на сердечный выброс ПЖ не влияет ГЗФАП, этот показатель рекомендуется использовать в первые 24 часа после рождения, а также у недоношенных новорожденных с ГЗФАП. Однако, при значительном шунтировании крови через овальное окно СВ ПЖ также не будет характеризовать системный кровоток. В этой ситуации для косвенной оценки системного кровотока используют данные о возврате крови к сердцу – кровоток в верхней полой вене.
Кровоток в верхней полой вене (ВПВ). Объем крови, проходящий через верхнюю полую вену на уровне ее впадения в правое предсердие. Характеризует кровоток в верхней половине туловища, 70-80% которого составляет кровоток в головном мозге. Измеряется в мл/кг/мин. Составляет 30-50% выброса правого желудочка. Кровоток значительно возрастает в первые 48 часов жизни – от 70 мл/кг/мин в возрасте 5 часов жизни до 90 мл/кг/мин в возрасте 48 часов. Таким образом, с учетом данных о значительном приросте в первые 48 часов, нормальные значения: 40-120 мл/кг/мин.
Для оценки функции миокарда используются данные о фракции выброса и фракции укорочения. Основной проблемой достоверности этих измерений у недоношенных новорожденных является традиционное использование для этого М-режима, при котором оценивается движение задней стенки ЛЖ и межжелудочковой перегородки. Особенностью недоношенных является малая подвижность межжелудочковой перегородки при сокращении. Для недоношенных новорожденных предпочтительно измерение ФУ методом Симпсона.
Шок. Этиология. Патогенез. Классификация
Острые кратковременные нарушения гемодинамики могут быть преходящим эпизодом при нарушении сосудистого тонуса, рефлекторно вызванного внезапной болью, испугом, видом крови, духотой или перегревом, а также при сердечной аритмии или ортостатической гипотензии на фоне анемии или гипотонии. Такой эпизод носит название коллапса и в большинстве случаев купируется самостоятельно без лечения. Из-за преходящего снижения кровоснабжения мозга может развиться обморок – кратковременная потеря сознания, которой часто предшествуют нейро-вегетативные симптомы: мышечная слабость, потливость, головокружение, тошнота, потемнение в глазах и шум в ушах. Характерны бледность, низкое АД, бради- или тахикардия. То же самое может развиться у здоровых людей при высокой температуре окружающей среды, поскольку тепловой стресс ведет к значительному расширению кожных сосудов и снижению диастолического АД. Более продолжительные расстройства гемодинамики всегда представляют опасность для организма.
Причины шока
Шок возникает при действии на организм сверхсильных раздражителей и может развиться при различных заболеваниях, повреждениях и патологических состояниях. В зависимости от причины различают геморрагический, травматический, ожоговый, кардиогенный, септический, анафилактический, гемотрансфузионный, нейрогенный и другие виды шока. Могут быть и смешанные формы шока, вызванные сочетанием нескольких причин. С учетом патогенеза происходящих в организме изменений и требующих определенных специфических лечебных мероприятий выделяют четыре основных вида шока
Гиповолемический шок возникает при значительном снижении ОЦК в результате массивного кровотечения или дегидратации и проявляется резким снижением венозного возврата крови к сердцу и выраженной периферической вазоконстрикцией.
Кардиогенный шок возникает при резком снижении сердечного выброса вследствие нарушения сократимости миокарда или острых морфологических изменениях клапанов сердца и межжелудочковой перегородки. Развивается при нормальном ОЦК и проявляется переполнением венозного русла и малого круга кровообращения.
Перераспределительный шок проявляется вазодилятацией, снижением общего периферического сопротивления, венозного возврата крови к сердцу и повышением проницаемости капиллярной стенки.
Экстракардиальный обструктивный шок возникает вследствие внезапного возникновения препятствия кровотоку. Сердечный выброс резко падает несмотря на номальные ОЦК, сократимость миокарда и тонус сосудов.
Патогенез шока
В основе шока лежат генерализованные нарушения перфузии, приводящие к гипоксии органов и тканей и расстройствам клеточного метаболизма (рис. 15. 2. ). Системные нарушения кровообращения являются следствием снижения сердечного выброса (СВ) и изменения сосудистого сопротивления.
Первичными физиологическими нарушениями, уменьшающими эффективную перфузию тканей служат гиповолемия, сердечная недостаточность, нарушение тонуса сосудов и обструкция крупных сосудов. При остром развитии этих состояний в организме развивается «медиаторная буря» с активацией нейро-гуморальных систем, выбросом в системную циркуляцию больших количеств гормонов и провоспалительных цитокинов, влияющих на сосудистый тонус, проницаемость сосудистой стенки и СВ. При этом резко нарушается перфузия органов и тканей. Острые расстройства гемодинамики тяжелой степени, независимо от причин, вызвавших их, приводят к однотипной патологической картине. Развиваются серьезные нарушения центральной гемодинамики, капиллярного кровообращения и критическое нарушение тканевой перфузии с тканевой гипоксией, повреждением клеток и органными дисфункциями.
Нарушения гемодинамики
В ответ на снижение АД усиливается активация адаптационных систем. Сначала происходит рефлекторная активация симпатической нервной системы, а затем усиливается и синтез катехоламинов в надпочечниках. Содержание норадреналина в плазме возрастает в 5-10 раз, а уровень адреналина повышается в 50-100 раз. Это усиливает сократительную функцию миокарда, учащает сердечную деятельность и вызывает селективное сужение периферического и висцерального венозного и артериального русла. Последующая активация ренин-ангиотензинового механизма приводит к еще более выраженной вазоконстрикции и выбросу альдостерона, задерживающего соль и воду. Выделение антидиуретического гормона уменьшает объем мочи и увеличивает ее концентрацию.
Сужение сосудов сердца и мозга происходит гораздо в меньшей степени по сравнению с другими зонами, и эти органы дольше других обеспечиваются кровью за счет резкого ограничения кровоснабжения других органов и тканей. Уровни метаболизма сердца и мозга высоки, а их запасы энергетических субстратов крайне низки, поэтому эти органы не переносят длительную ишемию. На обеспечение немедленных потребностей жизненно важных органов — мозга и сердца и направлена в первую очередь нейроэндокринная компенсации пациента при шоке. Достаточный кровоток в этих органах поддерживается дополнительными ауторегуляторными механизмами, до тех пор, пока артериальное давление превышает 70 мм рт. ст.
Централизация кровообращения – биологически целесообразная компенсаторная реакция. В начальный период она спасает жизнь больному. Важно помнить, что первоначальные шоковые реакции – это реакции адаптации организма, направленные на выживание в критических условиях, но переходя определенный предел, они начинают носить патологический характер, приводя к необратимым повреждениям тканей и органов. Централизация кровообращения, сохраняющаяся в течение нескольких часов, наряду с защитой мозга и сердца таит в себе смертельную опасность, хотя и более отдаленную. Эта опасность заключается в ухудшении микроциркуляции, гипоксии и нарушении метаболизма в органах и тканях.
Коррекция нарушений центральной гемодинамики при шоке включает в себя интенсивную инфузионную терапию, направленную на увеличение ОЦК, использование препаратов влияющих на тонус сосудов и сократительную способность миокарда. Лишь при кардиогенном шоке массивная инфузионная терапия противопоказана.
Нарушения микроциркуляции и перфузии тканей
Микроциркуляторное русло (артериолы, капилляры и венулы) является самым важным звеном системы кровообращения в патофизиологии шока. Именно на этом уровне происходит доставка к органам и тканям питательных веществ и кислорода, а также происходит удаление продуктов метаболизма.
Развивающийся спазм артериол и прекапиллярных сфинктеров при шоке приводит к значительному уменьшению количества функционирующих капилляров и замедлению скорости кровотока в перфузируемых капиллярах, ишемии и гипоксии тканей. Дальнейшее ухудшение перфузии тканей может быть связано с вторичной капиллярной патологией. Накопление ионов водорода, лактата и других продуктов анаэробного обмена веществ приводит к снижению тонуса артериол и прекапиллярных сфинктеров и еще большему снижению системного АД. При этом венулы остаются суженными. В данных условиях капилляры переполняются кровью, а альбумин и жидкая часть крови интенсивно покидают сосудистое русло через поры в стенках капилляров («синдром капиллярной утечки»). Сгущение крови в микроциркуляторном русле приводит к возрастанию вязкости крови, при этом увеличивается адгезия активированных лейкоцитов к эндотелиальным клеткам, эритроциты и другие форменные элементы крови слипаются между собой и образуют крупные агрегаты, своеобразные пробки, которые еще больше ухудшают микроциркуляцию вплоть до развития сладж-синдрома.
Сосуды, блокированные скоплением форменных элементов крови, выключаются из кровотока. Развивается так называемое “патологическое депонирование”, которое еще больше снижает ОЦК и ее кислородную емкость и уменьшает венозный возврат крови к сердцу и как следствие вызывает падение СВ и дальнейшее ухудшение перфузии тканей. Ацидоз, кроме того, снижает чувствительность сосудов к катехоламинам, препятствуя их сосудосуживающему действию и приводит к атонии венул. Таким образом, замыкается порочный круг. Изменение соотношения тонуса прекапиллярных сфинктеров и венул считается решающим фактором в развитии необратимой фазы шока.
Неизбежным следствием замедления капиллярного кровотока является развитие и гиперкоагуляционного синдрома. Это приводит к диссеминированному внутрисосудистому тромбообразованию, что не только усиливает расстройства капиллярного кровоообращения, но и вызывает развитие фокальных некрозов и полиорганной недостаточности.
Ишемическое поражение жизненно важных тканей последовательно приводит к вторичным повреждениям, которые поддерживают и усугубляют шоковое состояние. Возникающий порочный круг способен привести к фатальному исходу.
Нарушения метаболизма
В условиях пониженной перфузии капиллярного русла не обеспечивается адекватная доставка питательных веществ к тканям, что приводит к нарушению метаболизма, дисфункции клеточных мембран и повреждению клеток. Нарушаются углеводный, белковый, жировой обмен, резко угнетается утилизация нормальных источников энергии – глюкозы и жирных кислот. При этом возникает резко выраженный катаболизм мышечного белка.
Развивающееся при шоке повышение в плазме уровня адреналина, кортизола, глюкагона и подавление секреции инсулина воздействуют на обмен веществ в клетке изменениями в использовании субстратов и белковом синтезе. Эти эффекты включают увеличенный уровень метаболизма, усиление гликогенолиза и глюконеогенеза. Уменьшение утилизации глюкозы тканями почти всегда сопровождается гипергликемией. В свою очередь гипергликемия может приводить к снижению кислородного транспорта, нарушению водно-электролитного гомеостаза и гликозилированию белковых молекул со снижением их функциональной активности. Значимое дополнительное повреждающее воздействие стрессорной гипергликемии при шоке способствует углублению органной дисфункции и требует своевременной коррекции с поддержанием нормогликемии.
На фоне нарастающей гипоксии нарушаются процессы окисления в тканях, их метаболизм протекает по анаэробному пути. При этом в значительном количестве образуются кислые продукты обмена веществ, и развивается метаболический ацидоз. Критерием метаболической дисфункции служат уровень рН крови ниже 7, 3, дефицит оснований, превышающий 5, 0 мЭкв/л и повышение концентрации молочной кислоты в крови свыше 2 мЭкв/л.
Важная роль в патогенезе шока принадлежит нарушению обмена кальция, который интенсивно проникает в цитоплазму клеток. Повышенный внутриклеточный уровень кальция увеличивает воспалительный ответ, приводя к интенсивному синтезу мощных медиаторов системной воспалительной реакции (СВР). Воспалительные медиаторы играют значительную роль в клинических проявлениях и прогрессировании шока, а также и в развитии последующих осложнений. Повышенное образование и системное распространение этих медиаторов могут приводить к необратимым повреждениям клеток и высокой летальности. Использование блокаторов кальциевого канала повышает выживаемость пациентов с различными видами шока.
Действие провоспалительных цитокинов сопровождается высвобождением лизосомальных ферментов и свободных перекисных радикалов, которые вызывают дальнейшие повреждения — «синдром больной клетки». Гипергликемия и повышение концентрации растворимых продуктов гликолиза, липолиза и протеолиза приводят к развитию гиперосмолярности интерстициальной жидкости, что вызывает переход внутриклеточной жидкости в интерстициальное пространство, обезвоживание клеток и дальнейшее ухудшение их функционирования. Таким образом, дисфункция клеточной мембраны может представлять общий патофизиологический путь различных причин шока. И хотя точные механизмы дисфункции клеточной мембраны неясны, лучший способ устранения метаболических нарушений и предотвращения необратимости шока – быстрое восстановление ОЦК.
В развитии этих изменений ведущая роль принадлежит фактору некроза опухоли (ФНО), интерлекинам (ИЛ-1, ИЛ-6, ИЛ-8), фактору активации тромбоцитов (ФАТ), лейкотриенам (В4, С4, D4, E4), тромбоксану А2, простагландинам (Е2, Е12), простациклину, гамма-интерферону. Одновременное и разнонаправленное действие этиологических факторов и активированных медиаторов при шоке приводит к повреждению эндотелия, нарушению сосудистого тонуса, проницаемости сосудов и дисфункции органов.
Таким образом, в основе патогенеза шока лежат глубокие и прогрессирующие расстройства гемодинамики, транспорта кислорода, гуморальной регуляции и метаболизма. Взаимосвязь этих нарушений может привести к формированию порочного круга с полным истощением адаптационных возможностей организма. Предотвращение развития этого порочного круга и восстановление ауторегуляторных механизмов организма и является основной задачей интенсивной терапии больных с шоком.
Стадии шока
Шок представляет собой динамический процесс, начинающийся с момента действия фактора агрессии, который приводит к системному нарушению кровообращения, и при прогрессировании нарушений заканчивающийся необратимыми повреждениями органов и смертью больного. Эффективность компенсаторных механизмов, степень клинических проявлений и обратимость возникающих изменений позволяют выделить в развитии шока ряд последовательных стадий.
Стадия прешока
Шоку обычно предшествует умеренное снижение систолического АД, не превышающее 20 мм рт. ст. от нормы (или 40 мм рт. ст. при наличии у больного артериальной гипертензии), которое стимулирует барорецепторы каротидного синуса и дуги аорты и активирует компенсаторные механизмы системы кровообращения. Перфузия тканей существенно не страдает и клеточный метаболизм остается аэробным. Если при этом прекращается воздействие фактора агрессии, то компенсаторные механизмы могут восстановить гомеостаз без каких-либо лечебных мероприятий.
Ранняя (обратимая) стадия шока
Промежуточная (прогрессивная) стадия шока
Это жизнеугрожающая критическая ситуация с уровнем систолического АД ниже 80 мм рт. ст. и выраженными, но обратимыми нарушениями функций органов при немедленном интенсивном лечении. При этом требуется проведение искусственной вентиляции легких (ИВЛ) и использование адренергических лекарственных средств для коррекции нарушений гемодинамики и устранения гипоксии органов. Длительная глубокая гипотензия приводит к генерализованной клеточной гипоксии и критическому нарушению биохимических процессов, которые быстро становятся необратимыми. Именно от эффективности терапии в течение первого так называемого «золотого часа» зависит жизнь больного.
Рефрактерная (необратимая) стадия шока
Для этой стадии характерны выраженные расстройства центральной и периферической гемодинамики, гибель клеток и полиорганная недостаточность. Интенсивная терапия неэффективна, даже если устранены этиологические причины и временно повышалось АД. Прогрессирующая полиорганная дисфункция обычно ведет к необратимому повреждению органов и смерти.
Диагностические исследования и мониторинг при шоке
Диагностические исследования при шоке включают также клинический анализ крови, определение содержания электролитов, креатинина, показателей свертываемости крови, группы крови и резус-фактора, газов артериальной крови, электрокардиографию, эхокардиографию, рентгенографию грудной клетки. Только тщательно собранные и корректно интерпретированные данные помогают принимать правильные решения.
Центральное венозное давление
Низкое ЦВД является косвенным критерием абсолютной или косвенной гиповолемии, а его подъем выше 12 см вод. ст. указывает на сердечную недостаточность. Измерение ЦВД с оценкой его ответа на малую нагрузку жидкостью помогает выбрать режим инфузионной терапии и определить целесообразность инотропной поддержки. Первоначально больному в течение 10 минут вводят тест-дозу жидкости: 200 мл при исходном ЦВД ниже 8 см водн. ст. ; 100 мл – при ЦВД в пределах 8-10 см водн. ст. ; 50 мл – при ЦВД выше 10 см водн. ст. Реакцию оценивают, исходя из правила «5 и 2 см водн. ст. »: если ЦВД увеличилось более чем на 5 см, инфузию прекращают и решают вопрос о целесообразности инотропной поддержки, поскольку такое повышение свидетельствует о срыве механизма регуляции сократимости Франка-Старлинга и указывает на сердечную недостаточность. Если повышение ЦВД меньше 2 см вод. ст. – это указывает на гиповолемию и является показанием для дальнейшей интенсивной инфузионной терапии без необходимости инотропной терапии. Увеличение ЦВД в интервале 2 и 5 см водн. ст. требует дальнейшего проведения инфузионной терапии под контролем показателей гемодинамики.
Мониторинг гемодинамики в малом круге кровообращения
Инвазивный мониторинг кровообращения в малом круге производят с помощью катетера, установленного в легочной артерии. С этой целью обычно используют катетер с плавающим баллончиком на конце (Swan-Gans), который позволяет измерить ряд параметров:
Определение этих параметров значительно расширяют возможности мониторинга и оценки эффективности гемодинамической терапии. Получаемые при этом показатели позволяют:
Снижение насыщения кислородом смешанной венозной крови всегда является ранним показателем неадекватности сердечного выброса.
Диурез
Ультразвуковые исследования у пациентов в критическом состоянии (Часть I)
Пациенты в критическом состоянии в экстремальных условиях представляют собой одну из самых серьезных проблем для служб спасения и реаниматологов. По прибытии в отделение неотложной помощи (ОНП) или отделение интенсивной терапии (ОИТ) мало что известно о медицинском анамнезе пациента или обстоятельствах, которые привели к данной критической ситуации.
Пациенты в тяжелом состоянии чаще всего не могут предоставить данные своего медицинского анамнеза из-за тяжелой одышки, боли или изменений в сознании. Показатели витальных функций и физикальный осмотр критически важны для лечения пациентов, однако эти результаты часто неспецифичны и могут практически совпадать при различных этиологиях шока. Такие пациенты часто поступают с нестабильной гемодинамикой, поэтому должны быть начаты общепринятые реанимационные мероприятия одновременно с проведением первоначальной диагностической оценки. Тяжесть состояния пациента диктует необходимость проведения ключевых терапевтических вмешательств до получения лабораторных данных или консультативных диагностических визуальных исследований.
В настоящее время существует потребность в быстром и всегда доступном методе диагностики пациентов в критическом состоянии. В качестве такого метода было предложено ультразвуковое исследование, которое проводится врачом ультразвуковой диагностики непосредственно у постели нестабильного пациента. Сонографическая оценка пациентов в критическом состоянии предоставляет ценную информацию, которая помогает клиницисту во время первоначальной оценки и стабилизации недифференцированного шока. Эта статья призвана продемонстрировать, как прицельное ультразвуковое исследование может быть использовано для быстрой оценки физиологической основы шока у конкретного пациента, выявления потенциально летальных, но обратимых состояний, которые могут быть не диагностированы у постели пациента. Ультрасонография также помогает направить реанимационные мероприятия в правильное русло, в частности, когда это касается объема циркулирующей жидкости. До настоящего времени, применение экстренной сонографии было сосредоточено на визуализации патологических изменений заболеваний и обеспечении ультразвукового наведения для инвазивных процедур. Мы предлагаем отойти от такого традиционного использования и предлагаем направлять ультразвуковую оценку на то, чтобы оценивать физиологические процессы, лежащие в основе шока у пациентов в критическом состоянии, а также следить за динамикой их развития в реальном времени в ответ на реанимационные мероприятия.
ОГРАНИЧЕНИЯ В ТЕКУЩЕЙ ПРАКТИКЕ
Поступление пациента в стационар происходит по стандартной схеме. После того, как пациент доставлен в ОНП или ОИТ, он осматривается врачом, который назначает дополнительные методы диагностики, например: рентгенографию, компьютерную томографию (КТ), ультрасонографию или эхокардиографию. Диагностические исследования проводятся медицинским техником, как правило, только после того, как пациент перемещается за пределы ОИТ в радиологическое, сосудистое отделение или кабинет эхокардиографии. Полученные изображения отправляют по сети и впоследствии они интерпретируются радиологом или кардиологом. Заключение экспертов затем передаются лечащему врачу, который использует эту информацию для принятия клинических решений относительно лечения пациента.
Хотя эта последовательность событий может удовлетворительно работать для пациентов в амбулаторных условиях и клинически стабильных пациентов в ОНП или ОИТ, у пациентов в критическом состоянии этот алгоритм может привести к значительным задержкам в лечении. Для гемодинамически нестабильных пациентов терапию необходимо начинать немедленно при поступлении, а план лечения не может быть отложен, в ожидании проведения и интерпретации дополнительных исследований. Пациенты в ОНП и ОИТ зачастую нестабильны, чтобы покидать зону реанимации, где их жизненные функции контролируются приборами, поэтому консультативные исследования должны выполняться на месте с использованием подвижных устройств, будь то рентгенография, ультрасонография или эхокардиография. Многие из этих консультативных услуг могут быть недоступны в вечерние и ночные часы. Однако, пациенты в критическом состоянии поступают в больницу, независимо от времени суток.
Прицельное ультразвуковое исследование направлено на улучшение качества помощи пациентам путем диагностики состояний на ранней стадии, особенно когда эти состояния потенциально смертельны, а результат лечения зависит от времени его начала. Использование ультразвука для оценки пациентов с острой травмой и для ультразвукового наведения при неотложных процедурах было обосновано в литературе, и в настоящее время принято в медицинской практике. Американский колледж хирургов включил ургентную сонографию при травме – Focused Assessment with Sonography in Trauma (FAST) в свой расширенный протокол обучающих тренировочных курсов для специалистов (врачей) в оказании помощи пострадавшим при травме – Advanced Trauma Life Support (ATLS). Агентство исследований и оценки качества медицинского обслуживания – Agency for Healthcare Research and Quality (AHRQ) включило в рекомендации сосудистый доступ под ультразвуковым контролем, как один из самых безопасных методов для пациентов. Другие прицельные ультразвуковые исследования были одобрены для применения у постели больного, включая исследование аорты, для исключения её аневризмы аорты и ограниченную эхокардиографию. Американское общество эхокардиографии – American Society of Echocardiography (ASE) в консенсусе с Американским колледжем врачей неотложной помощи – American College of Emergency Physicians (ACEP) недавно признали эффективность специализированного ультразвукового исследования сердца – focused cardiac ultrasound (FOCUS) в ургентных ситуациях. Для органов, которые традиционно считались не поддающимися ультразвуковому исследованию, таких как легкие, разрабатываются техники исследования, эффективность которых увеличивается, и они завоевывают всю большую популярность. Кроме того, методы исследования, ранее разработанные в других специальностях, например, измерение состояния объема нижней полой вены (НПВ) интегрируются в специализированные ультразвуковые методики в ОНП или ОИТ.
КАТЕГОРИИ ШОКА
Шок определяется как состояние недостаточной перфузии тканей организма. Низкое давление крови (гипотония) характерный симптом, хотя и не всегда присутствует у пациентов с шоком. Существует 4 основных категории шока: кардиогенный, гиповолемический, дистрибутивный (перераспределительный) и обструктивный (рис. 1).
Кровотечение
Сепсис
Недостаточность нагнетательной функции сердца
Тампонада
Дегидратация
Пневмоторакс
Нейрогенный шок
Аритмия
Массивная эмболия легочной артерии
Рис. 1. Категории шока. Категории шока, наиболее «подходящие» для проведения ультразвуковой диагностики для постановки диагноза у постели больного, выделены жирным шрифтом.
Кардиогенный шок часто возникает из-за недостаточности левого желудочка (ЛЖ), однако, также развивается в результате аритмий, например, при желудочковой тахикардии, острой клапанной недостаточности, например, при недостаточности задней створки митрального клапана на фоне нижне-диафрагмального инфаркта миокарда, или недостаточности правого желудочка (ПЖ) в результате правостороннего инфаркта. Гиповолемический шок, состояние выраженного снижения внутрисосудистого объема, может быть следствием целого ряда причин. Скрытое кровотечение, как, например, желудочно-кишечное кровотечение или разрыв аневризмы брюшного отдела аорты (AБА), а также сильное обезвоживание, например, при гиперосмолярной некетоацидотической коме, являются наиболее частыми причинами развития шока. Дистрибутивный (перераспределительный) шок является результатом вазодилатации или потери внутрисосудистой жидкости. Чаще всего это связано с инфекционными (септическими) или воспалительными (третье пространство) причинами. В меньшей степени, дистрибутивный шок также может быть анафилактической и нейрогенной этиологии. Обструктивный шок возникает в результате механической обструкции, которая препятствует венозному притоку и/или сердечному выбросу. Это встречается при сердечной тампонаде, напряженном пневмотораксе и массивной тромбоэмболии легочной артерии (ТЭЛА).
Некоторые клинические проявления шока и гипотонии легко классифицируются на основе анамнеза и физикального обследования. У пожилого пациента с жалобами на кашель, тахипноэ, лихорадку и с признаками гипоксии и гипотонии, можно предварительно устанавливать диагноз дистрибутивного/септического шока на фоне пневмонии, даже до получения данных дополнительных обследований. При этом лечащий врач, зачастую, будет начинать терапию до подтверждения диагноза. С другой стороны, достаточно трудно отдифференцировать глубокий гиповолемический шок в результате разрыва AБA от дистрибутивного шока у больного с прогрессирующим уросепсисом, пациенты не всегда имеют классические клинические проявления, а признаки и симптомы могут быть обманчивыми. Кроме того, пациенты могут иметь схожую этиологию развития шокового состояния (дистрибутивный/септический шок), которое усугубляет изначально тяжелую кардиомиопатию. Именно в этих случаях недифференцированного шока, как нам кажется, наиболее важным является ультразвуковая оценка физиологических изменений и исключение опасных для жизни состояний.
УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ ПАЦИЕНТОВ ПРИ ШОКЕ
Структурированный протокол ультразвукового исследования, который включает оценку сердца, НПВ, живота, аорты и легких, может предоставлять ценную информацию для определения различных категорий шока, описанных выше. Аналогично FAST протоколу при травме, такой протокол ультразвукового исследования служит в качестве стандартизированного подхода, который легко запоминается и удобный для использования в ситуациях с высоким психологическим напряжением. Он позволяет создать систематизированную логическую структуру, которая облегчает дифференциальную диагностику шока у пациента с гипотензией, а в некоторых случаях может выявлять конкретную причину заболевания у данного пациента. Такая тактика также позволяет клиницисту принимать более обоснованные решения при первоначальном восполнении дефицита жидкости и последующей коррекции внутрисосудистого объема. Однако, в отличие от протокола FAST, ультразвуковая оценка больного в критическом состоянии технически и теоретически более сложная, что связано c тяжестью большинства пациентов и обширным спектром дифференциальных диагнозов, которые необходимо учитывать. Протокол FAST служит для идентификации свободной жидкости в ключевых отделах организма, а также тампонады сердца, что указывает на травматический источник кровоизлияния. Ультразвуковое исследование у пациентов в критическом состоянии включает аналогичную оценку, но значительно расширяет применяемые методы и оценивает конкретные органы.
Данные ультразвукового исследования на любой стадии патологического процесса по времени всегда совпадают со степенью тяжести основного заболевания пациента. Учитывая запущенную стадию болезни и предельные значения физиологических функций у пациентов в состоянии шока, результаты ультразвукового исследования, как правило, очевидны и достаточно легко распознаются специалистом. Например, состояние пациента при подозрении на массивную ТЭЛА, как правило, слишком нестабильное, чтобы он мог покинуть зону реанимации для подтверждения диагноза на КТ, или дождаться переносной консультативной эхокардиографии до проведения ключевых терапевтических мероприятий. Идентификация значительной дилатации ПЖ во время ультразвуковой оценки у постели больного в сочетании с предварительным клиническими данными может служить достаточно убедительным доказательством, которое позволяет в некоторых случаях начинать тромболизис. С другой стороны, у стабильных пациентов следует проводить комплексное эхокардиографическое обследование для более точной оценки степени дисфункции ПЖ – важного прогностического фактора при лечении ТЭЛА. Хотя дополнительная консультативная визуальная диагностика всегда играет важную роль во всесторонней оценке и дифференциальной диагностике особенностей протекания болезни, прицельное ультразвуковое исследования у пациента в критическом состоянии необходимо для выявления предельных патофизиологических параметров для более эффективного оказания неотложной медицинской помощи.
ОБЗОР УЛЬТРАЗВУКОВЫХ ПРОТОКОЛОВ
Ультразвуковой алгоритм для оценки пациентов в критическом состоянии с недифференцированной гипотензией был впервые предложен Rose и коллегами в 2001 году, который был назван ультразвуковым протоколом UHP (Undifferentiated Hypotensive Patient). В протокол были включены 3 ранее проверенных ультразвуковых исследования для выявления обратимых причин гипотонии. Относительно простой по охвату, он состоял из исследования проекции гепаторенального (кармана Морисона) пространства для оценки гемоперитонеума, субксифоидальной кардиальной проекции для определения перикардиального выпота и поперечной проекции аорты, для исключения АБА. В 2004 году Jones с коллегами расширили этот ультразвуковой протокол и назвали его прицельным ультразвуковым исследованием. Новый протокол включал дополнительные абдоминальные (сагиттальные и поперечные тазовые) и сердечные (парастернальные продольные, апикальные 4-камерные) проекции, а также исследование НПВ для оценки состояния объема. Прицельное УЗИ, которое проводилось немедленно при поступлении пациентов, сравнивалось со стандартным диагностическим подходом за 15 минут до ультразвукового исследования. Немедленное прицельное ультразвуковое исследование привело к сужению спектра дифференциальных диагнозов на ранней стадии лечения пациентов, а предварительный диагноз в большинстве случаев был более точным.
С тех пор были предложены другие протоколы и другая терминология для алгоритма ультразвуковой оценки пациента при шоке. Протокол FATE (Focus Assessed Transtoracic Echorardiogram), который выполняется не кардиологами в условиях палаты интенсивной терапии, был предложен для оценки ключевых показателей гемодинамики у больных в критическом состоянии. Протокол CAUSE (Cardiac Arrest Ultra-Sound Exam) показал эффективность ультразвука для быстрого выявления обратимых причин неаритмогенной остановки сердца: тяжелая гиповолемия (например, при разрыве АБА), тампонада сердца, напряженный пневмоторакс и массивная ТЭЛА. Аналогичным образом, протокол FEEL (Focused Echocardiography Evaluation in Life Support) был предложен в качестве быстрого и прицельного эхокардиографического протокола, который должен использоваться для проведения периреанимационной помощи. Протокол ACES (Abdominal and Cardiac Evaluation with Sonography in Shock) продемонстрировал, как интеграция отдельных данных ультразвукового исследования пациента облегчает определении категории шока.
В последнее время были предложены более подробные протоколы под названием протокол RUSH (Rapid Ultrasound in Shock and Hypotension). Perera и коллеги описали тщательную ультразвуковую оценку, разделенную на 3 категории: насосная функция (сфокусированная эхокардиография на перикардиальном выпоте, общей сократимости ЛЖ и соотношении ПЖ/ЛЖ, в качестве заменяющего маркера для массивной ТЭЛА), резервуарная функция (определения объема НПВ, выявления свободной жидкости в перитонеальной и плевральной полости), а также сосуды (грудная аорты для выявления признаков расслоения, брюшной аорты для выявления АБА и вен нижних конечностей для выявления тромбоза глубоких вен). В своем описании протокола RUSH Weingart и коллеги предложили мнемоническое правило «HI-MAP», чтобы облегчить запоминание последовательности ультразвуковых действий, соответствующих сердцу (heart), НПВ (IVC), карману Морисона (представляет собой абдоминальное обследование для определения свободной жидкости), аорте и легким (pulmonary) (рис.2). HI-MAP служит полезным правилом для быстрого получения основных ультразвуковых данных у пациентов в критическом состоянии при шоке или экстремальных ситуациях.
Рис. 2. Протокол RUSH. 1 – сердце; 2 – НПВ; 3 – живот; 4 – аорта; 5 – легкие.
Предлагаемые ультразвуковые алгоритмы не обязательно должны быть четко выполнены до конца у всех пациентов. Исследование сердца и НПВ необходимо проводить всем пациентам в критическом состоянии. Остальные компоненты обследования могут проводиться в зависимости от специфики клинических проявлений пациента. Например, гипотония у пожилого пациента с болью в нижней части спины или фланке указывает на возможный разрыв АБА, и поэтому крайне важно, проводить ультразвуковое исследование брюшной аорты для оценки наличия или отсутствия этой патологии. Для сравнения, гипотония у молодой пациентки с болью в нижней части спины или фланке с большей вероятностью указывает на разрыв эктопической беременности, при этом ультразвуковое исследование брюшной полости и таза для идентификации свободной жидкости в сочетании с тестом мочи на беременность приобретает важное значение для этой пациентки.
Интерпретация результатов ультразвукового исследования может быть адекватно выполнена только в клиническом контексте анамнеза болезни пациента и текущих клинических проявлений. Для иллюстрации: боль в нижней части спины или фланке и свободная жидкость в животе у молодой пациентки с гипотензией указывает на внематочную беременность, что почти является неопровержимым, если тест мочи на беременность является положительным. Напротив, наличие перитонеальной свободной жидкости у пациента с гипотензией любого возраста с ранее диагностированным циррозом может быть случайной находкой и, поэтому, её не следует рассматривать как этиологию шока у данного пациента. Таким образом, эти протоколы обеспечивают теоретическую основу для прицельного ультразвукового исследования, которое может быть применено к пациенту в критическом состоянии, но в то же время оно должно быть адаптировано (как с точки зрения отдельно выполняемых компонентов, так и с точки зрения интерпретации результатов) конкретно к каждому пациенту.
ОГРАНИЧЕНИЯ УЛЬТРАЗВУКОВОЙ ВИЗУАЛИЗАЦИИ
Цель клинического ультразвукового исследования не заключается в замене дополнительных консультативных методов визуализации. Ультразвуковая техника предназначена для использования в сфокусированных задачах, которые отвечают на конкретные клинические вопросы прямо у постели больного. Учитывая то, что прицельное ультразвуковое исследование может быть чрезвычайно эффективно при обследовании пациента, врач-диагност должен также знать о возможных ограничениях. Например, оценка для клапанной дисфункции выходит за рамки большинства врачей экстренной помощи, за исключением тех, которые получили дополнительное специализированное обучение. Врачи-диагносты могут выполнять прицельную эхокардиографию для оценки нормальной, сниженной или значительно сниженной систолической функции при оценке кардиогенного шока, но при этом кардиогенная патология также может быть вызвана острой клапанной недостаточностью. Для исключения этого диагноза требуется комплексная эхокардиография, которая выполняется и интерпретируется узкими специалистами.
Ограничения прицельного ультразвукового исследования рассматриваются в каждом из последующих разделов, в которых подробно описаны отдельные компоненты предлагаемого ультразвукового протокола. Очень важно, чтобы врачи ультразвуковой диагностики знали об этих ограничениях при принятии решений по тактике лечения пациентов на основании результатов ультразвукового исследования.
КОМПОНЕНТЫ УЛЬТРАЗВУКОВОГО ПРОТОКОЛА CARDIAC
Ультразвуковая оценка пациента при шоке начинается с эхокардиографии. Прицельная эхокардиография – это ответственный диагностический тест первой линии, который помогает ускорить диагностическую оценку и начало проведения реанимационных мероприятий у постели пациента. Ценность методики заключается в её способности предоставлять клиницистам анатомическую и физиологическую информацию в режиме реального времени, а также в возможности повторного осмотра после проведенных мероприятий для оценки клинического ответа. При ультразвуковом исследовании сердца у постели шокового больного проводится целенаправленная оценка причины шока: нарушение насосной функции (кардиогенный шок), неадекватная преднагрузка (гиповолемический или дистрибутивный шок) или механическая обструкция (обструктивный шок). И ASE и ACEP одобряют следующие клинические параметры для фокусного ультразвукового исследования сердца (focused cardiac ultrasound – FOCUS): перикардиальный выпот, общая сердечная функция, относительный размер камеры и объемный статус. УЗИ у пациента в критическом состоянии начинается с оценки каждого из этих параметров.
Сердце отображается в нескольких разных проекциях, а данные, полученные на одной проекции, должны быть подтверждены или опровергнуты на другой. Для ультразвукового исследования сердца используется датчик с частотной матрицей от 2 до 5 МГц с малым профилем, который легче расположить между ребрами при попытке достичь акустического окна для сердца. Существует четыре основных проекции для оценки сердечной деятельности: парастернальная продольная проекция, парастернальная поперечная проекция, апикальная 4-камерная и подреберная. При возможности, пациент должен быть повернут в положение на левый бок, так как такая позиция приближает сердце к передней грудной стенке и улучшает визуализацию. Парастернальная проекция получается путем размещения датчика слева от грудины с плавным перемещением его через стенку грудной клетки между вторым и пятым межреберьями до получения наилучшего возможного изображения. Как только будет получена парастернальная продольная проекция, датчик может быть повернут на 90 град для получения парастернальной поперечной проекции. Апикальная 4-камерная проекция получается путем помещения датчика ниже левого соска у мужчин или под левой грудью у женщин и поворота лицевой поверхности датчика в сторону основания сердца. Подреберная проекция получается путем размещения датчика чуть ниже мечевидного отростка, при использовании левой доли печени в качестве акустического окна, а лицевая поверхность датчика направлена от живота к сердцу.
ГЛОБАЛЬНАЯ ФУНКЦИЯ СЕРДЦА
Определение глобальной функции ЛЖ является основополагающим для ультразвуковой диагностики пациентов в критическом состоянии и, как было показано, является прогностическим маркером клинического исхода для различных патологических состояний. Оценка систолической функции происходит на основе качественной оценки в нескольких проекциях экскурсии эхокардиальной границы и утолщения миокарда. Функция ЛЖ может быть объединена в следующие категории: выраженное угнетение (фракция выброса 55%). ФВ превышающая 70%, считается гипердинамической, которая может проявляться почти облитерацией полости желудочка во время систолы. У пациентов в критическом состоянии гипердинамическая ФВ обычно отражает недозаполненный ЛЖ, что может развиваться в результате значительной гиповолемии, обструктивного процесса (классическая массивная ТЭЛА) или тяжелой периферической вазодилатации, как в случае парораспределительного/септического шока. Было показано, что у пациентов без травматического анамнеза с недифференцированной симптоматической гипотензией показатель ФВ, превышающий 55%, является предвестником септического шока.
Хотя существует множество количественных показателей функции ЛЖ (с использованием М-режима, двумерной или доплеровской визуализации), они могут быть ограничены допущениями относительно формы ЛЖ, наличием обширных аномалий движения стенок или навыками диагноста. В конечном итоге, оценка функции ЛЖ обычно выполняется субъективно, при этом данные визуальной оценки опытных экспертов подобны или равны количественным вычислениям. После проведения целенаправленного обучения и тренинга, специалисты неотложной помощи продемонстрировали хорошие навыки в дифференциации нормальной и сниженной систолической функции ЛЖ (рис. 3).
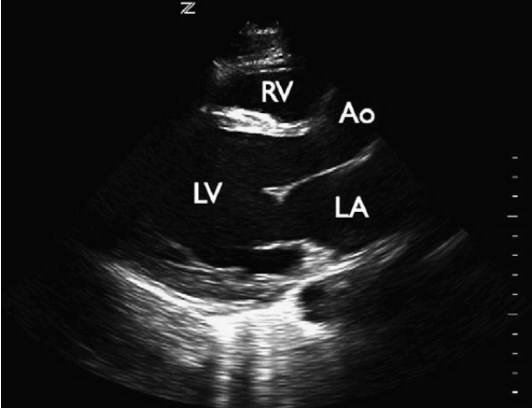
Рис. 3. Дилятационная кардиомиопатия. Парастернальная продольная проекция сердца демонстрирует расширенный ЛЖ в результате хронического снижения ФВ. Ao – корень аорты, LA – левое предсердие, LV – левый желудочек; RV – правый желудочек.
Исследования показали, что врачи интенсивной терапии могут быть обучены точно определять функцию ЛЖ у пациентов в состоянии гипотензии. Врачи некардиологического профиля, как правило, имеют проблемы с определением пациентов с умеренно сниженной ФВ. Проведенная клиницистом эхокардиография помогает эффективно дифференцировать нормальную или сильно сниженную функцию ЛЖ. Поэтому цель эхокардиографии у постели пациента не определять тонкие различия ФВ, а выявлять пограничные состояния дисфункции ЛЖ для выявления физиологической основы шока у пациентов в критическом состоянии.
ПЕРИКАРДИАЛЬНЫЙ ВЫПОТ
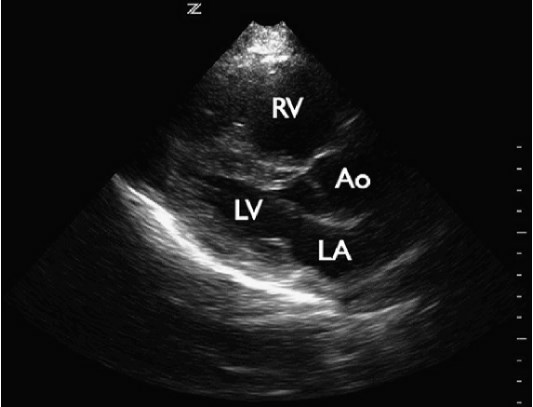
Перикардиальный выпот не является чем-то необычным у пациентов с одышкой или гипотонией. Пациенты с перикардиальным выпотом могут иметь неспецифические симптомы, такие как кашель, одышка при нагрузке и утомляемость, а результаты физикального обследования в равной степени неспецифические. Исследования показали, что эхокардиография у кровати пациента позволяет обнаруживать наличие перикардиального выпота и, соответственно, положительно влиять на тактику лечения пациентов. Перикардиальный выпот определяется наличием жидкости (обычно анэхогенной) между эпикардом и перикардом. Это состояние вызвано различными нарушениями (инфекцией, злокачественными новообразованиями, заболеваниями соединительной ткани, почечной недостаточностью, травмой), а также может развиваться после кардиохирургических операций и инвазивных вмешательств на сердце (установка кардиостимулятора, катетеризация сердца). Как объем, так и скорость накопления жидкости являются определяющими факторами с точки зрения клинического и гемодинамического воздействия. Несколько исследований показали, что эхокардиография в рамках экстренной медицинской помощи имеет чувствительность для обнаружения перикардиальной жидкости близкую к 100%. В связи с тем, что большой плевральный выпот может быть неверно истолкован как перикардиальный выпот, нисходящая грудная аорта может быть использована для дифференциальной диагностики. Плевральный выпот расположен сзади или сбоку от нисходящей грудной аорты, тогда как перикардиальный выпот проходит спереди или медиально (рис. 4).
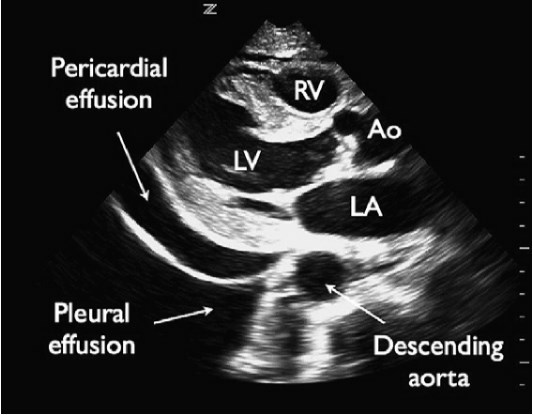
Рис. 4. Перикардиальный и плевральный выпот. Парастернальная продольная проекция сердца демонстрирует перикардиальный и плевральный выпот.
В диагностике плеврального выпота у пациентов в критическом состоянии является неуточненным вопрос о сердечной тампонаде. В то время как многие эксперты утверждают, что сердечная тампонада является в значительной степени клиническим диагнозом, эхокардиография может выявлять признаки, свидетельствующие о претампонаде или ранней тампонаде. Эхокардиографическим признаком для определения тампонады сердца является инверсия свободной стенки ПЖ во время диастолы желудочков. Дополнительные признаки включают инверсию ПП во время желудочковой систолы (наиболее распространенный и самый ранний признак), увеличение респираторной вариации скоростей притока при доплерографии (эхокардиографический эквивалент парадоксального пульса) и расширение НПВ с уменьшенной респираторной вариацией. У пациентов с травмой было показано, что эхокардиография эффективна при ранней диагностике сердечной тампонады и сокращении времени до оперативного вмешательства (торакотомии). Экономия времени при ультразвуковом исследовании у постели больного повышает эффективность идентификации и лечения перикардиального выпота у пациентов в критическом состоянии. Кроме того, для пациентов с гемодинамическими нарушениями, которым показано введение перикардиального дренажа, ультразвук можно использовать для определения наилучшего доступа при перикардиоцентезе, а затем и для наведения и контроля при его выполнении. Было показано, что перикардиоцентез под ультразвуковым контролем повышает частоту успешных попыток и снижает риск осложнений, таких как пункция миокарда, повреждение коронарных сосудов, пневмоторакс, повреждение органов брюшной полости и травмы диафрагмы.
УВЕЛИЧЕНИЕ ПРАВОГО ЖЕЛУДОЧКА
Возможность диагностики правосторонней сердечной недостаточности может оказаться жизненно важной при оценке больных с недифференцированным шоком. Пациенты с дисфункцией правых отделов сердца лечатся иначе, чем пациенты с левосторонней сердечной недостаточностью, при этом терапия может быть довольно сложной. Состояние пациентов с гипотензией и правосторонней сердечной недостаточностью может ухудшаться при агрессивном введении жидкости. Вместо этого ключевым фактором лечения является уменьшение перегрузки ПЖ жидкостью или давлением. Систолическая функция ПЖ может быть качественно оценена по аналогии с ЛЖ (путем оценки эндокардиальной пограничной экскурсии и утолщения миокарда), при этом расширение правого желудочка часто используется, как показатель дисфункции. Нормальный ПЖ тонкостенный и чувствительный к изменениям нагрузки; следовательно, небольшие изменения давления приводят к большим изменениям в объеме желудочка. Увеличение ПЖ является физиологическим ответом на избыточное давление или объемную перегрузку. Нормальное соотношение между размерами ПЖ и ЛЖ (измеренное на верхушках атриовентрикулярных клапанов в апикальной четырехкамерной проекции) составляет 0,6. Когда ПЖ равен по размеру ЛЖ, дилатация ПЖ оценивается как умеренная; когда ПЖ больше, чем ЛЖ, дилатация ПЖ оценивается как тяжелая.
Так же, как и сердечная тампонада подразумевается при выявлении выпота перикарда, так же и ТЭЛА возможна при увеличении правого желудочка. Хотя соответствующая клиническая картина и может свидетельствовать о наличие ТЭЛА, точности одной только эхокардиографии (даже если она является комплексной) не достаточно для постановки диагноза. Следует также учитывать другие причины увеличения правого желудочка: инфаркт миокарда, легочную гипертензию и хроническую обструктивную болезнь легких. В дополнение к увеличению ПЖ, при эхокардиографии у пациентов с массивной ТЭЛА может также определяться гипердинамический ЛЖ с недостаточным наполнением (рис. 5).
Рис. 5. Увеличение правого желудочка. На парастернальной продольной проекции сердца показано значительное расширение правого
желудочка и небольшой, незаполненный ЛЖ.
ЛЖ, который, как правило, имеет циркулярный вид в парастернальной поперечной проекции, может иметь D-образную форму из-за уплощения межжелудочковой перегородки в результате увеличения давления ПЖ. В некоторых случаях эхокардиография может выявлять венозный тромб в ПП который может попасть в легочной круг. Хотя и не часто, по данным литературы в пределах от 3% до 18% всей острых случаев ТЭЛА, венозная тромбоэмболия может рассматриваться как прямой признак ТЭЛА. Изначально было установлено, что симптом Макконнелла (отчетливая локальная картина дисфункции ПЖ с акинезией средней части свободной стенки, но с нормальным движением на верхушке) для диагностики острой ТЭЛА, имеет специфичность 94%. Однако последующие исследования не подтвердили эти данные, а некоторые специалисты предполагают, что апикальная сократимость ПЖ при этом не сохраняется, а признак Макконнелла является больше визуальной иллюзией, из-за связи верхушек ПЖ и ЛЖ.
НИЖНЯЯ ПОЛАЯ ВЕНА
Определение состояния внутрисосудистого объема может быть затруднено у больных в состоянии шока. Пациент с септическим шоком и гипотонией все еще может иметь недостаточный внутрисосудистый объем, несмотря на внутривенное введение в течении нескольких часов нескольких литров жидкости. Для пациента дополнительное введение объема жидкости зачастую полезнее, чем преждевременное введение вазопрессоров для увеличения артериального давления, что может иметь неблагоприятные последствия для перфузии жизненно важных органов. Кроме того, пациент с предшествующей кардиомиопатией может иметь сниженный объем в связи с септическим шоком. Увеличение объема циркулирующей жидкости у подобных пациентов проводится очень осторожно, так как чрезмерная инфузия жидкости может быстро привести к перегрузке объемом и внезапному отеку легких. В качестве емкостного резервуара НПВ может вмещать различное количество крови, а её` размер колеблется в зависимости от внутрисосудистого объема пациента. Соответственно, ультразвуковые измерения НПВ могут использоваться в качестве сонографической оценки состояния объема циркулирующей жидкости.
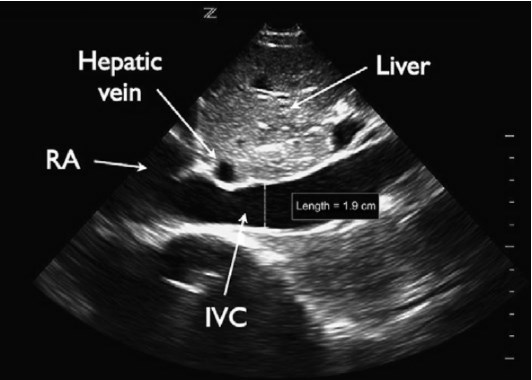
НПВ визуализируется через переднюю брюшную стенку в продольной проекции с использованием подреберного доступа, при этом датчик позиционируется немного правее средней линии. Для этого исследования часто используется конвексный датчик с частотой от 2 до 5 МГц, хотя также можно использовать микроконвексный или фазированный датчик. При осмотре НПВ оценивается как диаметр сосуда, так и изменения в разные респираторные фазы. Диаметр НПВ измеряется от внутренней стенки до внутренней стенки в передне-заднем направлении, либо каудальнее слияния НПВ с печеночными венами, либо на 2 – 3 см каудальнее атриокавального соединения (рис. 6).
Рис. 6. НПВ. На подреберной продольной проекции сердца показана НПВ (IVC) с измерением диаметра.
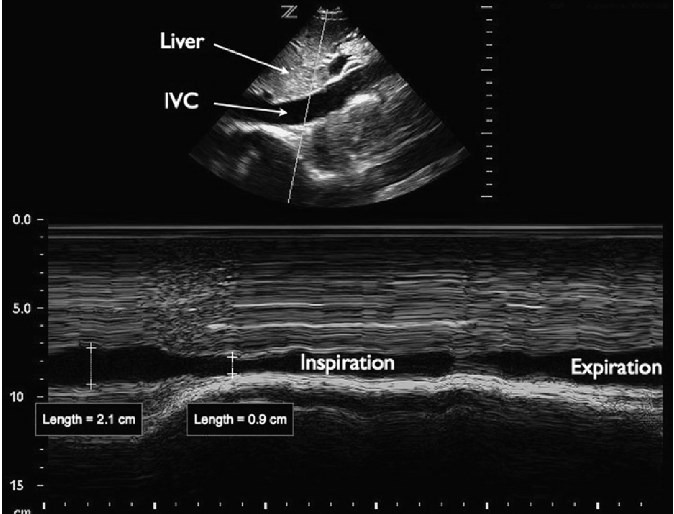
НПВ имеет динамический диаметр, который изменяется в зависимости от фазы дыхательного цикла. У спонтанно дышащего пациента отрицательное внутриплевральное давление при вдохе выталкивает кровь из внегрудного отдела НПВ в грудную клетку. В результате диаметр НПВ наибольший во время выдоха (НПВе) и проявляет разную степень сужения во время вдоха (НПВi). Для определения степени сужения НПВ пациента дополнительно попросят «пошмыгать» носом или вдохнуть с силой (так называемый нюхательный тест – sniff test), конечно, когда может выполнять команды. Процентная доля сужения диаметра НПВ во время вдоха было названо кавальным индексом: (НПВе – НПВi)/НПВе). Визуализация относительного размера НПВ во время дыхательных циклов может быть облегчена с помощью ультразвукового исследования в M-режиме (рис. 7).
Рис. 7. НПВ в М-режиме. На подреберной продольной проекции сердца показана НПВ, которая отображается в M-режиме во время вдоха.
Во многих исследованиях оценивали корреляцию диаметра НПВ и кавального индекса к внутрисосудистому объему, который часто оценивается по данным измерений центрального венозного давления (ЦВД) – часто используемый, однако несовершенный показатель уровня объема. Было показано, что абсолютный диаметр НПВ уменьшается в ответ на снижение внутрисосудистого объема и это может использоваться для наблюдения за относительным объемом циркулирующей крови, подобно измерениям ЦВД. Тем не менее, значительная вариация исходного диаметра НПВ от индивидуума к индивидууму ограничивает значимость изолированных измерений диаметра НПВ. Для сравнения, изменение диаметра НПВ при дыхании имеет лучшее прогнозирующее значение для оценки давления заполнения правого желудочка, чем статические измерения НПВ. Сужение НПВ более 50% при вдохе (кавальный индекс > 0,5) прогнозирует ЦВД менее 10 мм рт. ст. Наоборот, сужения НПВ менее 50% (кавальный индекс
Таблицы, сопоставляющие измерения НПВ с различными диапазонами ЦВД (0-5, 5-10, 10-15 и 15- 20 мм рт. ст.) обычно включаются в учебники по данной теме, хотя данные, поддерживающие такую точную взаимосвязь, не достаточно подтверждены. Хотя индивидуальный диаметр НПВ и кавальный индекс иногда не совсем точно соответствуют конкретным числовым значениям ЦВД, они могут эффективнее использоваться для прогнозирования пограничных значений гиповолемии и перегрузки объемом (табл. 1).
Таблица 1. Результаты измерений НПВ при пограничных уровнях уменьшения объема и объемной перегрузки.