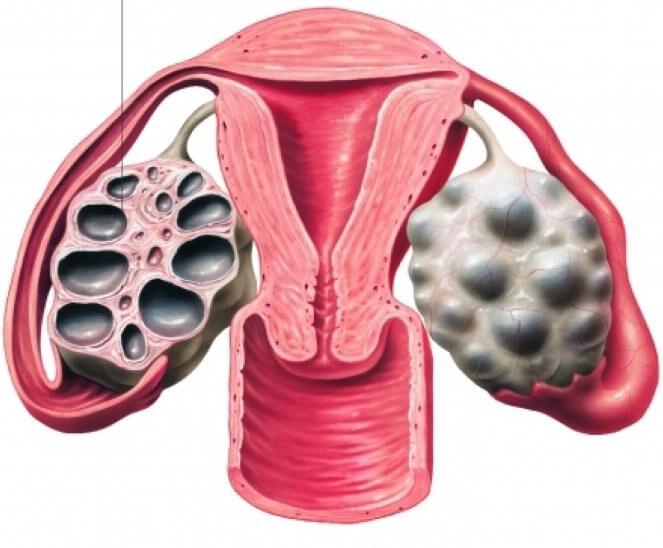
два доминантных фолликула в одном яичнике что это значит
(по материалам практических руководств Американского общества Репродуктивной медицины (ASRM, 2012), Европейского общества репродуктологов и эмбриологов (ESHRE, 2012) и собственным научно-клиническим данным (2010-2012) и видеоматериалам)
Способна ли я зачать здорового ребенка? Каковы мои шансы? В последнее время возраст женщины, планирующей беременность, растет, и по поводу бесплодия обращаются женщины старше 35 лет. Очень важным вопросом при работе с супружеской парой среднего и позднего репродуктивного возраста является оценка ресурса яичников в отношении продукции яйцеклеток.
По сути дела, овариальный резерв – это показатель, который характеризует как наличие яйцеклеток в яичнике, так и, косвенно, их полноценность.
Низкий овариальный резерв может быть обусловлен, как уменьшением количества ооцитов, так и их качества.
Точная оценка овариального резерва уже давно была ключевой задачей в области репродуктивной медицины.
Достоверно известно, что во время внутриутробного развития происходит закладка нескольких миллионов «начальных» (примордиальных) фолликулов. До момента начала репродуктивного периода у девочек их яичники находятся в «спящем» состоянии. В 10-13 лет они «просыпаются», начиная вырабатывать гормоны, формируя менструальный цикл. Каждый месяц то в одном, то в другом яичнике начинают расти фолликулы, но, как правило, только один становится доминантным. Именно в нем созревает яйцеклетка и происходит овуляция.
В среднем за время репродуктивного периода у женщины происходит 400-450 овуляций, остальные фолликулы рассасываются, так и не успев вырасти.
В программах ЭКО, под действие сильных гормональных препаратов, добиваются суперовуляции, когда в яичниках созревают до 20 фолликулов одномоментно.
Существует теория, что у млекопитающих в яичниках, есть стволовые клетки, которые способны к неогенезу и формированию новых примордиальных фолликулов в течение всей жизни. Но эта теория, пока не нашла достоверного подтверждения.
В мировом научном обществе термин «снижение овариального резерва» означает уменьшение количества и качества яйцеклеток у женщин с регулярными менструальным циклом, по сравнению с их возрастной группой а также снижение ответа яичников при стимуляции овуляции. Не стоит путать СОР с менопаузой, физиологическим «выключением» яичников или преждевременным истощением яичников, когда полностью прекращается менструальная функция.
В настоящее время ученые не могут понять, связан ли низкий овариальный резерв с более быстрой атрезией фолликулов при нормальном их количестве или изначально малом их формированием во внутриутробном развитии.
Причины снижения овариального резерва
Причинами СОР могут быть как физиологические изменения, так и патологические состояния.
К физиологическим причинам в первую очередь относят возраст женщины. Доказано, что с возрастом число как рассасывающихся фолликулов, так и фолликулов небольшого размера, увеличивается, а значит быстрее уменьшается запас примордиальных фолликулов, что, конечно же, уменьшает возможность получить достаточное количество полноценных яйцеклеток при ЭКО.
Особую роль в снижении овариального резерва играют генетические и аутоммунные факторы. Это те случаи, когда, несмотря на молодой возраст, яичники не способны продуцировать нормальные яйцеклетки. В ряде исследований показана роль мутаций в определенных генах, а также наличие антиовариальных антител в плохом ответе яичников на стимуляцию. Получается, что организм как бы борется со своими яичниками, вырабатывая защитные вещества, «убивая» жизнеспособные яйцеклетки. Причины подобных генетических нарушений пока не известны.
К патологическим причинам снижения овариального резерва относятся:
Интересно, что многие химические вещества, используемые в промышленности и сельском хозяйстве, негативно сказываются на работе яичников. Подобно эстрогенам организма женщины они связываются с их рецепторами, блокируя и нарушая гормональную активность яичников. Не последнюю роль в работе яичников и снижении овариального резерва играет курение. По последним исследованиям, у курящих женщин ответ на стимуляцию яичников в несколько раз ниже, чем у некурящих.
Диагностика состояния овариального резерва
Исследование овариального резерва проводят по нескольким критериям:
К биохимическим маркерам относят уровень ФСГ, антимюллерового гормона (АМГ), эстрадиола. К ультразвуковым – количество антральных фолликулов.
Наибольшее значение в последние годы играет уровень антимюллерового гормона (АМГ).
Уникальность этого гормона состоит в том, что он вырабатывается гранулезой преантральных фолликулов, то есть непосредственно в яичниках. Его уровень начинает расти вместе с ростом фолликула и снижается, когда фолликул становиться более 8 мм и переходит в доминантный.
Именно с этим связаны рекомендации о том, что исследование содержания этого гормона необходимо проводить на 2-3 дни цикла.
Наибольшее применение АМГ получил в программах экстракорпорального оплодотворения.
По данным литературы, низкий уровень АМГ сочетается (но не всегда предопределяет) с «бедным» ответом яичников на проводимую стимуляцию овуляции, низким качеством яйцеклеток и сниженным количеством успешных беременностей в результате проведения ЭКО.
Довольно часто женщинам с низким АМГ отказывают в стимуляции, предлагая донорские программы. Это связано с тем фактом, что при уровне АМГ от 0,2 до 0,7 нг/мл получают в среднем до 3 фолликулов и получают яйцеклетки всего в 2-4 % случаев (специфичность исследования 78-92% и чувствительность 40-97%).
Тем не менее, исследования зарубежных специалистов доказывают, что не следует так категорично подходить к этому вопросу. По данным этого исследования у женщин с АМГ от 0,16 до 0,5 нг/мл, средний возраст которых составлял 39,3 года, в процессе стимуляции получали до 6 яйцеклеток и почти в 26% случаев наступила беременность. Но, что более удивительно, у женщин с АМГ менее 0,16 нг/мл, средний возраст которых составлял 40,2 года, получали до 4 яйцеклеток и беременность наступила в 19% случаев.
Поэтому, несмотря на большее значение АМГ при бесплодии в программах ЭКО, не стоит оценивать ситуацию только основываясь на его показателях.
По-прежнему немаловажную роль в качестве маркеров овариального резерва играют ФСГ и эстрадиол. По данным ВОЗ возможно прогнозировать слабый ответ яичников на стимуляцию (не более 2-3 фолликулов) при значениях ФСГ более 10 МЕ/л (специфичность от 80 до 100%), в то время как чувствительность может варьировать от 10 до 80%.
Наличие нормального показателя базального ФСГ при уровне эстрадиола не более 60-80 пг/мл также ассоциируют со снижением овариального резерва и низкой частотой наступления беременности.
Это исследование проводится в раннюю фолликулярную стадию, при этом подсчитывается количество фолликулов в размере от 2-10 мм в обоих ячниках. Этот метод имеет хорошую специфичность от 70-100%, но низкую чувствительность: 9-70% даже при низких показателях (не более 3-4 фолликулов в обоих яичниках).
Учитывая данные о состоянии овариального резерва в программах вспомогательных репродуктивных технологий при бесплодии проводится индивидуальный подбор протокола в каждом случае.
Дискуссионные вопросы тактики ведения пациенток с бесплодием и кистами яичников
До сих пор ведутся дискуссии по поводу проведения программы ЭКО при наличии кист яичников. Согласно рекомендациям Европейского общества репродуктологов и эмбриологов возможно проведение программ вспомогательных репродуктивных технологий при наличии эндометриоидных кист яичников не более 2-3см. В данном случае идет речь только об этом типе кист (эндометриомы), поскольку подозрение при УЗИ на кистому, особенно неоднородной структуры, обязательным является проведение гистологического исследования.
С одной стороны киста сама по себе уменьшает овариальный резерв, постепенно «поглощая» здоровую ткань яичника. К тому же ни один врач не даст 100% ответа о природе кисты (не даст гарантии, что киста не является злокачественной), пока её не удалят и не проведут гистологическое исследование, а также не предскажет, как она себя поведет во время приема больших доз гормональных препаратов во время стимуляции.
Но, к сожалению, у некоторых женщин нет времени ждать, пока яичники «реанимируются» после операции. В силу возраста или перенесенных ранее оперативных вмешательств на яичниках у такой группы больных овариальный резерв снижен. Такие ситуации очень сложны для репродуктологов, т.к. им необходимо учесть множество факторов: возраст женщины, размеры кисты, одно- или двустороннее их расположение и оценить насколько риск удаления кисты и повреждения яичника выше риска неудачи ЭКО или злокачественного перерождения образования после стимуляции.
Появление новых технологий и энергий, используемых во время операций, значительно помогает решить эту задачу. В частности, в последние годы нами и зарубежными коллегами доказано щадящее воздействие аргоноплазменной коагуляции на ткань яичника при удалении кист яичника, положительное влияние на состояние овариального резерва, а также улучшение отдаленных результатов (восстановление овуляции и наступление беременности как естественной, так и в программах ЭКО).
Основными преимуществами арогоноплазменной коагуляции являются:
В видеопримере ниже показан этап обработки ложа удаленной кисты с использованием современного вида энергии: аргоноплазменной коагуляции. Через 2 месяца в этом яичнике у пациентки произошла первая овуляция.
Данный вид энергии используется также при проведении лапароскопии по поводу наружного генитального эндометриоза, ретроцервикального эндометриоза, при обработке ложа удаленных миоматозных узлов, при лечении шейки матки и ряде других заболеваний в гинекологии.
В зависимости от стадии наружного генитального эндометриоза, вида кист яичников нами разработаны и апробированы протоколы, применение которых обеспечивает щадящий деструктивный эффект.
И не следует отчаиваться при «плохих» результатах предоперационного обследования, т.к. снижение овариального резерва ещё не означает неспособность к зачатию и рождению здорового малыша.
Основная используемая литература:
«Запас яйцеклеток» для поздней беременности
Поделиться:
Если вы читали предыдущую статью о проблемах зачатия в возрасте «за 40», то, возможно, у вас возник вопрос: «Неужели все так фатально? Может быть, есть шанс сэкономить яйцеклетки и продлить их продуктивный век?». На этот счет ходят разные догадки, и сейчас мы разберемся, какие из них верны, а какие нет.
Миф об экономии яйцеклеток
Я достаточно часто сталкиваюсь с убеждением, что женщины, принимающие оральные контрацептивы, экономят яйцеклетки. Казалось бы, все сходится: контрацептивы подавляют овуляции, значит, яйцеклетки не расходуются и ждут своего шанса. Признаюсь, это было бы великолепно, но, увы, это не правда.
Дело в том, что начальные фазы роста и созревания фолликулов совершенно не зависят от гормонов и происходят непрерывно, начиная с внутриутробного периода. Современные противозачаточные таблетки способны лишь не допустить активного роста фолликула до лидирующего состояния и заблокировать овуляцию. Все остальные фолликулы (большинство) точно так же подвергаются регрессу и больше не смогут принимать участие в репродуктивных процессах.
Более того, до сих пор среди исследователей и ученых случаются споры о том, что длительный прием КОК может привести к угнетению резерва ооцитов в яичниках. Действительно, у пациенток, длительно принимающих КОК, яичники уменьшаются в размерах. Однако подобные эффекты обратимы, а для оценки истинного состояния яичников следует проводить исследования не ранее чем через 3 месяца после прекращения гормональной контрацепции.
КОК и сохранение фертильности
Тем не менее гормональные контрацептивы вносят свой вклад в сохранение фертильности. Нет нежелательных беременностей — нет абортов, а значит, нет травмы эндометрия и хронического эндометрита. Нет циклических колебаний гормонального фона — нет сбоев и поломок, нет образования кист, а значит, нет необходимости в операциях по поводу апоплексии или кисты яичника.
Сгущение цервикальной слизи, характерное для эстроген-гестагенных контрацептивов, не позволяет инфекционным агентам проникать в матку и маточные трубы и вызывать воспалительные процессы. А значит, вероятность трубно-перитонеального бесплодия стремится к нулю.
Эффект отмены (rebound effect)
Способность гормональных контрацептивов ускорить наступление беременности хорошо известна. Безусловно, это далеко не 100%-ный способ, но после отмены КОК в первые 4 цикла благополучно беременеет 60 % женщин.
Считается, что во время приема контрацептивов в яичниках накапливается группа вторичных фолликулов, готовых ринуться «в бой», как только поступит команда. При этом действительно могут возникнуть условия для одновременного созревания нескольких доминантных фолликулов и незначительно повышается вероятность многоплодной беременности.
Оценка овариального резерва
Если проблема отложенного материнства для вас актуальна, то в первую очередь стоит побеспокоиться и сдать определенные анализы женщинам:
Для того чтобы приблизительно оценить сохранность запасов яйцеклеток в яичниках, врачи определяют уровень АМГ (антимюллерового гормона) и используют УЗИ. Кровь на АМГ следует сдать на 3–5-й дни менструального цикла натощак, за 24 часа исключив прием гормональных препаратов.
УЗИ для оценки овариального резерва делают прямо во время менструации — на 2–5-й день цикла. Врач измерит длину, ширину и толщину яичников для определения их объема и подсчитает количество видимых фолликулов в каждом яичнике. Считается нормальным, если в этот период в яичниках находится от 5 до 15 фолликулов диаметром 2–5 мм. Если фолликулов меньше 5, а объем яичника меньше 3 кубических сантиметров, то речь идет о снижении пула годных яйцеклеток.
Отложить про запас
Эффективность процедуры зависит от возраста женщины в момент извлечения яйцеклетки. По данным за 2014 год, в США благополучная имплантация происходит в 43 % случаев, если яйцеклетка извлечена до 35 лет, однако после 35 шансы тают буквально на глазах, в итоге при криоконсервации яйцеклеток у женщин старше 40 лет вероятность успеха стремится к нулю. В то же время женщины, прошедшие процедуру до 30, имеют шансы никогда не воспользоваться «запасом», самостоятельно родив всех желанных детей.
Еще одним возможным методом сохранения фертильности является заморозка части яичника. Это позволяет сохранить большое количество ооцитов в первичных фолликулах без стимуляции яичников, но требует хирургического вмешательства для получения фрагментов тканей. Такой вариант чаще всего предлагают молодым женщинам перед началом химиотерапии или лучевой терапии.
Сейчас криоконсервация ооцитов практически не уступает в эффективности заморозке эмбрионов 2 и, безусловно, предпочтительнее для женщин, которые не определились с выбором отца для будущего ребенка. Исследователи считают, что программы криоконсервации могут стать наиболее востребованной обществом «страховкой» от бесплодия, связанного с поздней реализацией репродуктивных планов. Так это или нет — покажет время.
1 Wilson C, Check JH, Summers-Chase D. Successful pregnancies from embryos cryopreserved more than ten years: two case reports // Clin Exp Obstet Gynecol. 2006; 33(2): 79.
2 Ho JR, Woo I, Louie K et al. A comparison of live birth rates and perinatal outcomes between cryopreserved oocytes and cryopreserved embryos // J Assist Reprod Genet. 2017; 34(10): 1359. Epub 2017 Jul 17.
Синдром поликистозных яичников или мультифолликулярные яичники
Врачи на УЗИ нередко видят достаточно типичную картину, которую называют мультифолликулярными яичниками. Для некоторых пациенток мультифолликулярные яичники — синоним поликистоза, при котором также много фолликулов. Между тем, это совершенно разные понятия.
Для начала опишем УЗИ-картину яичников при поликистозе:
Однако описанная картина иногда бывает лишь ошибочно похожа на поликистозные яичники. Например, весьма похожая картина может быть в 1 фазе цикла (на 5-7 день) вследствие чисто физиологических изменений, которые естественно протекают в половой системе женщины. Кроме того, подобные изменения бывают у женщин на фоне длительного приема оральных контрацептивов, в рамках гипогонадотропной аменореи и, наконец, у девушек в периоде полового созревания.
Таким образом, мультифолликулярные яичники — лишь ультразвуковой симптом менструального цикла в рамках нормы. Однако, учитывая, что картина может быть нечеткой, что есть определенные варианты течения поликистоза яичников, при выявлении картины мультифолликулярных яичников необходимо провести дифференциальную диагностику. Для этого исследуют содержание в крови ЛГ и ФСГ, тестостерона, инсулина. При мультифолликулярных яичниках уровень этих гормонов находится в пределах нормы. А при поликистозе яичников соотношение ЛГ/ФСГ больше 2,5-3, увеличен уровень общего и свободного тестостерона, а также инсулина. Кроме того, о наличии поликистозных яичников свидетельствует также и клиническая картина заболевания.
То же относится и к девушкам периода полового созревания, у которых состояние называют также «формирующийся синдром поликистозных яичников». У них специфическую ультразвуковую картину сопровождают специфические гормональные и внешние изменения.
Таким образом, мультифолликулярные яичники — диагноз не заболевания, а определенного состояния, которое само по себе не является причиной бесплодия, нарушений менструального цикла и т.д. Но проводить дифференциальный диагноз с более тяжелыми состояниями все-таки необходимо.
Для дифференциальной диагностики мультифолликулярных и поликистозных яичников можно использовать следующие признаки:
Часто мультифолликулярные яичники принимают за поликистозные яичники, однако мультифолликулярные яичники следует рассматривать как вариант нормы, а поликистоз яичников — заболевание.
Женские половые органы – яичники, маточные трубы, матка, подвержены изменениям в зависимости от фазы менструального цикла. В начале менструального цикла в яичниках начинают созревать 5-7 фолликулов, но дозревает только один из них. При картине мультифолликулярных яичников одновременно дозревают более 7 фолликулов. Мультифолликулярные яичники часто встречаются в начале полового созревания, когда только устанавливается менструальная функция, у женщин длительно принимающих пероральные контрацептивы, а также на 5-7 день нормального менструального цикла. Иногда синдром мультифолликулярныхяичников может сопровождаться нарушениями менструального цикла, чаще всего это связано с недостаточностью лютеинизирующего гормона, что может быть вызвано резкой потерей веса, или наоборот его набором. При этом может наблюдаться аменорея или олигоменорея. Нарушения менструального цикла, сопровождающие мультифолликулярные яичники, может свидетельствовать о начальной стадии поликистоза яичников.
Часто, только лишь по данным УЗИ, бывает сложно отдифференцировать синдром мультифолликулярный яичников от синдрома поликистозных яичников. В таких случаях, необходимо динамическое наблюдение у гинеколога и определение гормонального фона. Однако, есть ряд УЗИ-признаков, отличающих мультифолликулярные яичники от поликистозных. Главным отличительным признаком является размер яичника, при синдроме мультифолликулярных яичников он нормальный, при поликистозных яичниках увеличен. Количество фолликулов при синдроме мультифолликулярных яичников 8-10, диаметр фолликулов 4-8 мм, приполикистозе более 10, диаметр фолликулов более 10 мм. Мультифолликулярные яичники не сопровождаются гормональными нарушениями, в отличии от поликистозных яичников.
Причины СПКЯ
СПКЯ – часто распространенное гормональное расстройство среди женщин репродуктивного возраста, приводящее к стойкому бесплодию. Несмотря на актуальнось проблемы, точные причины возникновения СПКЯ до сих пор неизвестны.
Помимо гормональных причин, к предрасполагающим факторам, ведущим к развитию СПКЯ, относят:
Симптомы СПКЯ
Молочные железы развиты правильно, у каждой третьей женщины имеет место фиброзно-кистозная мастопатия, развивающаяся на фоне хронической ановуляции и гиперэстрогении.
Практически все пациенки с СПКЯ имеют повышенную массу тела. При этом излишки жира откладываются, как правило,на животе (“центральный” тип ожирения). Поскольку уровень инсулина при СПКЯ повышен, довольно часто заболевание сочетается с сахарным диабетом 2 типа. СПКЯ способствует раннему развитию сосудистых заболеваний, таких какгипертоническая болезнь и атеросклероз.
Поскольку симптомов заболевания много, СПКЯ легко можно перепутать с любым дисгормональным нарушением. В молодом возрасте жирную кожу, угри и прыщи принимают за естественные возрастные особенности, а повышенная волосатость и проблемы с лишним весом зачастую воспринимаются как генетические особенности. Поэтому если менструальный цикл не нарушен и женщина еще не пробовала беременеть, то к гинекологу такие пациентки обращаются редко. Важно знать,что любые подобные проявления не являются нормой и при обнаружении у себя подобных симптомов следует очно проконсультироваться у гинеколога-эндокринолога.
Диагностика СПКЯ
Структурные изменения яичников при СПКЯ характеризуются:
Диагностика СПКЯ включает:
После пробы с дексаметазоном содержание андрогенов незначительно снижается, примерно на 25% (за счет надпочечниковой фракции).
Проба с АКТГ отрицательная, что исключает надпочечниковую гиперандрогению, характерную для адреногенитального синдрома. Отмечено также повышение уровня инсулина и снижение ПССГ в крови.
В клинической практике простым и доступным методом определения нарушения толерантности глюкозы к инсулину является сахарная кривая. Определяется сахар крови сначала натощак, затем — в течение 2 ч после приема 75 г глюкозы. Если через 2 ч уровень сахара крови не приходит к исходным цифрам, это свидетельствует о нарушенной толерантности к глюкозе, т. е. об инсулинрезистентности, что требует соответствующего лечения.
Критериями для постановки диагноза СПКЯ являются:
Лечение СПКЯ
Лечение СПКЯ определяется с учетом выраженности симптомов и желанием женщины забеременеть. Обычно начинают с консервативных методов лечения, при неэффективности показано хирургическое лечение.
Если у женщины имеется ожирение, то лечение следует начать с коррекции массы тела. В противном случае консервативное лечение у таких пациенток не всегда дает желаемый результат.
При наличии ожирения проводятся:
Консервативное лечение СПКЯ
При нарушенном углеводном обмене лечение бесплодия начинают с назначения гипогликемических препаратов из группы бигуанидов (Метформин). Препараты корректируют уровень глюкозы в крови, курс лечения составляет 3-6 месяцев, дозы подбирают индивидуально.
Для стимуляции овуляции применяют гормональный препарат-антиэстроген Кломифен-цитрат, который стимулирует выход яйцеклетки из яичника. Препарат применяют на 5-10 день менструального цикла. В среднем, после применения Кломифена овуляция восстанавливается у 60 % пациенток, беременность наступает у 35 %.
При отсутствии эффекта от Кломифена, для стимуляции овуляции применяют гонадотропные гормоны, такие как Пергонал, Хумегон. Стимуляция гормонами должна проводится под строгим контролем гинеколога. Эффективность лечения оценивают при помощи УЗИ и показателей базальной температуры тела. Если женщина не планирует беременность, для лечения СПКЯ назначают комбинированные оральные контрацеативы (КОК) с антиандрогенными свойствами для восстановления менструального цикла.Такими свойствами обладают КОКи Ярина, Диане-35, Жанин, Джес. При недостаточном антиандрогенном эффекте КОКов, возможно совместное применение препаратов с антиандрогенами (Андрокур) с 5 по 15-й день цикла. Лечение проводят с динамическим контролем показателей гормонов в крови. Курс лечения составляет в среднем от 6 месяцев до года.
Высоким антиандрогенным свойством обладает калийсберегающий диуретик Верошпирон, который также используют при поликистозе яичников. Препарат снижает синтез андрогенов и блокирует их действие на организм. Препарат назначают минимум на 6 месяцев.
Стимуляция овуляции при СПКЯ
Кломифен относится к нестероидным синтетическим эстрогенам. Механизм его действия основан на блокаде рецепторов эстрадиола. После отмены кломифена по механизму обратной связи происходит усиление секреции ГнРГ, что нормализует выброс ЛГ и ФСГ и, соответственно, рост и созревание фолликулов в яичнике. Таким образом, кломифен не стимулирует яичники непосредственно, а оказывает воздействие через гипоталамо-гипофизарную систему. Стимуляция овуляции кломифеном начинается с 5-го по 9-й день менструального цикла, по 50 мг в день. При таком режиме повышение уровня гонадртропинов, индуцированное кломифеном, происходит в то время, когда уже завершился выбор доминантного фолликула. Более раннее назначение кломифена может стимулировать развитие множества фолликулов и увеличивает риск многоплодной беременности. При отсутствии овуляции по данным УЗИ и базальной температуры дозу кломифена можно увеличивать в каждом последующем цикле на 50 мг, достигая 200 мг в день. Однако многие клиницисты полагают, что если нет эффекта при назначении 100-150 мг кломифена, то дальнейшее увеличение дозы нецелесообразно. При отсутствии овуляции при максимальной дозе в течение 3 месяцев пациентку можно считать резистентной к кломифену.
Критериями эффективности стимуляции овуляции служат:
При наличии этих показателей рекомендуется введение овуляторной дозы 7500-10000 МЕ человеческого хорионического гонадотропина — чХГ (профази, хорагон, прегнил), после чего овуляция отмечается через 36-48 ч. При лечении кломифеном следует учитывать, что он обладает антиэстрогенными свойствами, уменьшает количество цервикальной слизи («сухая шейка»), что препятствует пенетрации сперматозоидов и тормозит пролиферацию эндометрия и приводит к нарушению имплантации в случае оплодотворения яйцеклетки. С целью устранения этих нежелательных эффектов препарата рекомендуется после окончания приема кломифена принимать натуральные эстрогены в дозе 1-2 мг. или их синтетические аналоги (микрофоллин) с 10-го по 14-й день цикла для повышения проницаемости шеечной слизи и пролиферации эндометрия.
При недостаточности лютеиновой фазы рекомендуется назначить гестагены во вторую фазу цикла с 16-го по 25-й день. При этом предпочтительнее препараты прогестерона (дюфастон, утрожестан).
Частота индукции овуляции при лечении кломифеном составляет примерно 60-65%, наступление беременности — в 32-35% случаев, частота многоплодной беременности, в основном двойней, составляет 5-6%, риск внематочной беременности и самопроизвольных выкидышей не выше, чем в популяции. При отсутствии беременности на фоне овуляторных циклов требуется исключение перитонеальных факторов бесплодия при лапароскопии.
При резистентности к кломифену назначают гонадотропные препараты — прямые стимулятороы овуляции. Используется человеческий менопаузальный гонадотропин (чМГ), приготовленный из мочи женщин постменопаузального возраста. Препараты чМГ содержат ЛГ и ФСГ, по 75 МЕ (пергонал, меногон, менопур и др.). При назначении гонадотропинов пациентка должна быть информирована о риске многоплодной беременности, возможном развитии синдрома гиперстимуляции яичников, а также о высокой стоимости лечения. Лечение должно проводится только после исключения патологии матки и труб, а также мужского фактора бесплодия. В процессе лечения обязательным является трансвагинальный УЗ-мониторинг фолликулогенеза и состояния эндометрия. Овуляция инициируется путем однократного введения чХГ в дозе 7500-10000 МЕ, когда имеется хотя бы один фолликул диаметром 17 мм. При выявлении более 2 фолликулов диаметром более 16 мм. или 4 фолликулов диаметром более 14 мм. введение чХГ нежелательно из-за риска наступления многоплодной беременности.
При стимуляции овуляции гонадотропинами частота наступления беременности повышается до 60%, риск многоплодной беременности составляет 10-25%, внематочной — 2,5-6%, самопроизвольные выкидыши в циклах, закончившихся беременностью, достигают 12-30%, синдром гиперстимуляции яичников наблюдается в 5-6% случаев.
Хирургическое лечение СПКЯ
Несмотря на достаточно высокий эффект при стимуляции овуляции и наступлении беременности, большинство врачей отмечают рецидив клинической симптоматики СПКЯ примерно через 5 лет. Поэтому послебеременности и родов необходима профилактика рецидива СПКЯ, что важно, учитывая риск развития гиперпластических процессов эндометрия. С этой целью наиболее целесообразно назначение КОК, предпочтительнее монофазных (марвелон, фемоден, диане, мерсилон и др.). При плохой переносимости КОК, что бывает при избыточной массе тела, можно рекомендовать гестагены во вторую фазу цикла: дюфастон в дозе 20 мг. с 16-го по 25-й день цикла.
Женщинам, не планирующим беременность, после первого этапа стимуляции овуляции кломифеном, направленного на выявление резервных возможностей репродуктивной системы, также рекомендуется назначение КОК или гестагенов для регуляции цикла, уменьшения гирсутизма и профилактики гиперпластических процессов.
Физиотерапия и фитнесс для лечения СПКЯ
Физиотерапевтические процедуры также показаны при СПКЯ. Применяют гальванофорез лидазы для активации ферментативной системы яичников. Электроды устанавливают в надлобковой области. Курс лечения-15 дней ежедневно.
Лечение поликистоза яичников длительное, требующее тщательного наблюдения у гинеколога-эндокринолога. Всем женщинам с СПКЯ рекомендуется, по возможности, как можно раньше беременеть и рожать, поскольку симптомы заболевания, увы, с возрастом довольно часто прогрессируют.
Вся информация носит ознакомительный характер. Если у вас возникли проблемы со здоровьем, то необходима консультация специалиста.