какая молекула самая легкая чему равна ее относительная молекулярная масса
Молекулы. Химические формулы. Молекулярные массы
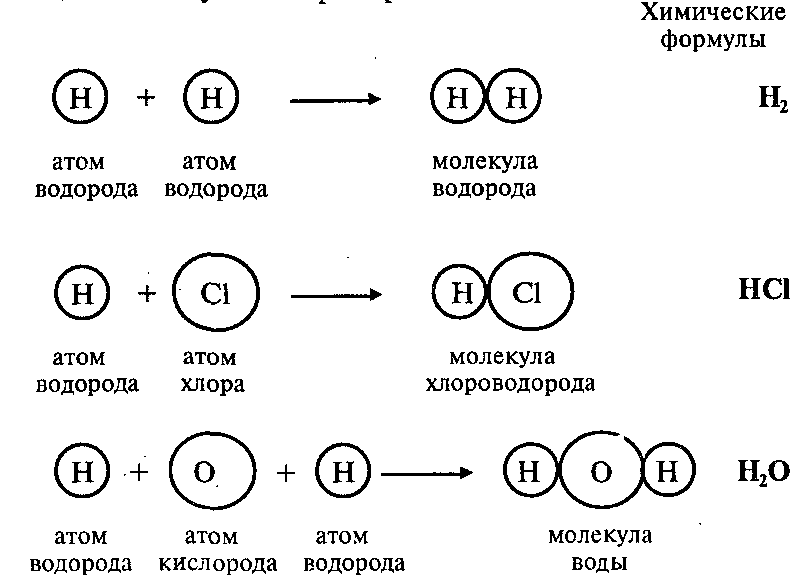
Атомы могут соединяться друг с другом. В результате этого соединения обычно образуются более сложные частицы – молекулы. Например:
Эти примеры показывают, что соединяться друг с другом могут атомы одного элемента и атомы разных элементов. Число атомов, которые соединяются друг с другом, может быть различным.
Состав любой молекулы можно выразить химической формулой.
Так, молекула водорода имеет формулу Н2. Число «2» в этой формуле показывает число атомов водорода в молекуле водорода.
Числа в химических формулах, которые показывают, сколько атомов данного элемента входит в состав молекулы, называются индексами.
Молекула хлороводорода имеет формулу НCl, так как она состоит из одного атома водорода и одного атома хлора. Молекула воды имеет формулу Н2O. Эта формула показывает, что молекула воды состоит из двух атомов водорода и одного атома кислорода.
Молекула серной кислоты состоит из двух атомов водорода Н, одного атома серы S и четырех атомов кислорода О. Значит, формула молекулы серной кислоты — H2SO4.
Существуют молекулы, в состав которых входит несколько одинаковых групп атомов. В формулах таких молекул эти группы атомов заключают в скобки, а индекс за скобками показывает число этих групп в молекуле. Например, формула Cu(NO3)2 показывает, что эта молекула состоит из одного атома меди и двух групп атомов NО3, т. е. двух атомов азота и шести атомов кислорода.
Таким образом, химические формулы доказывают качественный и количественный состав молекулы (из атомов каких элементов состоит молекула и сколько этих атомов в молекуле).
Согласно закону постоянства состава (Ж. Пруст, Франция, 1808 г.): Каждое чистое вещество имеет постоянный качественный и количественный состав, который не зависит от способа получения вещества.
Так как вещество состоит из одинаковых молекул, то состав молекулы определяет состав всего вещества. Различия в химических свойствах веществ обусловлены различиями в составе и строении молекул, из которых состоят эти вещества. Поэтому можно сделать вывод:
Молекула — это наименьшая частица вещества, которая сохраняет его химические свойства.
Масса любой молекулы равна сумме масс образующих ее атомов. Если при расчете массы молекулы используются относительные атомные массы, то получается относительная молекулярная масса, которая обозначается символом Мr.
Например, относительная молекулярная масса воды Н2O равна:
Mr(H2О) = Ar(H) + Аr(Н) + Аr(О) = 2Аr(Н) + Аr(О) =2∙1+16=18;
относительная молекулярная масса сульфата железа (III) Fe2(SO4)3 равна: Mr[Fe2(SO4)3] = 2Ar(Fe) + 3Ar(S) + 12Ar(O) = 2∙56+3∙32+12∙16=400;
Относительная молекулярная масса вещества Мr — это число, которое показывает, во сколько раз абсолютная масса молекулы данного вещества больше 1/12 части абсолютной массы атома углерода С.
Например, относительная молекулярная масса воды Mr(H2О) = 18. Это значит, что масса молекулы воды в 18 раз больше 1/12 части массы атома углерода.
Относительные молекулярные массы, как и относительные атомные массы, являются величинами безразмерными.
По формуле вещества можно рассчитать массовую долю каждого химического элемента, который входит в состав вещества.
Массовая доля (ω) химического элемента в данном веществе равна отношению относительной атомной массы данного элемента, умноженной на число его атомов в молекуле, к относительной молекулярной массе вещества:
где ω(Х) — массовая доля элемента Х; Ar(X) — относительная атомная масса элемента Х; n — число атомов элемента Х в молекуле вещества; Мr — относительная молекулярная масса вещества.
Молекулярная масса: базовые принципы определения
Молекулярная масса – одно из основных понятий в современной химии. Ее ввод стал возможным после научного обоснования утверждения Авогадро о том, что многие вещества состоят из мельчайших частиц – молекул, каждая из которых, в свою очередь, состоит из атомов. Этим суждением наука во многом обязана итальянскому химику Амадео Авогадро, который научно обосновал молекулярное строение веществ и подарил химии многие важнейшие понятия и законы.
Единицы масс элементов
В 1961 году была принята новая шкала относительных атомных масс, эталоном для которой стал изотоп углерода 12 С. Атомная единица массы (сокращенно а.е.м.) составляет 1/12 часть массы этого эталона. В настоящее время атомной массой называют массу атома, которая должна быть выражена в а.е.м.
Масса молекул
Масса молекула любого вещества равна сумме масс всех атомов, образующих данную молекулу. Самая легкая молекулярная масса газа у водорода, его соединение пишется как Н2 и имеет значение, приближенное к двум. Молекула воды состоит из атома кислорода и двух атомов водорода. Значит, ее молекулярная масса равна 15,994 + 2*1.0079=18.0152 а.е.м. Самые большие молекулярные массы имеют сложные органические соединения – белки и аминокислоты. Молекулярная масса структурной единицы белка колеблется от 600 до 10 6 и выше, в зависимости от количества пептидных цепей в этой макромолекулярной структуре.
Одновременно со стандартными единицами массы и объема в химии используется совершенно особая системная единица – моль.
Моль – это количество вещества, которое содержит столько структурных единиц (ионов, атомов, молекул, электронов), столько содержится в 12 граммах изотопа 12 С.
Молярная и молекулярная масса
Масса количества вещества в 1 моль измеряется в г/моль и называется молярной массой. Отношение между молекулярной и молярной массой можно записать в виде уравнения
ν = k × m/M, где к – коэффициент пропорциональности.
Нетрудно сказать, что для любых соотношений коэффициент пропорциональности будет равен единице. Действительно, изотоп углерода имеет относительную молекулярную массу 12 а.е.м, а, согласно определению, молярная масса этого вещества равна 12 г/моль. Отношение молекулярной массы к молярной равно 1. Отсюда можно сделать вывод, что молярная и молекулярная масса имеют одинаковые числовые значения.
Объемы газов
Таким образом, объемы газообразных веществ существенно отличаются от объемов жидких и твердых. Это обусловлено разностью растояний между молекулами веществ в различных агрегатных состояниях.
Нормальные условия
Для нормальных условий принято специальное сокращение – н.у. Иногда в задачах это обозначение не пишется, тогда следует внимательно перечитать условия задачи и привести заданные параметры газа к нормальным условиям.
Расчет объема 1 моля газа
В качестве примера несложно выполнить расчет одного моля любого газа, например азота. Для этого сначала нужно найти значение его относительной молекулярной массы:
Поскольку относительная молекулярная масса вещества численно равна молярной, то M(N2)=28 г/ моль.
Опытным путем выяснено, что при нормальных условиях плотность азота равна 1,25 г/литр.
Подставим это значение в стандартную формулу, известную со школьного курса физики, где:
Получим, что молярный объем азота при нормальных условиях
V(N2)= 25г/моль : 1,25 г/ литр =22,4 л/ моль.
Получается, что один моль азота занимает 22,4 литра.
Если выполнить такую операцию со всеми существующими газовыми веществам, можно прийти к удивительному выводу: объем любого газа при нормальных условиях равен 22,4 литра. Вне зависимости от того, о каком газе идет речь, какова его структура и физико-химические характеристики, один моль этого газа будет занимать объем 22,4 литра.
Молярный объем газа – одна из важнейших констант в химии. Эта постоянная позволяет решить многие химические задачи, связанные с измерением свойств газов при нормальных условиях.
Итоги
Молекулярная масса газообразных веществ важна для определения количества вещества. А если исследователь знает количество вещества того или иного газа, он может определить массу или объем такого газа. Для одной и той же порции газообразного вещества одновременно выполняются условия:
Если убрать постоянную ν, можно уравнять эти два выражения:
Так можно вычислить массу одной порции вещества и его объем, а также становится известной молекулярная масса исследуемого вещества. Применяя эту формулу, можно легко вычислить соотношение объем-масса. При приведении данной формулы к виду M= m Vm/V станет известна молярная масса искомого соединения. Для того чтобы вычислить это значение, достаточно узнать массу и объем исследуемого газа.
Следует помнить, что строгое соответствие реальной молекулярной массы вещества к той, что найдена по формуле, невозможно. Любой газ содержит массу примесей и добавок, которые вносят определенные изменения в его структуру и влияют на определение его массы. Но эти колебания вносят изменения в третью или четвертую цифру после запятой в найденном результате. Поэтому для школьных задач и экспериментов найденные результаты вполне правдоподобны.
Молекулярная масса
п.1. Относительная атомная и молекулярная масса
Массы атомов и молекул, из которых состоят вещества, очень малы. Поэтому их чаще измеряют не в килограммах, а используют внесистемную единицу – атомную единицу массы.
Относительную атомную массу проще всего найти, пользуясь таблицей Менделеева.
Например:
\(A_r(\mathrm
\(A_r(\mathrm
\(A_r(\mathrm
\(A_r(\mathrm
На практике при решении учебных задач относительные атомные массы округляют и единицу измерения а.е.м. не пишут.
п.2. Количество вещества. Постоянная Авогадро
Например:
В 5 молях углерода будет содержаться \(N=5\cdot N_A\approx 6,022\cdot 10^<23>\approx 3,01\cdot 10^<24>\) атомов углерода. Причём, всё равно, будут ли эти атомы углерода образовывать уголь, графит или алмаз.
Аналогично, в 5 молях воды будет \(N=5\cdot N_A\approx 3,01\cdot 10^<24>\) молекул воды. Причём, независимо от того, в каком агрегатном состоянии находится вода: в виде пара, жидкости или льда.
Т.е., «количество вещества» всегда говорит нам о «количестве частиц», независимо от других параметров.
п.3. Молярная масса
Например:
Найдем молярную массу этилового спирта \begin
п.4. Молярный объем
Это свойство газов часто используется при изучении различных веществ и явлений в физике и химии.
п.5. Задачи
Задача 1. Масса кристалла серы равна 16 г. Сколько молекул серы \(\mathrm
Задача 2*. В кислородном генераторе на космическом корабле было получено 1,6 кг кислорода \(\mathrm
Относительная молекулярная масса – формула, примеры, таблица (химия, 8 класс)
Для химиков важно знать массы молекул исследуемых ими веществ. Измерять их в килограммах неудобно, поэтому ученые используют а. е. м. – атомные единицы массы.
Понятие атомной единицы массы
На сегодняшний день принята договоренность, что масса атома углерода (а точнее его изотопа углерод-12) в точности равна 12 а. е. м. По этой причине используемую химиками величину иногда называют углеродной единицей. Ранее ученые использовали другие единицы – водородную и кислородную, но они по ряду причин оказались неудобными. Опыты показывают, что 1 а. е. м. равна примерно 1,66•10 –27 кг.
Атомная масса показывает, какую массу имеет тот или иной атом. Найти ее можно в таблице Менделеева. Обычно в этой таблице масса записана как дробное число, очень близкое к какому-либо целому значению. Например, атомная масса водорода составляет 1,000797 а. е. м., у гелия она равна 4,0026 а. е. м., а у кислорода 15,9994 а. е. м. При решении практических задач принято округлять эти значения до целых чисел. То есть надо считать, что у водорода атомная масса равна 1 а. е. м, у гелия – 4 а. е. м., у кислорода – 16 а. е. м. Исключением является хлор, чью массу округляют до значения 35,5 а. е. м.
Важно понимать, что на самом деле у одного и того же элемента атомы могут иметь различную массу. Такие отличающиеся по массе атомы называются изотопами. У изотопов одного элемента одинаковое количество протонов, но различное количество нейтронов. При этом все изотопы одного элемента имеют одинаковые химические свойства.
В таблице Менделеева указан средний вес всех изотопов, при этом учитывается их распространенность в природе. Например, у кислорода есть три стабильных изотопа:
С учетом этого атомная масса кислорода, указанная в таблице Менделеева, рассчитывается так:
(15,9949•99,759 + 16,9991•0,037 + 17,9991•0,204)/100 = 15,9994 а. е. м.
Молекулярная масса
Зная атомные массы отдельных элементов, можно находить и молекулярные массы молекул. Для этого надо всего лишь сложить атомные массы тех атомов, которые входят в состав молекулы.
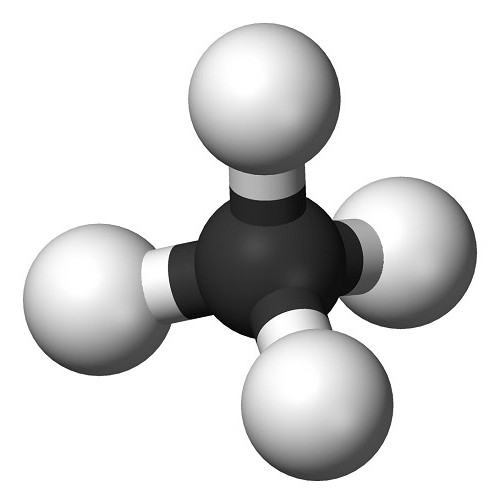
Например, рассмотрим молекулу метана, она имеет формулу СН4, то есть состоит из 1 атома углерода (который весит 12 а. е. м.) и 4 атомов водорода (каждый массой по 1 а. е. м.). Складываем атомные массы:
12 + 1 + 1 + 1 + 1 = 12 + 4•1 = 16 а. е. м.
Итак, молекула метана имеет молекулярную массу 16 а. е. м.
Заметим, что очень часто возникает путаница из-за молекул простых газов – водорода, кислорода, азота и т. д. Дело в том, что их молекулы состоят из двух атомов, поэтому и масса у них вдвое больше, чем масса атомов. Например, атомная масса элемента кислород – 16 а. е. м., а вот молекула кислорода, имеющая формулу О2, весит уже 16•2 = 32 а. е. м.
Молярная масса
Молекулярные массы веществ тесно связаны с понятием молярной массы. Молярная масса – это масса 1 моля вещества. Численно она совпадает с молекулярной массой, но измеряется в других величинах – в граммах на моль, или в г/моль.
Молярная масса позволяет определять, легче или тяжелее воздуха тот или иной газ. Для этого надо лишь сравнить молярную массу газа с молярной массой воздуха, составляющей 28,98 г/моль. Так, кислород оказывается тяжелее воздуха, так как его молярная масса – 32 г/моль. Азот же легче воздуха, ведь его масса равна 28 г/моль. Здесь следует уточнить, что воздух не является отдельным веществом в химическом смысле слова, то есть никаких «молекул воздуха» не существует (поэтому не существует и понятия «молекулярная масса воздуха»). В реальности воздух – это смесь нескольких газов, преимущественно азота и кислорода. При этом более тяжелые молекулы чаще встречаются в нижних слоях атмосферы, а легкие молекулы – на высоте. По этой причине (но отнюдь не только из-за нее) в горах тяжело дышать – на большой высоте воздух содержит меньше кислорода и больше азота.
Подведение итогов
Молекулярная масса показывает, какую массу имеет та или иная молекула. Для ее вычисления достаточно сложить массы входящих в молекулу атомов. Молекулярная масса численно равна молярной массе, и по ней можно оценить, какой газ легче воздуха, а какой – тяжелее.
Какая молекула самая легкая чему равна ее относительная молекулярная масса
Основной характеристикой атомов и молекул служит относительная атомная масса элемента (сокращенно – атомная масса) и относительная молекулярная масса вещества (сокращенно – молекулярная масса). За единицу атомной массы выбрана 
Атомной массой Аr химического элемента называется отношение массы атома этого элемента к 
Молекулярной массой Mr вещества называется отношение массы молекулы этого вещества к 
Как только что было определено, единица массы, равная 
Количество вещества, в котором содержится число молекул, равное числу атомов в 0,012 кг углерода С, называется молем.
Число молекул, содержащихся в одном моле, называется числом Авогадро. Экспериментально определено, что число Авогадро
 . . |
Лоренцо Романо Амедео Карло АВОГАДРО (1776-1856)
Итальянский физик и химик. Родился в Турине в дворянской семье, получил ученую степень доктора церковного права. В 1800 г. начал самостоятельно заниматься математикой и физикой, а спустя шесть лет получил должность профессора в колледже города Верчелли. Затем стал профессором кафедры математической физики Туринского университета. Авогадро был чрезвычайно скромным человеком, работал в одиночестве, и большую часть его жизни достижения Авогадро были неизвестны в научном мире.
Таким образом, в моле любого вещества содержится число Авогадро молекул. Массу моля, выраженную в килограммах, называют молярной массой и обозначают греческой буквой μ. Масса моля равна произведению NA на массу одной молекулы:
 . . |
 . . |
Отсюда
 . . |
Таким образом, масса любого атома равна
 . . |
а любой молекулы –
 . . |
Произведение 
Подставляя это в формулу
 . . |
получим:
 . . |
или
 . . |
Если вещество состоит из молекул, образованных из атомов различных химических элементов, то молекулярная масса данного вещества равна сумме атомных масс элементов, входящих в состав данного вещества. Так молекулярная масса воды Н2О, состоящая из двух атомов водорода и одного атома кислорода, будет равна
 . . |
Возьмем 1 см 3 Н2О. Его масса 1 г. Один моль воды содержит 18 г. Таким образом, 1 см 3 воды содержит 

Таким образом, в жидкой воде на долю одной молекулы приходится объем
 . . |
 . . |
Масса самой легкой молекулы – молекулы водорода Н2 – равна
 . . |
Это очень маленькая величина, однако, масса электрона в тысячи раз меньше.
Чтобы нагляднее представить себе размеры атомов молекул и их количество в определенном объеме вещества, вот два интересных примера:
1) наименьшие размеры частиц, доступные рассмотрению в оптический микроскоп, содержат примерно 10 миллиардов атомов;
2) если все атомы, находящиеся в 1 см 3 меди, расположить в одну линию плотно друг к другу, то длина такой цепочки будет примерно 14 миллиардов километров. Это примерно в 90 раз больше, чем расстояние от Земли до Солнца.