кандида тропикалис чем лечить
Терапия кандидоза
Кандидоз — инфекционное заболевание, обусловленное дрожжеподобными грибами рода Candida. Клинические проявления микоза широко варьируют от поверхностных, слабовыраженных поражений кожи и слизистых оболочек до тяжелых, угрожающих жизни инвазивных висцеральных форм. Диагностика и терапия кандидоза непроста и часто требует привлечения специалистов различного профиля [1, 4, 8].
Число больных поверхностными и глубокими формами кандидоза в последние десятилетия значительно возросло во всех странах мира. Этот факт связывают со снижением естественной иммунной реактивности организма значительной части населения из-за поражения СПИДом, ятрогенных иммунодефицитов, возникающих при химиотерапии онкологических больных, трансплантации органов, вследствие применения глюкокортикоидов, цитостатиков, антиметаболитов, антибиотиков широкого спектра действия, в том числе в отделениях реанимации и интенсивной терапии [4, 8].
Главным возбудителем кандидоза является Candida albicans, которая, как и другие виды грибов Candida, обнаруживается в норме на слизистых и кожных покровах большинства обследованных, но поражает лишь ослабленный организм. Именно в этом кроется сложность проблемы кандидоза.
Природа возбудителя, его взаимоотношения с макроорганизмом, многие аспекты защиты организма от кандидозной инфекции, генетические механизмы резистентности различных видов Candida spp. к основным антимикотикам, применяющимся в лечении кандидоза, подробно изучена. Установлено, что подавляющее большинство штаммов C. albicans, C. tropicalis, C. parapsilosis чувствительны к флуконазолу, однако у ВИЧ-инфицированных и других иммунокомпрометированных больных с инвазивным кандидозом возможна резистентность C. albicans к азольным соединениям. В то же время большинство штаммов C. krusei и часть штаммов C. Glabrata обнаруживают устойчивость к флуконазолу [8].
Адгезия грибов Candida обусловлена их способностью расщеплять секреторный иммуноглобулин А и α-антитрипсин и прикреплять жизнеспособный гриб к протеинам слизистых оболочек за счет гликопротеинадгезина клеточной мембраны гриба. Адгезия гриба к эпителию является основой его инвазии в организм, что происходит уже в первые минуты его взаимодействия со слизистой. Степень адгезии определяет уровень колонизации C. albicans, а степень инвазии — его вирулентность. Грибки продуцируют эндотоксины, гемолизины, дермотоксины, пирогены, протеолитические ферменты, облегчающие адгезию грибковых клеток к ороговевшему эпителию и слизистым оболочкам. Установлено, что у разных штаммов C. albicans способность к продукции этих «факторов агрессии», колонизации и инвазии выражена в различной степени, что должно учитываться при назначении лечения [5, 6]. В «Проекте рекомендаций по лечению кандидоза» указано на важность определения вида возбудителей и их чувствительности к противогрибковым препаратам, даются рекомендации по лечению различных форм инвазивного кандидоза, кандидемии и острого диссеминированного кандидоза — тяжелейших форм кандида-инфекции с высокой летальностью, перечисляются показания к проведению адекватного лечения амфотерицином В и флуконазолом [4]. Замена первого дорогостоящим липосомальным препаратом амбизомом позволяет избежать высокой нефротоксичности амфотерицина В и проводить лечение больных кандидозом с почечной недостаточностью, резистентной к антибиотикам фебрильной нейтропенией, при высоком риске развития острого диссеминированного кандидоза у больных без нейтропении, его органных форм (поражения сердца, сосудов, мочевыводящих путей, желудочно-кишечного тракта). В работе также приводятся рекомендации по лечению кандидоза кожи, ее придатков, хронического кандидоза кожи и слизистых оболочек, профилактике кандидоза у реципиентов трансплантатов органов.
Наиболее полное, систематизированное изложение проблемы кандидоза дано в вышедшей в 2000 году монографии «Кандидоз» [8].
Лечение может быть направлено на предупреждение гиперколонизации организма грибами рода Candida (при назначении антимикотиков широкого спектра действия и иммуносупрессантов). Местные оральные антимикотики — полиены (нистатин, леворин, микогептин) нерастворимы и почти не всасываются из желудочно-кишечного тракта, поэтому редко могут обеспечить элиминацию Candida. Здесь необходимы пероральные препараты системного действия (флуконазол, итраконазол) или препараты для инъекций, такие как флюцитозин, амфотерицин В, амбизом. Если амфотерицин В вследствие его чрезвычайной нефротоксичности назначается при кандидозе в суточной дозе 0,5 мг/кг массы тела, амбизом в 10 раз и более превышает эту дозу и не имеет противопоказаний к назначению [1, 2, 3, 4, 9, 10]. При лечении кандидозов кожи и слизистых оболочек часто используются антимикотики для наружного применения: полиены (леворин, нистатин, натамицин), производные имидазола (кетоконазол, оксиконазол, эконазол, тиоконазол, клотримазол, миконазол, изоконазол, бифоназол, амиказол), триазолы (терконазол), аллиламины (нафтифин, тербинафин), морфолины (аморолфин), прочие препараты (производные унденциленовой кислоты, анилиновые красители и др.).
Одно только перечисление антикандидозных препаратов уже свидетельствует об их множестве и разной степени эффективности, связанной с химической структурой и особенностями фармакокинетики. В частности, наружные средства не всегда создают достаточную концентрацию в подслизистом слое половых путей, глубоких слоях кожи и ее придатках.
В последние годы в России и за рубежом в системной терапии кандидоза с успехом применяется медофлюкон (флуконазол) [2, 3].
Спектр фунгистатического действия флуконазола: Candida albicans, некоторые штаммы Candida nonalbicans (C. guilliermondii, C. pseudotropicalis, C. torulopsis, C. kefyr, C. stellatoidea), Cryptococcus neoformans, Microsporum spp., Trichophyton spp., Blastomyces dermatitidis, Coccidioides immitis, Histoplasma capsulatum.
При пероральном и внутривенном применении фармакокинетика флуконазола сходная. При приеме внутрь биодоступность около 90%. Прием пищи не влияет на абсорбцию препарата. Максимальная концентрация достигается через 0,5 — 1,5 ч. После приема 150 мг она составляет 2,44 — 3,58 мкг/мл. Концентрация в крови прямо пропорциональна принятой дозе. Равновесная концентрация устанавливается к 4 — 5-му дню при приеме 1 раз в сутки. При использовании в первый день двойной дозы она достигается ко второму дню. Связь с белками плазмы 11 — 12%. Объем распределения приближается к общему объему воды в организме. Концентрации флуконазола в слюне, мокроте, суставной и перитонеальной жидкостях, вагинальном секрете, грудном молоке аналогичны таковым в плазме крови. Концентрация в ликворе составляет 50 — 90% (в среднем 70 — 80%) уровня в плазме крови, при менингите — до 93%. В роговом слое кожи, эпидермисе, дерме, потовой жидкости и моче концентрации достигают значений, в 10 раз превышающих концентрацию в плазме крови. Концентрация в роговом слое кожи после 12-дневного применения в дозе 50 мг 1 раз в сутки составляет 73 мкг/г. Концентрация в ногтях после 4-месячного применения в дозе 150 мг 1 раз в неделю составляет 4,05 мкг/г в здоровых и 1,8 мкг/г в пораженных ногтях. Препарат определяется в ногтях в течение 6 месяцев после завершения терапии. Т1/2 27 — 30 ч. Биотрансформации не подвергается. Экскретируется почками, на 80% — в неизмененном виде. Клиренс флуконазола пропорционален клиренсу креатинина. Концентрация флуконазола в плазме крови может быть уменьшена с помощью диализа (на 50% в течение 3 ч).
Медофлюкон применяется внутрь 1 раз в сутки (утром).
Специального подбора доз для пациентов пожилого возраста не требуется, если не угнетена функция почек (клиренс креатинина менее 40 — 50 мл/мин).
У больных с нарушениями функции почек доза должна быть снижена в соответствии со степенью почечной недостаточности.
Пациентам, находящимся на гемодиализе: однократно после каждого сеанса гемодиализа.
Российские авторы [3] приводят собственные данные о применении медофлюкона при различных поражениях, в том числе при висцеральных микозах, обусловленных грибами рода Candida. В частности, опубликованы данные об успешном лечении медофлюконом 9 больных кандидозом кишечника, 11 — полости рта, 3 — пищевода, 18 — вагинальным кандидозом при суточной дозе 50 — 200 мг и длительности курса 14 дней. Отечественные исследователи, оценив эффективность и безопасность препарата, уже в 1996 году назвали медофлюкон безусловным достижением в лечении кандидоза и рекомендовали его для лечения поверхностных и висцеральных форм микоза не только в стационаре, но и в амбулаторных условиях.
К такому же выводу пришли и авторы, проводившие исследования медофлюкона в Московском центре глубоких микозов [2]. По их данным, из 79 больных кандидозным бронхитом, получавших в течение 2 недель 100 — 400 мг медофлюкона в сутки, излечено 74,7%, улучшение наступило у 22,8%, при кандидозной пневмонии выздоровело 66,75%, улучшение отмечено у 33,3%, эрадикация возбудителя — в 97,5 — 100%.
В дерматовенерологии медофлюкон наиболее часто применяется при лечении урогенитальных кандидозов, кандидоза слизистой оболочки полости рта, онихомикозах [4, 6, 7, 8].
Данные, приведенные из литературы, и наш опыт применения медофлюкона при кандидозном вульвовагините и онихомикозе свидетельствуют о его высокой эффективности, хорошей переносимости и безопасности, что делает флуконазол препаратом выбора при лечении различных форм кандидоза слизистых оболочек, кожных покровов и внутренних органов.
В. М. Лещенко, доктор медицинских наук, профессор
Городской микологический центр, Москва
Средства для лечения кандидозов (ч. 2)
Синтетические противогрибковые препараты для наружного применения имеют имеют широкий спектр действия.
Преферанская Нина Германовна
Доцент кафедры фармакологии института фармации им. А.П. Нелюбина Первого МГМУ им. И.М. Сеченова (Сеченовский университет), к.фарм.н.
СИНТЕТИЧЕСКИЕ ПРОТИВОГРИБКОВЫЕ ПРЕПАРАТЫ
Клотримазол (Clotrimazolum), мазь 20 г и 30 г, 1% гель и крем — туба 20 г; табл. вагин. 100 мг — ТН «Кандид» — противогрибковое средство, широкого спектра действия, для наружного применения. Антимикотический эффект Клотримазола связан с нарушением синтеза эргостерола, входящего в состав клеточной мембраны грибов, что изменяет проницаемость цитоплазматической мембраны и вызывает последующий лизис клетки. В малых концентрациях действует фунгистатически, в больших — фунгицидно, причем не только на пролиферирующие клетки. В фунгицидных концентрациях взаимодействует с митохондриальными и пероксидазными ферментами, в результате чего происходит увеличение концентрации перекиси водорода до токсического уровня, что также способствует разрушению грибковых клеток.
Препарат проявляет фунгицидную и фунгистатическую активность в отношении дрожжеподобных и плесневых грибов (Candida spp., включая Candida albicans; Torulopsis glabrata, рода Rhodotorula, Pityrosporum orbiculare). Первично резистентные варианты чувствительных грибов встречаются очень редко. Развитие вторичной резистентности у чувствительных грибов также отмечается в исключительных случаях. При наружном применении после нанесения Клотримазола на интактную или воспаленную кожу он плохо всасывается через кожу и практически не оказывает системного действия. Дозу, способ и схему применения определяют индивидуально, в зависимости от показаний, возраста пациента и применяемой лекарственной формы.
Важно! При применении Клотримазола могут наблюдаться аллергические реакции: сыпь, зуд, волдыри, жжение, раздражение. Противопоказан при повышенной чувствительности к клотримазолу, при беременности и кормлении грудью. При появлении аллергических реакций или раздражения в месте нанесения средства лечение прекращают.
Сертаконазол (Sertaconazolum), 2% р-р 15 мл д/наружн. прим; суппоз. 300 мг; 2% крем, туба 20 г — ТН «Залаин», «Офломикол» — противогрибковое средство, хлорированное производное имидазола и бензотиофена. Механизм действия заключается в подавлении синтеза эргостерола, основного компонента мембран грибковых клеток и в конкурентном антагонизме с другим компонентом клеточной стенки — триптофаном. Это ведет к дезорганизации и увеличению проницаемости клеточной мембраны, деструкции и уничтожению патогенного гриба.
В терапевтических дозах оказывает фунгицидное и фунгистатическое действие. Обладает широким спектром действия в отношении патогенных грибов (Candida spp., в т.ч. Candida albicans, Candida tropicalis) и других патогенных грибов (Pityrosporum orbiculare, Malassezia spp.), а также дерматофитов (Trichophyton и Microsporum), грамположительных бактерий (Streptococcus spp., Staphylococcus spp.), а также Gardnerella vaginalis, Enterococcus faecalis, Bacteroides spp., Trichomonas vaginalis.
Сертаконазол не подавляет жизнеспособность Lactobacillus spp. in vitro.
Показаниями для его применения служат поверхностные микозы кожи, микозы голеней, стоп и кистей; микозы туловища; кандидоз; кандидозный вульвовагинит, разноцветный (отрубевидный) лишай; себорейный дерматит.
Вводят препарат интравагинально, однократно. В период лечения рекомендуется воздерживаться от половых контактов. Не рекомендуется использование кислотных моющих средств, т.к. кислая среда способствует размножению грибов рода Candida.
При применении препарата может возникать местная эритематозная реакция, ощущение жжения, зуд во влагалище, которые проходят самостоятельно во время лечения и не требуют отмены препарата.
Важно! Противопоказанием к применению Сертаконазола служит повышенная чувствительность к производным имидазола, бензотиофена и другим компонентам препарата, при беременности и кормлении грудью.
Миконазол (Miconazolum), 2% крем, туба 15 г — ТН «Микозон» — является хлорированным производным имидазола. Препарат ингибирует биосинтез эргостерола и изменяет липидный состав мембраны, вызывая гибель клетки гриба. Активен в отношении возбудителя разноцветного лишая Malassezia furfur, возбудителей некоторых дерматомикозов(Candida, Trichophyton, Epidermophyton floccosum, Microsporum). Проявляет активность в отношении Aspergillus spp., Dimorphons fungi, Cryptococcus neoformans, Pityrosporum, Torulopsis glabrata, Pseudallescheria boydii. Применяют Миконазол при заболеваниях кожи, вызванных грибами, чувствительными к нему, при кандидоз е слизистой полости рта, глотки и ЖКТ, вагинальных и вульвовагинальных кандидоз ах.
Применяют препарат местно, нанося на пораженные участки кожи 2 раза в день, утром и вечером, мягко втирая крем, возможная реакция — раздражение кожи, контактный дерматит. Дозу устанавливают в зависимости от показаний к применению данной лекарственной формы. Продолжительность курса лечения зависит от вида грибкового заболевания, эффективности лечения и результатов микологических тестов.
Важно! Препарат не рекомендуется применять при беременности и в период лактации.
Важно! При беременности следует применять только после консультации с врачом, в тех случаях, когда предполагаемая польза для матери превышает потенциальный риск для плода. В период лечения необходимо решить вопрос о прекращении грудного вскармливания.
Бутоконазол (Butoconazolum) 2% крем вагин., аппликатор 5 г — ТН «Гинофорт» — является производным имидазола, оказывает противогрибковое действие, блокирует в клеточной мембране гриба образование эргостерола из ланостерола, повышает проницаемость мембраны, что приводит к лизису клетки гриба. Препарат обладает фунгицидной активностью против грибов типа Candida, Trichophyton, Microsporum, Eridermaphyton и некоторых грамположительных бактерий; наиболее эффективен при кандидозах — при интравагинальном применении один аппликатор вводится во влагалище в любое время суток. Бутоконазол находится на слизистой влагалища, в течение 4–5 дней.
При применении препарата могут возникать жжение, зуд, болезненность и отек стенки влагалища, боли/спазмы в нижней части живота.
Фентиконазол (Fenticonazolum) — капс. вагин. 600 мг и 1000 мг, 2% крем вагин. — 30 г и 78 г — ТН «Ломексин» — является хлорированным производным имидазола с противогрибковым действием — ингибирует синтез эргостерола, нарушая проницаемость клеточной стенки гриба. Препарат активен в отношении Candida spp. (включая Candida albicans) и грамположительных бактерий (Staphylococcus aureus, Streptococcus spp.), а также в отношении Trichomonas vaginalis. В отличие от других известных азольных соединений препарат показан при вульвовагинальном кандидоз е, вагинальном трихомониазе; интравагинально 1–2 раза/сут. в течение 3–6 дней.
Важно! Не применять препарат во время менструации. Курс лечения целесообразно начинать после ее окончания. Применение в I триместре беременности противопоказано.
Итраконазол (Itraconazolum), капс. 100 мг, табл. вагин. 200 мг, р-р 10 мг/мл —150 мл — ТН «Орунгал», «Румикоз» — является синтетическим производным триазола, механизм действия которого заключается в ингибировании биосинтеза эргостерола — основного компонента клеточной мембраны гриба, участвующего в поддержании структурной целостности мембраны. Нарушение синтеза эргостерола приводит к изменению проницаемости мембраны и лизису клетки, что и обуславливает противогрибковый эффект препарата. Активен в отношении дерматофитов. Некоторые штаммы могут быть устойчивы: Candidaglabrata, Candidakrusei, Candidatropicalis, Absidiaspp., Fusariumspp., Mucorspp., Rhizomucorspp., Rhizopusspp., Scedosporiumproliferans, Scopulariopsisspp.
Эффективность лечения при микозах оценивается через 2–4 недели после прекращения терапии. Терапевтическая концентрация итраконазола в коже сохраняется в течение 2–4 недель после прекращения 4–недельного курса лечения.
Препарат применяют при вульвовагинальном кандидозе; дерматомикозе, разноцветном лишае, кандидозе слизистой оболочки полости рта, кератомикозе; онихомикозе, вызванный дерматофитами или дрожжеподобным грибами, а также при системных микозах — системный аспергиллез или кандидоз, криптококкоз (в т.ч. криптококковый менингит) у иммунокомпрометированных лиц и криптококкоз центральной нервной системы, бластомикозе, споротрихозе, паракокцидиоидозе, прочие редко встречающиеся системные и тропические микозы.
Важно! При применении препарата могут возникать побочные эффекты: диспептические расстройства, токсическое поражение печени, аллергические реакции, головная боль, головокружение и др. Какого–либо специфического антидота для Итраконазола не существует.
Флуконазол (Fluconazolum) капс. 50 г и 150 г; р-р д/в/в. инфуз. 2 мг/мл — 50 мл, 100 мл и 150 мл — ТН «Дифлюкан», «Флюкостат», «Микосист» — является производным триазола, мощным селективным ингибитором синтеза стеролов в клетке грибов.
Флуконазол активен в отношении большинства микроорганизмов: Candida albicans, Candida glabrata (многие штаммы умеренно чувствительны), Candida parapsilosis, Candida tropicalis, Cryptococcus neoformans.
Препарат имеет большой спектр применения (см. инструкцию).
Режим дозирования индивидуальный. Длительность лечения зависит от клинического и микологического эффекта. Длительный период полувыведения из плазмы крови позволяет принимать флуконазол при вагинальном кандидозе однократно 1 раз/сут. или 1 раз/нед. — при других показаниях. Флуконазол хорошо проникает во все жидкости организма. Уровни флуконазола в слюне и мокроте сходны с его концентрациями в плазме крови. Флуконазол обладает высокой специфичностью в отношении грибковых ферментов, зависимых от цитохрома Р450, что может сопровождаться повышением сывороточных концентраций тех средств, с которыми он принимается. При таких комбинациях следует тщательно контролировать состояние пациентов.
Важно! При применении могут возникать побочные эффекты: диспептические расстройства, токсическое поражение печени, аллергические реакции, головная боль, головокружение, бессонница, сонливость, тремор, алопеция, лекарственная сыпь, аллергические реакции, нарушения со стороны органов кроветворения, ССС, слабость, повышенная утомляемость.
С осторожностью применяют при нарушениях функции печени и функции почек.
Каприловая кислота (БАД, производитель NPS, США) — представляет собой особый тип полезной насыщенной жирной кислоты, которая обладает антибактериальными, противовирусными, противогрибковыми и противовоспалительными свойствами. Ее считают одной из трех основных жирных кислот (каприновой, лауриновой), найденных в кокосовом масле.
Каприловую кислоту также иногда называют октановой кислотой, ведь она содержит восемь атомов углерода, что делает ее жирной кислотой со средней длиной цепи. В последнее время каприловая кислота стала широко известна своими противогрибковыми эффектами, особенно в отношении поддержания функций пищеварения и здоровья половых органов, в т.ч. мочевого пузыря, кишечника и мочеиспускательного канала. Эту кислоту применяют для профилактики инфекций мочевых путей, мочевого пузыря, инфекции кандида, инфекций, передаваемых половым путем, таких инфекций полости рта, как гингивит и мн. др. Она препятствует разрастанию дрожжеподобных грибов, которые могут жить и размножаться в кишечнике. Кислота может проникать в клеточные мембраны дрожжей Candida, заставляет их отмирать, выводит токсины из желудочно-кишечного тракта и ускоряет процесс заживления.
Каприловая кислота при приеме внутрь быстро уменьшает симптомы, связанные с вирусными и грибковыми инфекциями, такие как Candida и хламидии. Помимо Candida дрожжи могут вызвать другие типы внутренних или внешних дрожжевых инфекций, которые проявляются на коже, половых органах, пальцах ног и других местах. Эта кислота избавляет от дрожжевых инфекций грибка на большом пальце ноги, инфекции полости рта, вагинита у женщин и стригущего лишая.
Специалисты рекомендуют принимать капс. от 500 до 1000 мг три раза в день в форме капсул для достижения оптимального результата.
Прием каприловой кислоты необходимо начинать медленно, чтобы предотвратить боли в желудке. Капсула 500 мг 1–2 раза в день рекомендуется в начале, а затем дозировка увеличивается по мере самочувствия по времени от трех до четырех месяцев, пока состояние не улучшится. Считается, что медленное увеличение дозировки помогает эффективно устранить дрожжевую инфекцию, не навредив организму с аутоиммунной реакцией.
Важно! БАД не рекомендуется к применению беременным женщинам, кормящим грудью, при заболеваниях печени, гипотонии или дефицитом ацил-КоА-дегидрогеназы жирных кислот.
Перед применением необходимо сделать проверку на аллергию и обязательно проконсультироваться с вашим лечащим врачом.
КАНДИДОЗ ПИЩЕВОДА
Кандидоз — инфекционное заболевание слизистых оболочек, кожи и внутренних органов, вызванное дрожжеподобными грибами рода Candida. Кандидоз пищевода (КП), являющийся проявлением висцерального кандидоза, занимает видное место среди инфекционных поражений пищевода. В последние годы прослеживается тенденция нарастания частоты КП, особенно у пациентов с нарушением иммунитета. Рост кандидозной инфекции в значительной степени обусловлен увеличением количества больных с ВИЧ-инфекцией, успехами в трансплантологии и иммуносупрессивной терапии, бесконтрольным использованием антибиотиков. КП встречается у 0,7-1,5% больных гастроэнтерологического профиля [5, 6].
Проблема тяжелых грибковых инфекций, вызываемых оппортунистическими патогенами, состоит в том, что они трудно поддаются лечению и могут приводить к летальному исходу. Было обнаружено, что смертность при инвазивных кандидозных инфекциях составляет 34% [16].
Благоприятные условия для развития инфекционного процесса создают различные нарушения физиологических, анатомических и иммунологических механизмов защиты организма. В качестве факторов, провоцирующих возникновение эзофагеального кандидоза, можно назвать использование антибиотиков, ингаляционных или инъекционных кортикостероидов, антацидную терапию или гипохлоргидрическое состояние, сахарный диабет, алкоголизм, последствия интоксикации, недоедание, пожилой возраст, нарушение моторики пищевода или пищеводную обструкцию, трансплантацию органов и костного мозга, энтеральное и особенно парентеральное питание и др. Ослабление иммунной системы может привести к возникновению кандидозной инфекции. При сахарном диабете повышенный уровень глюкозы в крови способствует росту грибов, так как гипергликемия ослабляет функцию гранулоцитов. Гипофункция паращитовидных желез и надпочечников приводит к нарушению кальциево-фосфорного обмена, что вызывает скрытую спазмофилию пищевода, тем самым снижая его местные защитные возможности [9]. Нарушения нутритивного статуса из-за недостатка белка в организме и низкой калорийности пищи влияют на состояние иммунной системы и создают предпосылки для развития кандидоза [3]. К факторам риска заболевания кандидозом относится снижение кислотности желудочного сока (рН 7,4 является оптимальной для роста грибов Candida, а при сдвиге рН до 4,5 рост грибов полностью угнетается) [3, 4, 7].
Патологические проявления КП разнообразны. Сначала пораженные участки пищевода имеют вид отдельных беловатых или желтоватых очажков, приподнятых над слизистой оболочкой. Позднее эти очажки могут сливаться, образуя плотные налеты с внедрением гриба в подслизистую оболочку или псевдомембранозные наложения с проникновением гриба в мышечную оболочку и сосуды [9]. Пленки, образующиеся на слизистой пищевода в особенно тяжелых случаях, могут почти полностью закрывать просвет пищевода. Налет состоит из слущенных эпителиальных клеток, которые смешиваются с грибками, клетками воспаления и бактериями. Микроскопическое исследование позволяет выявить равномерно окрашенные дрожжеподобные клетки и нити мицелия грибов Candida [9]. Истинное язвообразование наблюдается нечасто и в большинстве случаев отмечается у иммуносупрессированных больных с гранулоцитопенией [29]. Иногда возникает некроз стенки пищевода и развивается флегмонозное воспаление пищевода и средостения, что может стать одной из причин смерти больного [1].
Существует морфологическая классификация, согласно которой все случаи КП подразделяются на три группы в зависимости от степени тяжести процесса, то есть в зависимости от глубины поражения его стенки: 1-я группа — отдельные беловатые налеты с внедрением псевдомицелия гриба между эпителиальными клетками; 2-я группа — пленчатые налеты, сливающиеся между собой и образующие обширные поля, при этом нити псевдомицелия прорастают не только слизистую, но и подслизистую оболочку; 3-я группа — псевдомембранозные наложения, сочетающиеся с глубокими изменениями, при которых нити гриба глубоко проникают в толщу мышечной ткани [10].
Клинические проявления и осложнения. Симптомы заболевания практически отсутствуют у 25-30% пациентов, страдающих КП, особенно у иммунокомпетентных лиц. Тем не менее большинство пациентов предъявляют жалобы, связанные с поражением желудочно-кишечного тракта. Наиболее типичные клинические проявления КП — дисфагия и несколько реже одинофагия. Степень выраженности пищеводных симптомов колеблется от умеренного затруднения при глотании до резко выраженной боли, результатом чего являются неспособность принимать пищу и развитие вторичной дегидратации. При тяжелой одинофагии возможно наличие других причин или коинфекции, особенно у больных со СПИДом. Гораздо реже больные могут жаловаться на загрудинные боли, не связанные с глотанием, изжогу, тошноту, иногда рвоту с выделением пленок (псевдомембран), снижение аппетита и веса, появление жидкого стула со слизью (см. рисунок) [4, 9, 29].
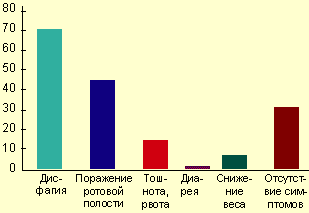 |
| Симптомы кандиозного эзофагита (R. S. Orlando, 1996) |
При КП может быть полезно физикальное исследование. Приблизительно две трети пациентов со
СПИДом и пищеводным кандидозом имеют кандидозный стоматит. КП наблюдается у больных с хроническим слизисто-кожным кандидозом, который относится к тяжелым формам кандидозной инфекции и чаще наблюдается при дисфункции надпочечников и околощитовидных желез [29].
Осложнения пищеводного кандидоза наблюдаются редко. Эзофагеальное кровотечение может наблюдаться при тяжелом течении болезни, сопровождающемся образованием эрозий, язв, и ассоциироваться с коагулопатией; возможно развитие перфорации. Описана вторичная обструкция просвета мицетомой. Редко возникает некроз с развитием флегмонозного воспаления пищевода и средостения [1]. В тяжелых случаях специфический эзофагит может осложниться развитием кандидамикозного сепсиса [6].
Диагностика. Подозрение на пищеводный кандидоз должно возникнуть у любого больного при наличии факторов риска развития пищеводной инфекции и жалоб на дисфагию и одинофагию. Наличие кандидозного стоматита подтверждает этот диагноз, но при его отсутствии поражение пищевода также не исключается.
Рентгенография пищевода с использованием бария обычно применяется для начальной оценки перед проведением эндоскопии. Однако на ранних стадиях кандидозного эзофагита рентгенологическое исследование пищевода не имеет большого диагностического значения, так как оно отражает лишь неспецифические изменения, общие для всех эзофагитов [2]. Классическими рентгенологическими признаками острого эзофагита, вызванного Candida spp., являются линейные или неправильной формы дефекты наполнения с четкими краями. При тяжелом течении кандидозного эзофагита происходит слияние повреждений, из-за чего большие дефекты наполнения иногда образуют скопления в виде гроздьев винограда [2]. Пищевод при этом приобретает «косматый» («ворсистый») вид, симулируя ульцерацию [25]. Наличие больших, хорошо очерченных язв не является признаком кандидозного эзофагита. Могут наблюдаться нарушение моторики и сужение просвета пищевода за счет псевдомембран. Следует помнить о том, что нормальная рентгенограмма пищевода с использованием бария не исключает пищеводного кандидоза. Из-за тяжелой одинофагии больной не сможет выпить барий, что затрудняет рентгеногрфию пищевода [29].
Более информативным для диагностики кандидозного эзофагита считается рентгенологический метод двойного контрастирования, эффективность которого достигает 70% [26].
Цитологическая щетка и баллонный катетер используются для быстрой диагностики пищеводных инфекций без эндоскопии. Эти инструменты могут быть легко введены через носовые ходы или рот сквозь защитный зонд, который предотвращает контаминацию. Материал, полученный на защищенной щетке или баллонном катетере после того, как они будут изъяты из пищевода, оценивается цитологически и культурально. Методика с использованием защищенных щеток имеет чувствительность 88% и специфичность почти 100% [26].
Цитологический метод предполагает окраску мазков-отпечатков или осадка смыва с цитологической щетки в поисках активных форм Candida — почкующихся дрожжевых клеток, псевдомицелия и мицелия. Культуральный метод предполагает помещение исследуемого материала на обогащенную глюкозой среду Сабуро или другие среды, чтобы затем по характеру образующихся колоний судить об этиологии инфекционного процесса в пищеводе.
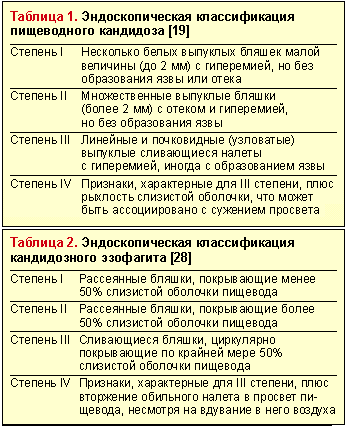
Эндоскопическое исследование пищевода — наиболее чувствительный и специфический метод диагностики пищеводного кандидоза. Эндоскопическая картина КП характеризуется чаще всего наличием легко снимающихся фибринозных рыхлых наложений белого или желтого цвета, под которыми обнаруживается легкоранимая и/или отечная слизистая. Реже наблюдаются катаральный и эрозивно-язвенный эзофагит [19]. Candida spp. редко вызывает истинное язвообразование. Наличие язвы при кандидозном эзофагите нередко служит признаком дополнительного патологического процесса в пищеводе [29]. Существуют различные эндоскопические классификации пищеводного кандидоза (табл. 1 и 2).
В ходе эндоскопии пораженные участки слизистой могут быть подвергнуты щеточной биопсии для цитологического исследования или биопсии для гистологической диагностики. Когда эндоскопически идентифицируются язвы, многократное проведение биопсии помогает исключить наличие сосуществующих патологических процессов. Цитологическое исследование материала, полученного с помощью браш-биопсии, имеет более высокую ступень чувствительности, чем гистологическое исследование образцов биопсии при умеренном поверхностном кандидозе, потому что микроорганизмы могут быть вымыты с поверхности ткани при обработке биопсийного материала [19]. В редких случаях позитивная цитология при наличии отрицательной гистологии указывает на то, что речь идет скорее о колонизации, чем об инфекции. При более тяжелом кандидозном поражении пищевода наибольшее диагностическое значение имеет гистологическое исследование биоптатов слизистой с использованием специальной окраски на нейтральные мукополисахариды по Шиффу PAS (ШИК-реакция) или по Gomori гексаметилентетрамином серебра. Только гистологическое исследование демонстрирует инвазию мицелия или псевдомицелия гриба в глубь ткани пищевода.
Кожное тестирование и серологические тесты малоинформативны для диагностики пищеводного кандидоза.
Лечение. Существует множество пероральных и внутривенных медикаментов, которые используются для лечения кандидозного эзофагита. Несмотря на относительно широкий выбор препаратов, лечение КП является актуальной проблемой, так как некоторые лекарственные средства недостаточно эффективны, другие имеют серьезные побочные эффекты; кроме того, в настоящее время отмечается рост резистентности к антигрибковым препаратам.
При лечении КП первоначально должна быть назначена пероральная терапия, внутривенное введение используется лишь в случае рефрактерного течения заболевания или если имеются противопоказания к пероральному использованию медикаментов. Больным с умеренной степенью тяжести заболевания и минимальным нарушением иммунитета необходим сокращенный курс терапии с использованием системных абсорбируемых лекарственных препаратов типа орального азола. Иммунокомпрометированных больных после трансплантации и больных СПИДом с КП лучше лечить более длинными курсами азола. У пациентов с гранулоцитопенией, когда имеется существенный риск диссеминации Candida инфекции, оправданно использование внутривенных препаратов системного действия (азолов, амфотерицина B) [29].
Арсенал современных противогрибковых средств достаточно широк. Для лечения пищеводного кандидоза используют антигрибковые препараты нескольких групп. Наиболее эффективны препараты из группы азола. Перорально используют невсасывающиеся азолы (клотримазол, миконазол); однако более эффективны препараты системного действия из этой группы (кетоконазол, флуконазол и итраконазол). Эти препараты, подобно другим из группы азола, изменяют проницаемость клеточной мембраны грибов посредством цитохром P450 (CYP)-зависимого вмешательства в биосинтез эргостерола, что приводит к повреждению грибной клетки и ее смерти. Новые триазолы (итраконазол и флуконазол) имеют большее аффинное подобие, чем имидазолы (миконазол и кетоконазол) для грибных CYP-энзимов [14]. Хотя другие средства, такие, как миконазол, клотримазол и нистатин, могут быть использованы для лечения кандидозного стоматита, а также для профилактики пищеводного поражения, эти лекарственные средства менее эффективны в качестве основной группы препаратов для терапии КП [24].
Клотримазол и миконазол — препараты имидазолового ряда. В настоящее время выпускаются клотримазол в таблетках и миконазол для перорального применения. Однако они не всасываются в желудочно-кишечном тракте. Эти препараты могут использоваться при легком кандидозном поражении пищевода у лиц без иммунодефицита.
Кетоконазол (низорал, ороназол) является производным имидазола и при ежедневном приеме в дозе от 200 до 400 мг дает хороший эффект в лечении пищеводного кандидоза. У больных СПИДом, которым обычно требуются более высокие дозы кетоконазола, дневная доза может быть увеличена, если не возникает тошноты, до максимальной (800 мг). Кетоконазол хорошо проникает в различные органы и ткани, но плохо — через гематоэнцефалический барьер. Препарат хорошо всасывается в желудочно-кишечном тракте, но для оптимального всасывания требуется кислая среда. При желудочной гипохлоргидрии и использовании антацидных средств его биодоступность уменьшается. Для улучшения всасывания кетоконазол следует принимать за 2 часа до приема противоязвенных препаратов. Приблизительно у 10-25% больных СПИДом наблюдается снижение желудочной кислотной секреции. Кетоконазол же может вызвать временную блокаду синтеза тестостерона и кортизола [6, 8, 29].
Итраконазол (споранокс) относится к группе триазолов, подобно кетоконазолу, назначается в дозе 200 мг в день. Дальнейшее увеличение дозы удлиняет период полураспада препарата и повышает его эффективность. Всасывание интраконазола уменьшается при снижении pH желудочного сока [23]. Кетоконазол и итраконазол метаболизируются в печени и выделяются с желчью. Период полураспада этих двух препаратов составляет от 7 до 10 часов и от 24 до 42 часов соответственно [14]. Коррекции дозы у больных с почечной недостаточностью не требуется.
Флуконазол (дифлюкан, дифлазон, форкан, флюкостат — отечественный флуконазол) представляет собой водорастворимый триазол и назначается в дозе 100 мг в день. Флуконазол — это препарат, всасывание которого не зависит от pH желудочного сока и который значительно более эффективен при лечении пищеводного кандидоза при СПИДе, чем кетоконазол (200 мг ежедневно) [21]. Флуконазол доступен для перорального и внутривенного применения. Он минимально метаболизируется и выделяется неизмененным с мочой. Флуконазол отличается высоким тканевым тропизмом и не влияет на синтез андрогенов, хорошо проникает через гематоэнцефалический барьер. В отличие от кетоконазола и интраконазола он хорошо растворим в воде и минимально связывается белком. Препарат обладает длительным периодом полураспада (приблизительно 30 часов, если не нарушена функция почек, а наличие пищи или гипохлоргидрия не изменяют всасывание), что позволяет принимать его один раз в сутки. Показано, что введение флуконазола улучшает иммунные показатели по Т- и В-системам [18]. И флуконазол, и итраконазол можно принимать перорально в виде растворов. Эти формы могут быть более эффективны, чем таблетки, потому как усиливают локальный эффект и улучшают всасывание.
Неблагоприятные воздействия кетоконазола, флуконазола и итраконазола прежде всего зависят от дозировки и проявляются в виде тошноты, гепатотоксичности, замедления продукции стероидов и метаболизма циклоспорина [14]. В редких случаях кетоконазол может вызывать фатальный гепатит [12]. Незначительное увеличение аминотрансфераз — общий побочный эффект для всех трех препаратов, однако это не должно служить оправданием для их отмены. Влияние на стероидогенез наиболее выражено у кетоконазола. Обратимое замедление гонадального и надпочечного синтеза стероидов под воздействием кетоконазола может наблюдаться, когда доза превышает 400 мг в сутки [27]. В рекомендуемых дозах флуконазол и итраконазол не влияют на стероидогенез. В результате воздействия на печеночные микросомальные ферменты все три азола ингибируют метаболизм циклоспорина, что приводит к увеличению уровня циклоспорина в крови; этот эффект наиболее ярко выражен у кетоконазола [14].
Новейшим классом противогрибковых препаратов являются кандины, вмешивающиеся в синтез грибковой стенки. Они эффективны в отношении большинства видов Candida, в том числе C. krusei. Первые исследования показали, что капсофунгин, представляющий эту группу препаратов, оказался столь же эффективен при КП, как и амфотерицин В [16].
При лечении больных КП следует учитывать наличие резистентности, которая из-за широкого применения азолов в настоящее время значительно возросла. При развитии резистентности часто бывает полезно увеличить дозу азола. Если этого оказывается недостаточно, переходят на другой препарат из этой группы или используют пероральный раствор итраконазола [13], который нужно назначать в более высоких дозах из-за часто наблюдающейся перекрестной резистентности. Когда высокой дозы (то есть 400 мг ежедневно) флуконазола недостаточно, переходят на внутривенное введение амфотерицина B, при этом результат достигается в 90% случаев. Резистентность к амфотерицину наблюдается редко [29].
В табл. 3 представлено лечение кандидозного эзофагита в зависимости от функции лимфоцитов и гранулоцитов.
При лечении кандидозного эзофагита у больных СПИДом препаратами первого ряда являются кетоконазол и флюконазол, причем предпочтение следует отдавать флюконазолу. Из-за лучшей переносимости он прежде всего показан пациентам, находящимся на поздней стадии болезни, которые имеют много сопутствующих заболеваний. При нарушении глотания могут применяться парентеральные формы флуконазола. При неэффективности препаратов первого ряда используют лекарственные средства из группы резерва (амфотерицин В, итраконазол), которые более токсичные и/или более дорогие. Этиотропная терапия кандидоза пищевода, кроме основного курса лечения, требует проведения поддерживающего лечения, которое может быть пожизненным (табл. 4) [4].
Лечение кандидоза на фоне тяжелого иммунодефицита и лейкопении — задача сложная. Наряду с антигрибковой терапией актуально восстановление пула нейтрофильных лейкоцитов и их функциональной активности, так как нейтрофильные лейкоциты являются одним из основных звеньев механизма защиты от Candida spp. Предлагается в качестве дополнительного средства при лечении кандидозной инфекции на фоне нейтропении использовать гранулоцитарный колониестимулирующий фактор, который сокращает дефицит миелопероксидазы в нейтрофильных лейкоцитах и усиливает их кислородозависимую антикандидозную активность [7]. Получен хороший эффект от эндоскопического введения больным КП концентрата гранулоцитов и высокоинтенсивного импульсного лазерного излучения, что улучшает иммунные функции [5].
Таким образом, для достижения успеха у больных с тяжелыми грибковыми инфекциями, в том числе с кандидозом, целесообразен комплексный подход к диагностике и лечению. Повышению выживаемости будет способствовать оперативная диагностика с последующими подбором эффективной специфической противогрибковой терапии и проведением лечебных мероприятий, направленных на повышение числа гранулоцитов и стимуляцию фагоцитоза [16].
По вопросам литературы обращайтесь в редакцию