канюляция аорты что это
Хирургические особенности доперфузионного периода
Подготовка к операции.
Кожу следует обработать раствором «первомура» и насухо вытереть. Затем ее последовательно обрабатывают спиртовым раствором йода и спиртом. Больного накрывают простынями так. чтобы доступ к сердцу был просторным. В некоторых случаях, как, например, при операциях аортокоронарного шунтирования, оставляют непокрытой и участок кожи на нижней конечности, где «забирают» вену для шунтирования.
Продольная срединная стернотомия.
Это наиболее часто используемый доступ к сердцу, поскольку он предоставляет исключительные возможности подхода к различным отделам этого органа.
Кожу рассекают строго по средней линии примерно на 1,5см выше рукоятки грудины, не доходя на 2—3 см до пупка. Среднюю линию рукоятки и тела грудины обозначают коагуляцией передней надкостницы. Рассекают мечевидный отросток по средней линии и тупым путем освобождают ретростернальное пространство, затем рассекают грудину. Существует несколько способов рассечения грудины. Чаще всего ее рассекают с помощью специальной пилы. Некоторые авторы используют пилу Джигли. Надкостницу грудины коагулируют, а затем губчатое вещество обрабатывают воском. Ставят ранорасширитель и приступают к вскрытию перикарда. Существуют различные способы вскрытия перикарда, однако наиболее удобным является Т-образный разрез. Следует стремиться к максимальному освобождению перикарда от вилочковой железы и излишнего жира, чтобы получить хороший доступ к аорте во время операции.
Стернотомия при повторной операции.
Наличие сращений от предыдущей операции делает доступ путем продольной срединной стернотомии трудным и потенциально опасным. Конечно, внимательное отношение к каждому движению с максимальным исключением риска делает эту процедуру управляемой. Основная опасность — развитие неконтролируемого кровотечения. Кровотечения можно избежать, если предпринять соответствующие меры предосторожности и обеспечить возможность немедленной канюляции сосудов. Во всех случаях повторной операции должна быть предусмотрена возможность проведения экстренной перфузии во время стернотомии; для этого необходимо предварительно подготовить хирургическое поле с целью быстрого выделения и канюляции бедренных артерии и вены.
Последовательность повторной стернотомии: проволоку или дакроновые швы пересекают, но не извлекают. Для рассечения грудины следует пользоваться пилой. Она проходит через ранее наложенные швы. Не повреждая дополнительных тканей. Швы, наложенные ранее на фасции и нижнюю часть грудины, разрезают, что открывает доступ к ретростернальному пространству. Трудоемкость доступа свидетельствует о ретростернальных сращениях сердца и крупных сосудов. В этих случаях прекращают выделение отделов сердца, канюлируют бедренные сосуды и подключают АИК.
Грудину рассекают пилой. При этом следят за тем, чтобы край пилы не заходил за задний край грудины. После разделения грудины можно использовать острые крючки, с помощью которых начинают освобождать ткани ретростернального пространства. Сердце необходимо освободить от грудины до установления ранорасширителя, так как широкое разведение грудины до освобождения сердца может привести к разрыву правого желудочка или правого предсердия. Сердце начинают выделять после небольшого разведения грудины. Сравнительно свободная область, позволяющая начать такое выделение,— это диафрагмальная поверхность сердца. Она может служить для идентификации отдельных структур сердца, а также для того, чтобы приступить к выделению его структур тупым и острым путем. Выделение сердца обычно осуществляется вокруг правого предсердия над правым желудочком вокруг аорты и легочной артерии. Последовательность действий при повторной стернотомии уменьшает частоту кровотечений, а также их выраженность. При массивном кровотечении во время стернотомии или выделения сердца тщательно контролируют кровопотерю путем измерения артериального давления; при необходимости немедленно подключают АИК. Коронарным отсосом всю кровь возвращают в оксигенатор. Иногда не удается справиться с кровотечением даже при полном ИК, в этих случаях можно использовать глубокую гипотермию, а при необходимости остановку кровообращения. Для опытного хирурга повторная стернотомия становится достаточно безопасной процедурой.
Канюляция сосудов.
Методы канюляции полых вен разнообразны. Безусловно, каждый хирург выработает со временем свои подходы к этому этапу операции. Однако некоторые общие положения соблюдают все. К ним относятся: использование оптимального места канюляции, создающего наилучшие условия для обзора и манипулирования, предупреждение повреждения синусно-предсердного узла или межузловых путей, профилактика кровопотери.
При проведении операций у детей грудного возраста с использованием глубокой гипотермии и остановкой кровообращения, а также у взрослых больных при выполнении операции аортокоронарного шунтирования для возврата венозной крови используется одна канюля, вводимая в правое предсердие. Во всех остальных случаях при операциях на открытом сердце канюлируют обе полые вены. Ушко правого предсердия используется для проведения канюли в правое предсердие (при использовании одной канюли) или для проведения последней в нижнюю полую вену. Ушко отжимают зажимом Сатинского и накладывают кисетный шов. Затем иссекают край ушка и разделяют содержащиеся в нем трабекулы над зажимом. На края разреза накладывают два зажима, которые держит ассистент. Хирург открывает зажим Сатинского и проводит канюлю в правое предсердие, а затем внижнюю полую вену. Затягивают турникет и фиксируют его к канюле. Для канюляции верхней полой вены используют другое отверстие. Его формируют следующим образом: накладывают кисетный шов, если есть возможность, в области ушка правою предсердия (когда оно увеличено) или в свободной (не мешающей операции) части правого предсердия. Это место потом можно также отжать зажимом Сатинского и затем выполнить канюляцию по методике, изложенной выше. Канюляцию полых вен при повторных операциях, когда ушко предсердия облитерировано. а стенка утолщена и отечна, выполняют без применения зажима. Накладывают кисетный шов. ограниченную кисетом часть стенки правого предсердия вытягивают зажимом типа Алиса, что позволяет сделать скальпелем отверстия в предсердии строго по середине кисетного пространства и ввести канюлю с острым концом сначала в нижнюю полую вену, а затем по аналогичной схеме и в верхнюю полую вену. Края такого разреза обычно достаточно эластичны и канюлю ввести нетрудно. После введения канюли затягивают турникет и фиксируют его к канюле.
Мобилизация полых вен и подведение под них тесемок, проводимых в турникеты, разные хирурги осуществляют не в одно и то же время. Многие авторы, особенно при повторных операциях, обходят и берут в турникеты полые вены во время параллельного ИК с одновременным охлаждением поверхности тела больного. Для выделения верхней полой вены рассекают перикардиальную складку над правой легочной артерией (медиально от верхней полой вены). Это открывает ретрокавальное пространство и позволяет без труда провести десектор и тесемку вокруг верхней полой вены. Для выделения нижней полой вены можно надсечь перикард латеральнее от нее, отступя книзу к диафрагме. Затем с внутренней стороны проводят десектор и обходят вену тесемкой. У детей до 3 лет обходить полые вены рекомендуется после начала ИК, что позволяет избежать нарушений гемодинамики.
Канюляция аорты.
В большинстве случаев канюлируют восходящую часть аорты. Бедренную артерию используют иногда при повторных операциях и при резекции восходящей части аорты, когда ее канюляция становится невозможной. С накоплением огромного опыта канюляция аорты перестала быть рискованной процедурой. Ее выполняют обычно без краевого отжатия стенки сосуда. Перед тем как приступить к канюляции, обходят аорту тесемкой и берут ее в турникет, чтобы впоследствии пережать аорту при выполнении кардиоплегии, особенно у детей. Затем на область предполагаемой канюляции накладывают два кисетных шва, захватывая только наружный слой аорты. В пределах внутреннего кисетного шва ее надсекают. Скальпелем создают отверстие в аорте. В это отверстие вставляют конец аортальной канюли и затягивают турникеты; внутренний турникет фиксируется к аортальной канюле. Ряд хирургов надсекают аорту остроконечным скальпелем в центре внутреннего кисетного шва и сразу же вводят в просвет аорты через разрез конец (клюв) канюли. Аортальную канюлю подсоединяют к артериальной магистрали АИК и из нее тщательно удаляют воздух. Для канюляции бедренной артерии ее необходимо широко обнажить, прибегая для этого к частичному рассечению пупартовой связки. Канюлю вводят в бедренную артерию выше места отхождения глубокой бедренной артерии. В ряде случаев одну из венозных канюль проводят через бедренную вену, фиксируя ее к коже вне операционной раны.
Аневризма восходящего отдела аорты: лечение, операция, стоимость
Тел.: 8-800-25-03-03-2
(бесплатно для звонков из регионов России)
Санкт-Петербург, наб. реки Фонтанки, д. 154
Тел.: +7 (812) 676-25-25
Санкт-Петербург, В.О., Кадетская линия, д. 13-15
Тел.: +7 (812) 676-25-25
Санкт-Петербург, ул. Циолковского, д.3
Тел.: +7 (812) 676-25-10
Деление аорты на отделы очень важно для оценки риска и выбора оптимальной тактики лечения у пациентов с аневризмами аорты.
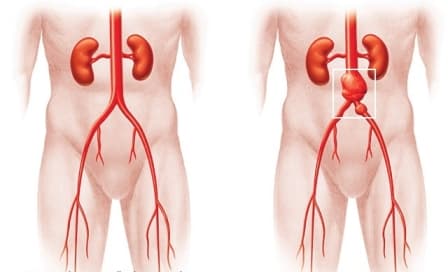
Аневризмой аорты называют участок её локального расширения.
Причины расширения аорты
Врожденные системные заболевания соединительной ткани: синдром Марфана, Элерса – Данлоса, вызванные генетическими изменениями, при которых стенка аорты имеет неправильное строение, способны стать причиной развития аневризмы.
Приобретенные заболевания, вызывающие аневризматическое изменение стенки аорты: чаще всего это — атеросклероз. Около 80% всех осложненных аневризм аорты — аневризмы, вызванные атеросклеротическим процессом, который приводит к ослаблению стенки сосуда, и невозможности выдерживать нормальное кровеносное давление, а как следствие — к расширению её.
Реже аневризма аорты развивается при воспалительных заболеваниях, вызванных внешними агентами (сифилис, грибковая инфекция, туберкулез) или при аутоиммунных заболеваниях (неспецифический аортоартериит).
Симптомы аневризмы аорты
К сожалению, диагноз аневризмы аорты не всегда может быть установлен в «холодный период» (до развития осложнений), так как это заболевание обычно протекает бессимптомно. Чаще всего её обнаруживают случайно при выполнении флюорографии, ультразвуковых или томографических исследований, выполненных в связи с другими заболеваниями. Лечение аневризмы восходящего отдела аорты до развития осложнений гораздо безопаснее для пациента, поэтому в ранней диагностике аневризмы аорты важное значение придается плановой диспансеризации.
Жалобы обычно появляются, когда аневризма начинает расслаиваться или, увеличиваясь, сдавливает окружающие органы и ткани. Появляется боль или нарушение функций тех органов, которые располагаются в области аневризмы. Вначале это не носит яркого характера и, поэтому, не настораживает ни пациента, ни врача.
Диагностика аневризмы аорты
Методы лечения аневризмы аорты
Для каждого метода имеются свои показания, и каждому из них присущи свои преимущества и недостатки.
Преимущества хирургического метода заключаются в его универсальности, то есть возможности исправления всех нарушений, связанных с аневризмой аорты, вне зависимости от отдела и характера поражения. Например, при аневризме восходящего отдела аорты и поражении аортального клапана проводят протезирование аорты, аортального клапана в сочетании с коронарным шунтированием.
Показания к оперативному лечению
Для каждого отдела аорты существует пограничный предел поперечного размера аорты, после достижения которого риск разрыва аорты статистически достоверно увеличивается. Так, для восходящего и брюшного отдела аорты опасным в плане разрыва является поперечный диаметр аневризмы 5 см, для грудного отдела аорты — 6 см. Если диаметр аневризмы увеличивается более чем на 6 мм за 6 мес, то это тоже является показанием к операции. Угрожающими в плане разрыва и расслоения аорты являются также мешковидная форма аневризмы и расширения аорты меньше того диаметра, который является показанием для операции, но сопровождающиеся болями в месте расширения и нарушениями функций предлежащих органов. Расслоения и свершившиеся разрывы аневризм являются абсолютными показаниями к экстренной операции.
Виды открытых хирургических операций при аневризмах аорты:
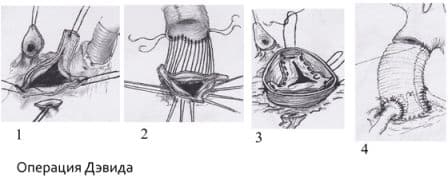
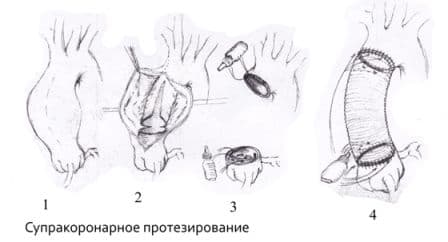
Операция Бенталла-Де-Боно (протезирование восходящего отдела аорты клапансодержащим кондуитом с механическим протезом аортального клапана);
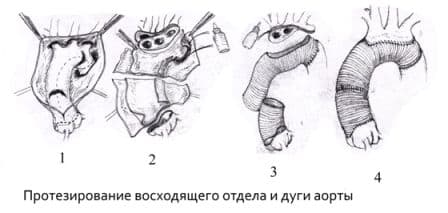
Протезирование восходящего отдела аорты и её дуги (техника Борста, использование косого агрессивного анастомоза и другие методики);
Протезирование грудного отдела аорты;
Протезирование брюшного отдела аорты.
Эндоваскулярные вмешательства
Позволяют резко уменьшить объем операционной травмы, сократить сроки госпитализации и уменьшить неизбежные страдания пациента, связанные с хирургическими доступами. Одним из основных недостатков метода, является необходимость повторных вмешательств.
Виды эндоваскулярных операций при аневризме аорты:
Наиболее современным методом лечения аневризмы аорты является гибридный метод, позволяющий достичь оптимальных результатов лечения при наименьшей операционной травме.
Гибридные операции сочетают в себе преимущества открытых и эндоваскулярных вмешательств.
Канюляция аорты что это
Резюме Цель исследования — ретроспективный анализ результатов последовательных 100 операций у больных с критическим стенозом аортального клапана. Материал и методы. Проанализированы результаты 100 операций по поводу критического аортального стеноза за период с 2014 по 2018 г. Средний возраст пациентов составил 63,9±8,9 года (от 32 до 83 лет), соотношение мужчин и женщин — 43/57. Результаты. Летальность в ближайшем послеоперационном периоде составила 2%, среднее время искусственного кровообращения (ИК) — 93,9±32,4 мин (от 57 до 192), время пережатия аорты — 74,4±24 мин (от 45 до 133). Адекватная хирургическая коррекция и снижение постнагрузки на левый желудочек (ЛЖ) сопровождались увеличением сердечного индекса более чем в 1,5 раза (с 1,3±0,2 до 2,1±0,3 л/мин/м; р
Аортальный стеноз (АС) является наиболее распространенной формой поражения клапанного аппарата сердца. В развивающихся странах с высокой частотой диагностируется аортальный стеноз ревматического генеза. Для данной патологии характерно длительное течение с постепенной трансформацией фиброза в тотальный кальциноз, переходящий на структуры корня аорты [1]. Патофизиология обусловлена перегрузкой левого желудочка (ЛЖ) вследствие обструкции его выходного тракта, развитием гипертрофии ЛЖ и в запущенных случаях снижением контрактильности миокарда [2]. Ни одна из предложенных схем фармакотерапии не доказала свою эффективность в отношении регрессирования стеноза аортального клапана. В настоящее время широкое распространение получают транскатетерные методы имплантации аортального клапана, однако открытое хирургическое вмешательство по-прежнему является «золотым стандартом».
Цель исследования — ретроспективный анализ результатов 100 последовательных операций у больных с критическим стенозом аортального клапана.
Материал и методы
В отделении хирургии пороков сердца РНЦХ им. акад. Б.В. Петровского был проведен ретроспективный анализ результатов лечения 100 пациентов, последовательно оперированных за период с 2014 по 2018 г. Критерием включения являлся стеноз аортального клапана с пиковым градиентом давления не менее 100 мм рт.ст. и эффективной площадью аортального отверстия 2 по данным трансторакальной эхокардиографии (ЭхоКГ) (табл. 1).

Средний возраст пациентов — 63,9±8,9 года (от 32 до 83 лет), соотношение мужчин и женщин — 43/57.
Всем пациентам было выполнено стандартное предоперационное обследование, включавшее ЭхоКГ и коронарную ангиографию (КАГ). Интраоперационно выполнялся мониторинг гомеостаза, включавший контроль гемодинамики большого и малого круга кровообращения, метаболизма, температуры тела, кислотно-основного баланса крови, ЭКГ. Чреспищеводная ЭхоКГ использовалась для визуализации анатомических структур сердца, определения ударного объема (УО), конечного систолического (КСО) и конечного диастолического объемов (КДО) ЛЖ, фракции выброса ЛЖ (ФВ ЛЖ), градиента давления на аортальном клапане.
Дооперационные характеристики больных представлены в табл. 2.

Анестезиологические аспекты
Премедикация: на ночь — реланиум 1 таблетка, утром в день операции — промедол, супрастин, атропин.
Вводная сбалансированная анестезия осуществлялась введением мидазолама в дозе 1,5—2,5 мг, пропофола в общей дозе 50—150 мг, фентанила. Вазодилатирующий эффект пропофола и мидазолама компенсировали небольшим поднятием ног и инфузией кристаллоидного раствора для предупреждения снижения преднагрузки, в отдельных случаях прибегали к введению микродоз фенилэфрина. С целью предупреждения нежелательной гипертензии и тахикардии при эндотрахеальной интубации 20—40 мг пропофола из его общей дозы инъецировали непосредственно перед ларингоскопией. Пипекурония бромид был использован для миорелаксации ввиду отсутствия его влияния на гемодинамику [3, 4].
Поддержание анестезии осуществляли сбалансированным применением севофлурана, пропофола в дозе 2—4 мг/кг/ч и пипекурония бромида на фоне инфузии фентанила. Севофлуран был использован в качестве основного анестетика у всех больных в концентрации, достаточной для поддержания минимальной альвеолярной концентрации от 0,5 до 1.
Катехоламины в предперфузионном периоде не применялись при снижении давления, если не считать единичных болюсных введений микродоз фенилэфрина в период подключения венозных канюль для ИК.
Хирургические аспекты
ИК осуществляли канюляцией восходящей аорты и раздельной канюляцией полых вен. Перфузионный индекс поддерживали ≥2,5 л/мин/м 2 со снижением температуры тела до 32 °C. Целевое значение артериального давления во время перфузии составляло 55—60 мм рт.ст., парциальное давление кислорода в артериальной крови (раО2) ≤ 250 мм рт.ст., гематокрит ≥23—24%. При снижении гематокрита ниже указанных цифр в контур аппарата ИК включался гемоконцентратор DHF 0,6. Защита миокарда в большинстве случаев (n=77) осуществлялась антеградной перфузией коронарных артерий раствором Кустодиол в течение 10 мин (средний объем 3 л). Дополнительно сердце обкладывалось ледяной крошкой. К повторному введению кардиоплегического раствора у этой группы больных не прибегали. Раздельная канюляция полых вен позволяла удалять кардиоплегический раствор из правого предсердия внешним отсосом. У 18 больных кардиоплегия достигалась введением раствора Консол, в 5 случаях использовали кровяную кардиоплегию.
Доступ к сердцу — полная срединная стернотомия, доступ к аортальному клапану (АК) — косая аортотомия, которую при необходимости можно продлить до фиброзного кольца и выполнить расширение корня аорты.
Критическое стенозирование выходного тракта ЛЖ у всех пациентов было обусловлено грубой кальцификацией створок АК с вовлечением фиброзного кольца, переходом на стенку аорты и переднюю створку митрального клапана (МК) (рис. 1 и далее).

Компактность анатомических структур корня аорты затрудняет удаление кальцинированного АК при вовлечении в процесс фиброзного каркаса сердца и перехода кальциноза на МК, межжелудочковую перегородку, стенку аорты (рис. 2).




Как следует из табл. 3, после вводной анестезии систолическое АД (CАД) достоверно снизилось с 139±15 до 117±15 мм рт.ст., т. е. на 16% (р 2 ; р 
Механические протезы были использованы у 62, биологические — у 38 пациентов. В табл. 5 указаны

Обсуждение
Среди всех приобретенных клапанных пороков сердца диагностика аортального стеноза наиболее простая: уже на ранних стадиях появляется систолический шум, который коррелирует со степенью стеноза, ЭКГ подтверждает гипертрофию и перегрузку Л.Ж. Тем не менее значительная часть пациентов поступают для хирургического лечения на поздних стадиях заболевания. Одной из причин этого является длительное бессимптомное течение болезни, обусловленное большими резервными возможностями ЛЖ [1].
Основными жалобами пациентов с аортальным стенозом являются снижение толерантности к физическим нагрузкам, одышка, стенокардия, обмороки. У многих пациентов порок диагностируют до появления симптомов на основании шума при физикальном обследовании. Ожидаемая продолжительность жизни пациентов с тяжелым аортальным стенозом при появлении выраженных симптомов составляет в среднем 1—2 года.
У абсолютного большинства пациентов (99%) наблюдался кальциноз АК 3—4-й ст. с распространением процесса на окружающие структуры: фиброзное кольцо АК, митрально-аортальный контакт, переднюю створку МК, стенку корня аорты и межжелудочковую перегородку.
Кальцификация створок врожденного двустворчатого или нормального трехстворчатого АК в настоящее время является наиболее частой причиной аортального стеноза у взрослых пациентов. Как следует из нашего исследования, 73% больных были в возрасте 60 лет и более.
Кальцинированный аортальный стеноз как активный патологический процесс во многом подобен атеросклерозу, характеризуется отложением липидов, воспалением и кальцификацией. Таким образом, факторы риска его развития аналогичны факторам риска развития атеросклероза: повышение уровня холестерина, липопротеинов низкой плотности, сахарный диабет, курение, артериальная гипертензия. Описаны также семейные случаи кальцинированного аортального стеноза, что свидетельствует о возможной генетической предрасположенности к кальцификации клапана.
Систолический градиент давления на аортальном клапане иногда достигает 180 мм рт.ст., и при системном давлении 120 мм рт.ст. суммарная нагрузка на ЛЖ достигает 300 мм рт.ст. Длительная перегрузка ЛЖ давлением приводит к значительному ремоделированию миокарда. При гистологическом исследовании определяются выраженная гипертрофия кардиомиоцитов, увеличение размеров их ядер. Ядра окружены перинуклеарным гало. Отмечаются участки диффузного, в том числе крупноочагового, кардиосклероза. Интрамуральные сосуды имеют толстые стенки, просвет их сужен, присутствуют участки кровоизлияний (рис. 5).

Увеличение толщины стенки позволяет поддерживать сократительную функцию ЛЖ, однако увеличенная масса миокарда и прогрессирование интерстициального фиброза приводят к диастолической дисфункции, которая может сохраняться даже после устранения аортального стеноза. Усиленное предсердное сокращение вносит вклад в повышение конечного диастолического давления, играет важную роль в желудочковом наполнении без повышения среднего давления в левом предсердии и легочных венах. Утрата эффективного предсердного сокращения, например при фибрилляции предсердий, часто сопровождается серьезным клиническим ухудшением у пациентов с тяжелым аортальным стенозом. При «митрализации» порока в патологический процесс вовлекаются правые отделы сердца, появляются застой и гипертензия в малом круге кровообращения, что относится к поздним признакам порока.
В гипертрофированном сердце могут развиваться относительное снижение коронарного кровотока, а также ограничение коронарного вазодилатационного резерва даже при отсутствии ИБС. Все это предъявляет повышенные требования к проведению анестезии и защиты миокарда.
Задачей анестезиологического обеспечения в предперфузионный период у больных с обструкцией выходного тракта ЛЖ является поддержание адекватной преднагрузки, синусового ритма, профилактика тахиаритмии, гипотензии и повышение контрактильности миокарда [8].
Метод титрования препаратов для вводной анестезии позволил достичь необходимой глубины анестезии и предупредить резкие изменения гемодинамики.
Вопрос о целесообразности включения кетамина в схему вводной анестезии неоднозначен ввиду его возможного симпатомиметического эффекта. Наш опыт показал, что использование его у 20 больных в дозе 0,5—0,9 мг/кг в сочетании с мидазоламом и/или пропофолом не оказало нежелательного стимулирующего действия и сопровождалось аналогичной, но менее выраженной динамикой этих показателей: САД снизилось лишь на 10%, а ЧСС практически не изменилась. Эти данные говорят о возможности включения субнаркотических доз кетамина при исходной гипотензии и брадикардии.
В пользу применения севофлурана для поддержания анестезии свидетельствуют результаты исследования S. Cromheecke и соавт. [9]. Авторы показали, что ударный объем и скорость нарастания давления в полости ЛЖ (dP/dt) в постперфузионном периоде были достоверно выше, а уровень тропонина через 48 ч ниже в условиях ингаляционной анестезии севофлураном в сравнении с тотальной внутривенной анестезией пропофолом при коррекции аортального стеноза [9].
В целом стабильность центральной гемодинамики и сохранение нормальных значений лактата крови позволяют считать выбранную вводную и поддерживающую анестезию адекватной для предперфузионного периода, что позволило предупредить экстренное подключение аппарата ИК.
Показатели ЦВД не вполне корректно коррелируют с наполнением ЛЖ при сниженном комплаенсе, имеющем место при критическом АС [4, 10]. Введение катетера Сван—Ганца чревато возникновением тахиаритмий, которые могут значимо компрометировать диастолическое наполнение ЛЖ [6, 10]. ЭхоКГ, по нашим данным, может адекватно заменить легочно-артериальный катетер для волемического и гемодинамического контроля и оценки адекватности анестезии в отсутствие легочной гипертензии. В литературе [2, 11] подчеркнута значимая роль чреспищеводной ЭхоКГ в составе интраоперационного мониторинга для характеристики внутрисердечной геометрии, систолической и диастолической функции ЛЖ, насосной функции сердца до и после коррекции аортального порока.
Ключ к успеху операции при коррекции аортального клапана, помимо хирургической техники, лежит в адекватной защите гипертрофированного миокарда.
Преимущества раствора Кустодиол при коррекции АС заключаются в высокой консервирующей способности, внутриклеточном действии, глубоком и равномерном охлаждении всех участков гипертрофированного миокарда за счет длительности введения, сохранении защитных свойств до 3 ч без повторного проливания. Относительными недостатками являются необходимость длительной инфузии нескольких литров раствора и его высокая цена.
Об адекватности защиты миокарда и предупреждении развития «оглушения» миокарда свидетельствовали такие факты, как достаточно быстрое отключение ИК (период от снятия зажима с аорты до прекращения ИК составлял 10—30 мин у 90% больных) и стабильное поддержание гемодинамики у большинства больных в постперфузионном периоде. Минимальные дозы кардиотоников (добутрекс/допамин 2—4 мкг/кг/мин) потребовались лишь у 15% больных.
Уменьшению периоперационной геморрагии, помимо протокольного восстановления свертывающей системы крови после ИК, способствовали профилактическое использование антифибринолитических средств (транексамовой и аминокапроновой кислоты) и интраоперационная нормоволемическая гемодилюция или аутогемотрансфузия [12].
Заключение
Больные с критическим АС представляют собой тяжелую категорию пациентов в хирургии пороков сердца. Однако современные достижения и возможности их до- и послеоперационного ведения, усовершенствование анестезиологического пособия и хирургической тактики позволили снизить уровень госпитальной летальности и частоту осложнений.
Авторы заявляют об отсутствии конфликта интресов.
The authors declare no conflict of interest.