карбамазепин или лирика что лучше
Что лучше: Лирика или Карбамазепин
Лирика
Карбамазепин
Исходя из данных исследований, Лирика лучше, чем Карбамазепин. Поэтому мы советуем выбрать его.
Но не забывайте, что у данных препаратов в составе разные активные вещества. Поэтому обязательно проконсультируйтесь с врачом. Возможно, какой-то из них может не подойти для вашей терапии.
Сравнение эффективности Лирики и Карбамазепина
Эффективность у Лирики достотаточно схожа с Карбамазепином – это означает, что способность лекарственного вещества оказывать максимально возможное действие схоже.
Например, если терапевтический эффект у Лирики более выраженный, то при применении Карбамазепина даже в больших дозах не получится добиться данного эффекта.
Также скорость терапии – показатель быстроты терапевтического действия у Лирики и Карбамазепина примерно одинаковы. А биодоступность, то есть количество лекарственного вещества, доходящее до места его действия в организме, схожа. Чем выше биодоступность, тем меньше его потерь будет при усвоении и использовании организмом.
Сравнение безопасности Лирики и Карбамазепина
Безопасность препарата включает множество факторов.
При этом у Лирики она достаточно схожа с Карбамазепином. Важно, где метаболизируется препарат: лекарственные вещества выделяются из организма либо в неизмененном виде, либо в виде продуктов их биохимических превращений. Метаболизм протекает спонтанно, но чаще всего задействует основные органы, такие как печень, почки, лёгкие, кожу, мозг и другие. При оценивании метаболизма у Лирики, также как и у Карбамазепина мы смотрим, какой орган является метаболизирующим и наколько критично действие на него.
Соотношение риска к пользе – это когда назначение лекарственного препарата нежелательно, но оправдано при определенных условиях и обстоятельствах, с обязательным соблюдением осторожности применения. При этом у Лирики нет никаих рисков при применении, также как и у Карбамазепина.
Также при рассчете безопасности учитывается проявляются ли только аллергические реакции или же возможная дисфункция основных органов. В прочем как и обратимость последствий от использования Лирики и Карбамазепина.
Сравнение противопоказаний Лирики и Карбамазепина
Исходя из инструкции. Количество противопоказаний у Лирики достаточно схоже с Карбамазепином и составляет малое количество. Это и перечень симптомов с синдромами, и заболевания, различные внешних и внутренние условия, при которых применение Лирики и Карбамазепина может быть нежелательным или недопустимым.
Сравнение привыкания у Лирики и Карбамазепина
Как и безопасность, привыкание тоже включает множество факторов, которые необходимо учитывать при оценивании препарат.
Так совокупность значениий таких параметров, как «cиндром отмены» и «развитие резистентности», у Лирики меньше, чем аналогичные значения у Карбамазепина. Синдром отмены – это патологическое состояние, возникающее после прекращения поступления в организм веществ, вызывающих привыкание или зависимость. А под резистентностью понимают изначальную невосприимчивость к препарату, этим она отличается от привыкания, когда невосприимчивость к препарату развивается в течение определенного периода времени. Наличие резистентности можно констатировать лишь в том случае, если была сделана попытка увеличить дозу препарата до максимально возможной.
Сравнение побочек Лирики и Карбамазепина
Побочки или нежелательные явления – это любое неблагоприятное с медицинской точки зрения событие, возникшее у субъекта, после введения препарата.
У Лирики состояния нежелательных явлений почти такое же, как и у Карбамазепина. У них у обоих количество побочных эффектов малое. Это подразумевает, что частота их проявления низкая, то есть показатель сколько случаев проявления нежелательного эффекта от лечения возможно и зарегистрировано – низкий. Нежелательное влияние на организм, сила влияния и токсическое действие у Лирики схоже с Карбамазепином: как быстро организм восстановиться после приема и восстановиться ли вообще.
Сравнение удобства применения Лирики и Карбамазепина
Это и подбор дозы с учетом различных условий, и кратность приемов. При этом важно не забывать и про форму выпуска препарата, ее тоже важно учитывать при составлении оценки.
Удобство применения у Лирики лучше, чем у Карбамазепина.
Рейтинг препаратов составлен опытными фармацевтами, изучающий международные исследования. Отчет сгенерирован автоматически.
Дата последнего обновления: 2021-01-10 10:01:49
ТАБЛЕТКИ ОТ ПАНИЧЕСКИХ АТАК
Существует несколько способов борьбы с паническими атаками. Все их можно разделить на три вида:
Все лекарственные средства, помогающие при панических атаках делятся на две группы:
Средства быстрой помощи при панической атаке
Бензодиазепиновые транквилизаторы
Самые эффективные и быстродействующие лекарства при панических атаках это группа бензодиазепиновых транквилизаторов. К ним относятся:
Это сильнодействующие средства и поэтому в свободной продаже их нет. Приобрести их можно по специальным рецептам, которые могут выписывать только сертифицированные врачи в лицензированных клиниках.
Действие бензодиазепиновых транквилизаторов обеспечивает быстрое снятие тревоги, вегетативных проявлений (учащенный пульс и дыхание, потливость, дрожь, ознобы и волны жара, головокружения и др.), нормализацию сна и аппетита.
Так как в основе любой панической атаки находится тревога и чрезмерная активизация структур мозга, отвечающих за защитный тревожный рефлекс, то, независимо от причин, механизма развития и проявления паники транквилизаторы всегда оказывают быстрый эффект. Либо предотвратят развитие панического приступа, либо (если он уже начался) купируют его.
Указанные препараты часто применяются в таблетированной форме. Как правило прием одной таблетки транквилизатора обеспечивает развитие лечебного эффекта через 20-40 минут.
Плюсы бензодиазепиновых транквилизаторов: выраженный противотревожный эффект, быстрое наступление действия, хорошо переносится.
Небензодиазепиновые транквилизаторы
По силе действия они уступают препаратам предыдущей группы. Но и имеют свои преимущества: хорошо переносятся, не вызывают сонливости, не развивается зависимость, проще приобрести в аптеках (не нужны специальные рецепты).
Нейролептики
Нейролептики с седативным действием. Это следующая группа препаратов, обладающая успокоительным действием и позволяющая снять приступ панической атаки. Наиболее рапространенные таблетированные средства:
Антидепрессанты с седативным действием
В отличие от нейролептиков и транквилизаторов, эффект у антидепрессантов развивается не так быстро, но носит более продолжительный характер.
Прочие препараты для быстрого снятия приступа
Лекарства для постоянного приема от панических атак
Постоянный прием фармакотерапии позволяет стабилизировать биохимические и физиологические процессы в нервной системе, отвечающие за развитие приступов паники.
В основном, такие лекарства воздействуют на специфические рецепторы в головном мозге и восстанавливают нормальную активность нейромедиаторов: дофамин, серотонин, норадреналин, адреналин, ацетилхолин и другие.
Антидепрессанты
Преимущественно воздействуют на серотониновые рецепторы нервной системы. Применяются курсами по несколько месяцев (от трех до более года). Наиболее «популярные» и распространенные антидепрессанты для предотвращения панических атак:
Нейролептики
Воздействуют преимущественно на дофаминовые рецепторы мозга. Назначаются в случаях когда панические атаки являются проявлением эндогенного заболевания. Как и антидепрессанты принимаются длительно от нескольких месяцев до нескольких лет.
Вопреки распространенному среди болеющих тревожными расстройствами лиц мнению не вызывают зависимости. Самые часто применяемые при длительном лечении панических атак нейролептики:
Нормотимические препараты
Их механизм действия это нормализация соотношения процессов возбуждения и торможения в головном мозге. Наиболее эффективны при панических атаках на фоне энцефалопатии, последствий черепно-мозговых травм, инсультов, гипоксии.
Самые распространенные представители нормотимиков:
Подводя итог, можно отметить, что среди выше перечисленных лекарств есть несколько препаратов с универсальным действием: они подходят как и для однократного приема для быстрого снятия приступа панической атаки, так и для длительного приема. Это антидепрессант амитриптилин и нейролептики кветиапин, тиоридазин и сульпирид.
Сравнительный анализ эффективности комплексной фармакотерапии боли при невралгии тройничного нерва
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Лицевые боли (прозопалгии) – одна из наиболее частых причин обращаемости больных к неврологам, стоматологам и врачам других специальностей.
Боли в области лица могут быть вызваны поражением нервного аппарата челюстно-лицевой области (системы тройничного, языкоглоточного нервов, вегетативных узлов и сплетений) или мышечно-суставной дисфункцией при артрозоартрите височно-нижнечелюстного сустава и нарушении соотношения зубных рядов. Кроме того, описаны рино- и офтальмогенные прозопалгии, патогенез которых сложен, однако в конечном итоге реализуется через неврогенные и мышечные механизмы.
В клинической практике среди краниальных невралгий наиболее часто встречается тригеминальная невралгия, или невралгия тройничного нерва (НТН). Распространенность НТН – 45–50 на 100 тыс. населения с пиком заболеваемости на 6-м десятилетии жизни. Патогенез заболевания сложен. Доказано, что пусковым моментом является корешково-сосудистый конфликт в области мостомозжечкового угла, приводящий к сегментарной демиелинизации корешка тройничного нерва. Сочетание демиелинизации корешка с функциональной и/или структурной дефектностью антиноцицептивных регуляторных систем у данного индивидуума может способствовать формированию так называемого «генератора патологической активности» в системе тройничного нерва и служить основой развития клинической картины НТН [5].
Клиническая картина невралгии тройничного нерва
Больные предъявляют жалобы на пароксизмальную боль, сравнимую с ударом электрического тока. Продолжительность болевого пароксизма не превышает 2 мин., хотя больные могут жаловаться на непрерывную боль. Однако при внимательном расспросе удается установить наличие «светлого» безболевого промежутка между приступами.
Характеристика болевого пароксизма:
1. Боль чрезвычайно сильная и при определении ее интенсивности по 10-балльной шкале боли соответствует 8–10 баллам.
2. Рисунок боли в период обострения не изменяется (боль не может перемещаться на противоположную сторону) и соответствует корешково-сегментарной зоне иннервации.
3. Между двумя отдельными приступами всегда имеется безболевой (рефрактерный) период.
4. Наличие триггерных зон – гиперсенситивных участков на коже лица или в полости рта, слабое раздражение которых вызывает типичный болевой приступ. Триггерные зоны наиболее часто локализуются в медиальных отделах лица или на альвеолярных отростках челюстей.
5. Наличие триггерных факторов – действий или условий, при которых возникают типичные болевые пароксизмы. Наиболее часто такими факторами являются: умывание, прием пищи, движения нижней челюсти.
6. Типичное болевое поведение – во время приступа больные «замирают» в той позе, в которой их застал приступ.
7. На высоте приступа могут быть подергивания лицевой мускулатуры.
8. Отсутствие сенсорного дефекта на лице в дебюте заболевания.
При клинико-неврологическом обследовании на стороне боли может быть отмечено снижение вибрационной чувствительности и корнеального рефлекса. Также во время обострения НТН при наличии активных триггерных зон положителен симптом Штернберга – указывая локализацию триггерной зоны, больной не касается лица из-за боязни вызвать приступ.
Течение заболевания хроническое. У 2/3 больных в дебюте отмечаются легкие пароксизмы боли в проекции зубов, что может быть поводом для их удаления, у 1/3 уже в начале заболевания развиваются пароксизмы интенсивной боли, которые продолжаются 2–3 нед. и проходят самостоятельно. Как правило, через полгода или год приступы возобновляются в более тяжелой форме. В развернутой стадии заболевания обострения (периоды интенсивной боли), развивающиеся чаще в холодное время года, продолжаются 4–8 нед., затем стихают, но без адекватного лечения полностью не проходят. В начале заболевания ремиссии (период стихания болей) могут быть спонтанными, однако, как показывает наш клинический опыт, с течением времени их удается достичь только при адекватной терапии.
По мере развития заболевания, вероятно в связи с нарастанием демиелинизирующего процесса в области корешка тройничного нерва, формируется невропатическая стадия невралгии, когда в клинической картине, наряду с пароксизмами боли, отмечается незначительная постоянная боль. В этой стадии при клинико-неврологическом обследовании выявляется постоянный или преходящий сенсорный дефект периферического типа в зоне иннервации второй и/или третьей ветвей тройничного нерва.
Диагностика типичной НТН не представляет значительных трудностей, однако следует помнить, что пароксизмальная прозопалгия может быть симптоматической, т. е. обусловленной патологическими процессами в области мостомозжечкового угла (опухоль вестибуло-кохлеарного нерва, слипчивый оболочечный процесс и др.). В этой связи больные с впервые выявленной НТН в возрасте до 50 лет, а также с наличием в неврологическом статусе симптомов очагового поражения нервной системы нуждаются в МРТ-обследовании головного мозга.
Лечение невралгии тройничного нерва
Лечение боли при НТН до настоящего времени представляет сложную задачу. В 1962 г. С. Блюм предложил лечить невралгию тройничного нерва карбамазепином. В настоящее время, наряду с карбамазепином, применяются и другие противоэпилептические препараты: габапентин, окскарбазепин, прегабалин (Лирика).
Лечение карбамазепином рекомендуется начинать с 50 мг (1/4 стандартной таблетки, содержащей 200 мг карбамазепина) 3 р./сут во время или после еды, запивая достаточным количеством жидкости [3]. Повышать дозу карбамазепина при хорошей переносимости можно на 50 мг ежедневно. Средняя эффективная доза составляет 600–800 мг/сут. Доза считается эффективной, если болевой синдром купирован полностью (раздражение триггерных зон и триггерные факторы не вызывают болевого пароксизма – больной может принимать пищу и безболезненно выполнять гигиенические процедуры умывания и чистки зубов).
Дальнейшее лечение в течение 3–4 нед. проводится с применением индивидуальной эффективной дозы препарата, что позволяет достичь медикаментозной ремиссии. Затем проводится обратное титрование со снижением суточной дозы на 50 мг в течение 5–7 дней. Целью обратного титрования является достижение индивидуальной поддерживающей дозы, которая может составлять от 100 до 400 мг/сут. В дебюте заболевания у части больных (40–60%) удается полностью отменить препарат. Возможно применение пролонгированных фармакологических форм карбамазепина, которые особенно удобны для проведения поддерживающей терапии.
При лечении препаратами карбамазепина следует помнить, что длительное применение больших доз может привести к развитию побочных явлений в виде головокружения, тошноты, атаксии. Описаны случаи апластической анемии. Поэтому, наряду с клиническим контролем развития возможных побочных эффектов препарата, необходимо следить за состоянием периферической крови и печени (общий анализ крови и содержание АСТ и АЛТ каждые 3 мес.).
Примерно у 15% больных карбамазепин неэффективен. Таким больным подбирают противоэпилептические препараты других групп.
В настоящее время сформулированы основные принципы рациональной полифармакотерапии, предполагающие воздействие на основные патогенетические механизмы нейропатической боли при НТН: периферическую и центральную сенситизацию с одновременной активизацией антиноцицептивной системы [5]. В схемах лечения нейропатической боли применяются местные анестетики, блокирующие проведение болевых импульсов на периферическом уровне, что при НТН технически невыполнимо; опиоидные анальгетики, оказывающие центральное действие, и адъювантные анальгетики, к которым можно отнести антидепрессанты, усиливающие ингибирующее влияние антиноцицептивных систем, и противоэпилептические препараты, тормозящие проведение ноцицептивных стимулов на сегментарном и супрасегментарном уровнях. Эффективность препаратов, применяемых в различных комбинациях в предлагаемых схемах, различна [3]. В этой связи изучение эффективности и безопасности применения прегабалина (Лирика) и карбамазепина в комплексном лечении НТН представляется своевременным и актуальным.
Целью настоящего исследования является совершенствование методов комплексного лечения пациентов, страдающих НТН в стадии обострения, посредством сравнительного анализа терапевтической эффективности прегабалина (Лирика) и карбамазепина в комплексном лечении.
Материалы и методы
В настоящее исследование были включены 35 пациентов с НТН. Длительность заболевания – от 2 до 11 лет. Все наблюдаемые находились на амбулаторном лечении в консультативно-диагностическом центре Московского областного научно-исследовательского клинического института им. М.Ф. Владимирского. Возраст больных – от 48 до 63 лет. Критериями включения в исследование были: обострение хронического болевого синдрома не более 2-х нед.
В стандартное комплексное лечение входили витаминотерапия, антиоксиданты, анксиолитики, антидепрессанты и противоэпилептические препараты.
Научным обоснованием применения антидепрессантов являются данные о недостаточности (функциональной и/или морфологической) антиноцицептивных систем. Известно, что антиноцицептивные системы осуществляют ингибирующий контроль сегментарного ноцицептивного аппарата челюстно-лицевой области, расположенного в каудальной части ядра спинального тракта тройничного нерва. Указанные системы, к которым относится околоводопроводное серое вещество, крупноклеточное ядро ствола головного мозга, голубое пятно и др., являются серотонин- и норадреналинергическими и участвуют, наряду с антиноцицептивным контролем, в эмоциональных реакциях человека. Поэтому применение препаратов с агонистическими моноаминергическими свойствами при лечении хронической боли является вполне обоснованным.
Возможно использование антидепрессантов различных фармакологических групп: трициклические (амитриптилин), селективные ингибиторы обратного захвата серотонина (флуоксетин), селективные ингибиторы обратного захвата серотонина и норадреналина, агонисты мелатониновых рецепторов. В нашем наблюдении применялся пипофезин (атипичный трициклический антидепрессант) в дозе 75 мг/сут.
В программу комплексной фармакотерапии НТН были включены противоэпилептические препараты. В зависимости от применяемого комплекса лечения все пациенты были разделены на 2 группы.
Группа 1 (15 человек) получала карбамазепин (средняя суточная доза карбамазепина составила 700±230 мг), группа 2 (20 человек) получала прегабалин (Лирика): 8 пациентов в дозе 450 мг/сут, 12 – 600 мг/сут. В комплексную фармакотерапию пациентов обеих групп входил пипофезин 75 мг/сут.
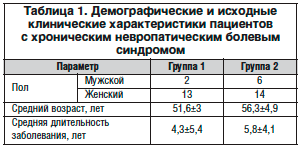
В обеих группах не выявлено достоверных различий по возрастному и половому составу (табл. 1).
У наблюдаемых пациентов с НТН было типичное течение заболевания – обострение начиналось с простреливающих болей в проекции одного или двух зубов, активизации имевших место ранее триггерных зон, которые располагались в медиальной части лица (верхняя губа, крыло носа) или в пародонте зубов. В подавляющем большинстве случаев провоцирующим обострение фактором явились резкое изменение АД, стресс, перепады температур. Далее развивались приступы интенсивной боли. У пациентов имелись активные триггерные зоны, раздражение которых (умывание, еда, бритье) вызывало пароксизм боли.
Результаты
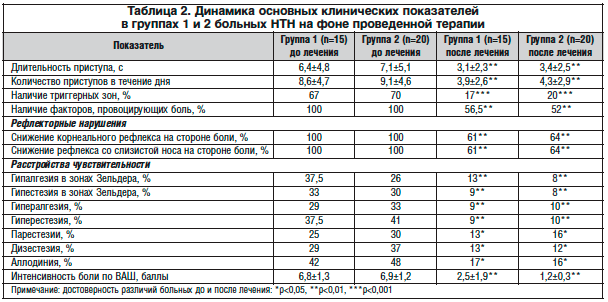
Динамика клинических показателей в группах наблюдения представлена в таблице 2.
Как следует из таблицы 2, в начале наблюдения интенсивность боли по ВАШ в группе 1, в комплексное лечение в которой входил карбамазепин, в среднем составила 6,8±1,3 балла, в группе 2, в комплексное лечение в которой входил прегабалин (Лирика), – 6,9±1,2 балла.
Исходный уровень депрессии по шкале Бека до лечения в обеих группах был достоверно высокий (27 и более баллов) (р 0,1).
Экстероцептивная супрессия произвольной активности височной и жевательной мышц. При регистрации экстероцептивной супрессии (ЭC) произвольной ЭМГ-активности жевательной и височной мышц с обеих сторон как в группе 1, так и в группе 2 достоверных изменений латентного периода (ЛП) и длительностей ЭС1 после лечения обнаружено не было (p>0,1). Основные изменения, выявленные у больных с НТН после курса проведенной терапии, касались параметров поздней ЭС2. В обеих группах больных после лечения наблюдалось достоверное уменьшение величины ЛП и увеличение длительности периода ЭС2 ЭМГ активности височной и жевательной мышц при регистрации как с больной, так и со здоровой стороны, которые, однако, не достигали значений этих параметров, зарегистрированных у здоровых испытуемых (p Литература
Только для зарегистрированных пользователей
Лечение невропатических болевых синдромов в практике врача-невролога
Н.В. ТАРАРОЩЕНКО, заведующий неврологическим отделением Центральной городской больницы № 14 г. Донецка
Пациенты с разнообразными вариантами боли встречаются в нашей практике ежедневно. Как важно для врача после осмотра пациента четко определиться с генезом болевых ощущений, ведь от этого подчас зависит выбор правильного и адекватного лечения.
Врач-невролог, как никто другой, должен хорошо знать, что такое боль и какие ее типы существуют.
Все болевые ощущения подразделяются на две большие разновидности: ноцицептивная (или соматогенная) и невропатическая (или неврогенная).
В определенных случаях имеет место сочетание ноцицептивного и невропатического компонентов боли (при компрессионных радикулопатиях).
Самыми частыми ситуациями, при которых встречается невропатическая боль, являются:
Примеры невропатической боли:
Частота невропатической боли:
Среди всех пациентов с невропатической болью около 50 % составляют больные с диабетической полиневропатией. К сожалению, нередко боли у этих пациентов трактуются как сосудистые или вертеброгенные, что приводит к неадекватным терапевтическим мероприятиям.
Особенностью невропатической боли является ассоциированность со специфическими чувствительными расстройствами:
При гиперальгезии чувствительность к болевому стимулу оказывается значительно выше, чем ожидается в норме.
При гиперпатии субъективный ответ как на болевой, так и неболевой стимул является чрезмерным и часто сохраняется в течение долгого времени уже после прекращения раздражения.
Невралгии (тригеминальная, постгерпетическая) являются типичным примером невропатической боли.
Спонтанная боль возникает при очевидном отсутствии какого-либо внешнего воздействия; как правило, носит жгучий, колющий характер.
Невропатическая боль возникает в результате нарушенного взаимодействия ноцицептивных и антиноцицептивных систем вследствие их поражения или нарушения функций на различных уровнях нервной системы. Наиболее изучена роль периферических нервов, корешков, заднего рога спинного мозга, нейротрансмиттеров боли, глутаматных рецепторов, натриевых и кальциевых каналов.
Возможные механизмы боли включают спонтанную эктопическую активность поврежденных аксонов, сенситизацию болевых рецепторов, патологические взаимодействия периферических сенсорных волокон, гиперчувствительность к катехоламинам.
Центральная сенситизация группы нейронов спинного мозга является результатом нейрональной пластичности, активированной первичной афферентной стимуляцией. Этот процесс считается решающим в формировании синдрома невропатической боли и приводит к развитию аллодинии и гиперпатии.
Вольтажзависимые кальциевые N-каналы расположены в поверхностной пластинке заднего рога спинного мозга и участвуют в формировании невропатической боли. Полагают, что субъединица α2δ, входящая в состав всех вольтажзависимых кальциевых каналов, является мишенью для антиаллодинического действия габапентина.
Методы лечения невропатической боли можно разделить на две большие группы: немедикаментозные и медикаментозные.
Немедикаментозные методы, усиливающие активность антиноцицептивных систем: