карбонат кальция для чего используют
КАЛЬЦИЯ КАРБОНАТ (CALCIUM CARBONATE) ОПИСАНИЕ
Фармакологическое действие
Показания активного вещества КАЛЬЦИЯ КАРБОНАТ
Открыть список кодов МКБ-10
| Код МКБ-10 | Показание |
| E55.0 | Рахит активный |
| K02 | Кариес зубов |
| M80.0 | Постменопаузный остеопороз с патологическим переломом |
| M80.1 | Остеопороз с патологическим переломом после удаления яичников |
| M80.2 | Остеопороз с патологическим переломом, вызванный обездвиженностью |
| M80.4 | Лекарственный остеопороз с патологическим переломом |
| M80.5 | Идиопатический остеопороз с патологическим переломом |
| M80.8 | Другой остеопороз с патологическим переломом |
| M81.0 | Постменопаузный остеопороз |
| M81.1 | Остеопороз после удаления яичников |
| M81.2 | Остеопороз, вызванный обездвиженностью |
| M81.4 | Лекарственный остеопороз |
| M81.5 | Идиопатический остеопороз |
| M81.8 | Другие остеопорозы (старческий остеопроз) |
| M82 | Остеопороз при болезнях, классифицированных в других рубриках |
| R10.1 | Боли, локализованные в верхней части живота |
| R12 | Изжога |
Режим дозирования
У детей для профилактики и лечения рахита и кариеса применяют в суточной дозе 300-600 мг.
Побочное действие
Противопоказания к применению
Применение у детей
Возможно применение у детей по показаниям в рекомендуемых соответственно возрасту дозах и лекарственных формах.
Применение у пожилых пациентов
Возможно применение у пожилых пациентов по показаниям.
Особые указания
При длительном применении в высоких дозах следует регулярно контролировать концентрацию кальция в крови и показатели функции почек.
Кальция карбонат в форме таблеток, предназначенных для лечения и профилактики остеопороза, рахита и кариеса, не рекомендуется применять в качестве антацидного средства.
Лекарственное взаимодействие
При одновременном приеме внутрь возможно замедление абсорбции других лекарственных средств.
При одновременном применении с антибиотиками группы тетрациклина уменьшается концентрация тетрациклинов в плазме крови и снижается их клиническая эффективность.
При одновременном применении с тиазидными диуретиками возникает риск развития гиперкальциемии и метаболического алкалоза.
При одновременном применении с индометацином уменьшается абсорбция индометацина и уменьшается его раздражающее действие на ЖКТ.
При одновременном применении уменьшается клиническая эффективность левотироксина.
Польза и вред карбоната кальция
Пищевая добавка карбонат кальция обозначается как Е 170 и в природе встречается в виде привычного мела. Вещество относится к неорганическим пигментам и используется в пищевой промышленности, медицине, строительстве, других отраслях.
Карбонат кальция не растворяется в воде и спирте, обладает свойствами разрыхлителя, антиокислителя, красителя. В материале разберем, какую пользу несет вещество и ознакомимся с оптимальными дозировками, чтобы исключить опасные побочные эффекты.
Состав пищевой добавки Е 170
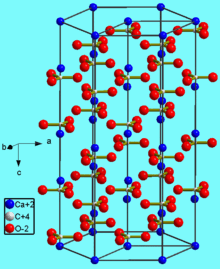
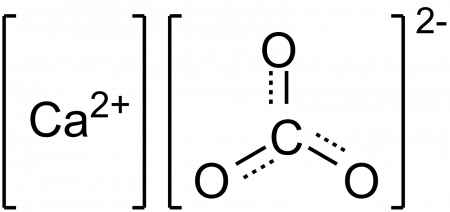
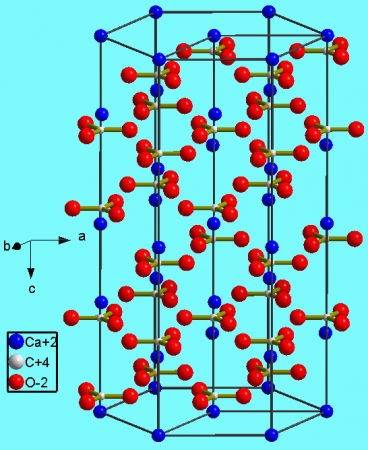
Химическая формула добавки Е 170 — CaCO3. Очищенный мел поступает в продажу в форме белого порошка мелкой фракции. Источником карбоната служит мрамор. Также соль угольной кислоты присутствует в панцирях ракообразных и моллюсков.
Где добывают карбонат кальция?
Для изготовления промышленной добавки Е 170 берут природное сырье, которое содержится в минералах: ватерите, арагоните, кальците. Источником углекислого кальция также служат мрамор, известняк, мел. Сырье перерабатывают и очищают от примесей перед продажей. Наиболее ценен карбонат кальция, полученный из мрамора.
Ведущие производители добавки — 10 европейских компаний, включая Omya (Швейцария) и Imerys (Франция). С начала XXI века заводы по переработке углекислого кальция действуют в Китае. Свои меловые месторождения есть и в России. Карбонаты добывают в Белгородской и Воронежской областях. Промышленным производством занимаются предприятия АО «Мелстром», ООО «Воронежглавмел» и ОАО «Клинцевский силикатный завод».
Краситель Е170 (карбонат кальция) — вреден или нет?
Потребляемый в разумных дозировках карбонат кальция вред организму не наносит. По этой причине пищевой краситель разрешен к применению в России. При превышении суточной нормы вещество может вызвать отравление, симптомами которого становятся:
Избежать этих неприятных последствий помогает соблюдение дозировки.
В сутки медики рекомендуют применять взрослому человеку не более 1,2–1,5 г карбоната кальция.
Применение карбоната кальция в промышленности
Углекислый кальций используется сразу в нескольких отраслях промышленности.
Кроме того, вещество используется при производстве очистных сооружений и фильтров, а также в сельском хозяйстве — для восстановления кислотности грунта.
Применение в продуктах питания
Природный карбонат кальция применим в кулинарии как натуральный пищевой краситель, разрыхлитель, регулятор кислотности, наполнитель.
Также вещество предупреждает слеживание и комкование сыпучих изделий.
Карбонат кальция встречается в составе молочных и молочнокислых продуктов: сыра, сгущенки, сливок, йогуртов. Также полезную добавку используют при приготовлении детского питания, консервов, шоколадных плиток.
Польза и вред карбоната кальция для организма
Как мы уже выяснили, карбонат кальция не несет вреда организму. Доказательством тому служит использование в фармацевтике: вещество присутствует в БАДах и витаминных препаратах, направленных на устранения дефицита кальция.
Польза Е 170 очевидна: вещество поддерживает жизнедеятельность организма, стабилизирует кровяное давление, стимулирует работу сердечной мышцы, отвечает за свертываемость крови и формирование костных структур.
Для лучшего усвоения карбонат кальция рекомендуется употреблять совместно с витамином D.






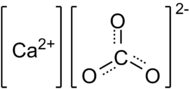


 . В природе встречается в виде минералов — кальцита, арагонита и ватерита, является главной составной частью известняка, мрамора. Нерастворим в воде и этаноле.
. В природе встречается в виде минералов — кальцита, арагонита и ватерита, является главной составной частью известняка, мрамора. Нерастворим в воде и этаноле.