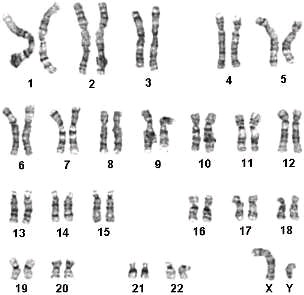
кариотип 46 хх у женщины что означает после замершей беременности
Инверсия пола 46 XX
OMIM 400045
Наша команда профессионалов ответит на ваши вопросы
46,ХХ инверсия пола характеризуется наличием мужского фенотипа (с полной или неполной маскулинизацией), наличием тестикулярной ткани при отсутствии в кариотипе Y-хромосомы. При этом данное нарушение формирования пола может быть обусловлено либо наличием синдрома «46,ХХ-мужчина» либо овотестикулярной формой нарушения формирования пола (истинный гермафродитизм). 46,ХХ инверсия пола может быть связана с наличием фрагмента Y-хромосомы и/или скрытого мозаицизма по Y-хромосоме (Y-позитивная форма) либо с аутосомными или Х-сцепленными мутациями (Y-негативная форма).
46,ХХ инверсия пола тип 1 (OMIM 400045)
В большинстве случаев ХХ-инверсия пола является результатом транслокации небольшого фрагмента короткого плеча Y-хромосомы, несущего ген SRY (OMIM 480000; Yp11.3), на Х-хромосому или аутосому. Нарушение формирования пола является врожденным состоянием, при котором наблюдается полное или частичное аномальное развитие и строение половых желез, внешних половых признаков, обусловленное аномалиями строения половых хромосом. У пациентов с истинным гермафродитизмом гистологически могут быть обнаружены как зрелые ткани яичников с фолликулами, так и яичек с семенными канальцами.
Ключевую роль в детерминации мужского пола и в дифференцировке яичек связана с геном SRY (Sex-determining region Y chromosome). Делеции или точковые мутации этого гена приводят к развитию «чистой» формы дисгенезии гонад при кариотипе 46,XY (синдром Свайера), тогда как его присутствие в геноме больных с 46,ХХ инверсией пола (синдром де ля Шапеля или синдром «46,ХХ-мужчина») обуславливает развитие по мужскому типу, а у больных с мозаицизмом по хромосоме Y, в том числе при синдроме Шерешевского-Тернера – с наличием и выраженностью маскулинизации и/или двойственного полового развития.
Ген SRY расположен на коротком плече Y-хромосомы в непосредственной близости к PAR1 региону, области гомологичной конъюгации хромосом Х и Y, происходящей в сперматогенезе. В процессе мейотического обмена между Х- и Y-хромосомами участок Y-хромосомы, содержащий ген SRY, может быть транслоцирован на Х-хромосому, что может привести к образованию сперматозоидов с перестроенными (дериватными) хромосомами: с Y-хромосомой, утратившей ген SRY, и Х-хромосомой, несущей этот ген. При оплодотворении такими гаметами яйцеклетки, соответственно, возможно рождение мужчин с кариотипом 46,ХХ с транслокацией гена SRY и женщин с кариотипом 46,XY, но с делецией гена SRY. Так, 85-90% больных с ХХ инверсией пола имеют в геноме небольшую часть короткого плеча Y-хромосомы, невидимую при стандартном цитогенетическом исследовании. Последовательности Y-хромосомы у таких больных транслоцированы, как правило, на Х-хромосому, реже на одну из аутосом, унаследованных от отца. Транслоцированный участок Y-хромосомы при этом содержит ген SRY. В редких случаях может встречаться скрытый мозаицизм по Y-несущему клону (например, 46,ХY), о чем свидетельствует наличие локусов SRY, AMGL и других Y-специфичных маркеров.
Для идентификации в геноме последовательностей Y-хромосомы, а также выявления делеции гена SRY, используется метод мультиплексной полимеразной цепной реакции (мПЦР), позволяющий исследовать наличия данного гена, а также гена амелогенина (AMG, AMELX), локализованного на коротком плече Х-хромосомы и его гомолога, локализованного на коротком плече Y-хромосомы (AMGL / AMELY). Для анализа наличия точковых мутаций гена SRY – прямое секвенирование его кодирующей последовательности.
С целью анализа количественных аномалий (анеуполидий) и некоторых структурных аномалий половых хромосом, а также гоносомного мозаицизма и химеризма, может быть использован метод количественной флюоресцентной ПЦР.
46,ХХ инверсия пола тип 2 (ОMIM 278850)
Данный тип ХХ-инверсии пола вызван дупликацией регуляторной области гена SOX9. Ген SOX9 располагается на длинном плече хромосомы 17 в локусе q24.3. Кодируемый геном белок является транскрипционным фактором, играющим важную роль в процессе эмбрионального развития. Особенно важен данный белок для развития скелета и репродуктивной системы. Дупликации локуса 17q24 приводит к увеличению числа копий гена SOX9, что у плодов с кариотипом 46,ХХ вызывает дифференцировку гонад по мужскому типу и развитие тестикул в отсутствие гена SRY и других генов Y-хромосомы (SRY-негативная ХХ-инверсия пола). При этом в большинстве случаев дупликаций гена SOX9 не происходит формирования нормальных тестикул, что ведет к овотестикулярной форме нарушения формирования пола (истинный гермафродитизм).
Точковые мутации в гене SOX9 у пациентов с кариотипом 46,ХХ и 46,ХY приводят к развитию кампомелической дисплазии (OMIM 114290) – заболеванию, которое влияет на развитие скелета и репродуктивной системы и часто является угрожающим жизни состоянием в период новорожденности. Пациенты с кариотипом 46,ХХ и точковыми мутациями в гене SOX9 имеют дисгенезию гонад без инверсии пола (фенотипически женщины), а у пациентов с кариотипом 46,XY дисгенезия гонад приводит к XY – инверсии пола или двойственному развитию половых органов.
В Центре Молекулярной Генетики проводится анализ ключевых генов, контролирующих дифференцировку пола: с помощью количественного метода MLPA проводится поиск делеций и дупликаций генов SRY и SOX9.
46,ХХ инверсия пола тип 3 (ОMIM 300833)
Данная форма ХХ-инверсии пола вызвана дупликацией гена SOX3 или делецией его негативно-регуляторной области. Ген SOX3 (sex determining region Y-box 3) является Х-сцепленным гомологом гена SRY, располагается на длинном плече Х-хромосомы в локусе Xq27.1 и подвержен Х-инактивации. Кодируемый им белок является членом семейства SOX (SRY-related HMG-box) – транскрипционных факторов, вовлеченных в контроль дифференцировки различных типов клеток, а также в регуляцию формирования головного мозга в ходе эмбрионального развития, развитие гипоталамо-гипофизарной системы. Он поддерживает недифференцированное состояние у нервных клеток, противодействуя влиянию факторов, стимулирующих их специализацию. Также наличие данного белка необходимо для инициирования формирования пола по мужскому типу. В дифференцирующихся тестикулах белок SOX3 поддерживает дифференцировку и развитие предшественников ‘поддерживающих клеток’ бипотенциальных (индифферентных) гонад в клетки Сертоли, а не в клетки гранулезы овариальной ткани.
Мутации, делеции или дупликации гена SOX3 являются причиной X-сцепленного гипопитуитаризма, некоторых форм аномалии развития нервной трубки (септо-оптической дисплазии), а также X-сцепленной умственной отсталости с изолированным дефицитом гормона роста. Дупликации Xq26-q27, включающие ген SOX3, являются одной из причин SRY-негативной ХХ-инверсии пола (46,ХХ тестикулярной и овотестикулярной форм нарушения формирования пола). Описано несколько случаев ХХ-инверсии пола, вызванных микродупликациями и микроделециями в локусе Xq27.1. При этом спектр фенотипических проявлений (от бесплодия при нормальном мужском фенотипе до аномалий развития пола, микроцефалии с задержкой умственного развития) зависел от локализации и размера перестройки.
Невынашивание беременности
Если вы посетили эту нашу страницу, значит вы в поиске ответов на болезненный сегодня для вас вопрос — почему внутриутробно погиб ваш не родившийся малыш, почему это происходит не впервые, кто виноват и, главное, что делать?
Возможно, вы уже прошли дорогостоящие длительные дополнительные медицинские обследования, но так и не получили ответ на ваш вопрос. Возможно, вы в настоящий момент готовитесь к выскабливанию. В любом случае, мы готовы помочь вам и вашему врачу в решении проблемы.
Мы поможем вам не только установить причины случившегося, но и ответить совместно с вашим персональным врачом на следующие вопросы:
— может ли это повториться в будущем?
— а что же действительно делать, чтобы этого избежать?
— каков путь лечения и будет ли результат?
— каков путь в планировании и ведении следующей беременности?
К сожалению, 90% наступающих беременностей — это спонтанные беременности, и, несмотря на убеждение пары, что беременность якобы спланирована, необходимый объем предшествующего планового обследования пары зачастую не проходят. А ведь многих проблем можно было избежать. Среди многообразия причин «первую скрипку» в неудачах зачатия и вынашивания беременности играют именно генетические, а зачастую – наследственные факторы.
Несмотря на стремительное развитие клинической генетики, расширения информационного поля этой сферы, все ещё ни пациенты, ни врачи не готовы воспользоваться, да и попросту не знают о современных и уже абсолютно доступных молекулярных лабораторных методах постановки диагноза.
Не всегда абортивный материал подвергается хотя бы классическому цитогенетическому анализу, а если это и происходит, то сам метод несет в себе множество безрезультативных неудач.
Что необходимо знать парам, столкнувшимся с невынашиванием беременности?
Что же в сущности стоит за такой статистикой? Принято считать, что даже при очень хороших условиях для зачатия максимальная вероятность наступления беременности в менструальном цикле не превышает 40%. 60 же процентов приходятся на доклинические потери (то есть, еще до наступления беременности). После того, как произошел это первичный фильтр, шансы на удачную беременность резко возрастают и 80% наступивших беременностей прогрессируют, а 20% — завершаются самопроизвольным прерыванием развития беременности. Беременность либо замирает, либо происходит самопроизвольный выкидыш. Большая часть прервавшихся беременностей — до 80% — приходится на I триместр гестации. И самая частая причина для этого — патологический генетический статус эмбриона, присутствие того или иного не совместимого с развитием и жизнью дефекта в его генетическом материале.
Невынашиванием беременности принято считать самопроизвольное её прерывание на любых сроках от момента зачатия до полных 37 недель беременности. Невынашивание беременности может идти по двум сценариям: самопроизвольный выкидыш и неразвивающаяся (замершая) беременность. Отличает неразвивающуюся беременность от самопроизвольного выкидыша лишь факт отсутствия самостоятельного опорожнения полости матки в первом случае, и тогда пациентка направляется на медицинский аборт.
Риск невынашивания беременности увеличивается с возрастом женщины: от около 5% в возрасте 20 лет и до практически 50% для возрастных групп женщин за пределами 35-40 лет.
Наиболее достоверно доказана связь ранней потери беременности с двумя факторами — старший и поздний репродуктивный возраст матери; большое число предыдущих выкидышей. И чем больше эпизодов невынашивания беременности, тем хуже прогноз для последующего зачатия: риск очередной потери после двух предшествующих потерь достигает 29%, после трёх — 33%.
Какие генетические причины приводят к замершим беременностям и самопроизвольным выкидышам?
Одна из основных причин невынашивания беременности — это хромосомный дисбаланс у плода. В большинстве случаев такой хромосомный дисбаланс — событие случайное и от него никто не застрахован. Однако частота возникновения хромосомных нарушений прямо пропорциональна возрасту беременной, воздействию вредных внешних факторов, зависит от присутствия какой либо генетической патологии у близкого окружения родства и ряда других факторов.
Не стоит забывать и о том, что следствием некоторых форм такого хромосомного дисбаланса в дальнейшем могут стать также тяжелые заболевания у самой женщины, потерявшей беременность, в том числе онкологические.
Количественные аномалии:
Трисомия аутосомных хромосом — наличие в хромосомном наборе трех гомологичных хромосом вместо двух. Большинство трисомий аутосомных хромосом летальны для плода. А примерами жизнеспособных трисомий являются синдромы Дауна, Эдвардса, Патау.
Моносомия аутосомных или половых хромосом — отсутствие в хромосомном наборе одной из парных хромосом. При моносомии по любой из аутосом нормальное развитие эмбриона невозможно. Единственная совместимая с жизнью моносомия у человека — это моносомия по половой хромосоме X — приводит к развитию синдрома Шерешевского—Тернера (45,Х0).
Триплоидия — наличие в хромосомном наборе дополнительного гаплоидного набора хромосом. Триплоидии — летальны для плода.
Полисомия половых хромосом — наличие в хромосомном наборе дополнительных половых хромосом вместо двух. Пример — синдром Клайнфельтера — наличие одной или нескольких дополнительных Х- или У-хромосом у мужчин.
Делеция — утрата фрагмента ДНК в пределах определенного локуса, гена хромосомы.
Дупликация — напротив, увеличение хромосомного материала, удвоение участка хромосом.
Размеры делеций и дупликаций могут быть разными — от крупных, доступных современным микроскопам, до микроделеций и микродупликаций, которые можно обнаружить только современными молекулярными методами с высоким разрешением.
Транслокации — обмен участками между двумя парами гомологичных или не гомологичных хромосом.
Инсерции — вставки генетического материала в хромосому.
Инверсии — поворот участка хромосом на 180 градусов в пределах одной хромосмы.
Наиболее частыми причинами потери беременности из числа количественных нарушений в наборе хромосом являются:
— полные аутосомные трисомии (как по одной паре хромосом, так и двойные, тройные трисомии). На их долю приходится около 60% всех известных генетических причин гибели плода
— полиплоидия (до 15-20%%), чаще всего — триплоидия
— моносомия Х хромосомы ( до15%).
Реже причиной замершей беременности могут стать нарушения в структуре хромосом, сочетание различных таких аберраций:
— Транслокации. Несбалансированная хромосомная перестройка (непропорциональный обмен участками между хромосомами с нарушение количественного и качественного баланса хромосомного материала) у плода может закончиться самопроизвольным абортом или привести к появлению ребенка с врожденными дефектами и/или умственной отсталостью. Этот вид перестройки возникает тогда, когда родители являются носителем сбалансированной хромосомной перестройки (без изменения количества хромосомного материала). И тогда вслед за исследованием ДНК плода потребуется дополнительное обследование хромосомного материала родителей, для того, чтобы избежать потери беременности в следующий раз.
Как диагностировать генетический дефект в случае регресса беременности?
Для этого, прежде всего, необходимо исследовать абортивный материал в условиях генетической лаборатории.
К сожалению, не всегда супружеская пара, столкнувшаяся с необъяснимой причиной прервавшейся беременности, оказывается в кабинете генетика, чтобы получить профессиональную «направляющую» в последующем обследовании и попытаться установить эти причины и получить рекомендации в отношении следующей беременности.
Тем не менее, если вы столкнулись с проблемой невынашивания, обсудите с вашим врачом возможность генетического обследования. И сделать это вы можете в нашем центре, где мы не только быстро и точно проведем сам лабораторный анализ, но сопроводим вас и вашего врача консультированием до его проведения и после полученных результатов.
Показания для исследования абортивного материала
— в анамнезе уже имеются два и более эпизода самопроизвольного аборта или замершей беременности
— если при предыдущем выкидыше или медицинском аборте уже выявлялась хромосомная патология у плода
— у одного из супругов ранее было выявлено носительство хромосомного дисбаланса или наследственных заболеваний
— если в семье уже имеется ребенок с хромосомной патологией или врожденными пороками развития
И даже в случае первой неудачной беременности вы можете узнать больше о причинах гибели плода.
Какой бы из известных методов лабораторного анализа абортивного материала вам не будет назначен, суть его заключается в оценке кариотипа погибшего плода на предмет отклонений в его хромосомном материале. В ходе последующей оценки карты кариотипа устанавливается тип хромосомного дефекта, место его локализации и ассоциация этого дефекта с патологическим эффектом потери беременности.
Какой лабораторный метод выбрать?
Мы оптимально подберем вам метод исследования, исходя из вашего конкретного клинического случая. Нам неважно, на каком отдалении от нашей лаборатории вы находитесь, в каком регионе России вы проживаете. Наши логистические возможности позволят доставить ваш биологический материал из любого города и в том преаналитическом состоянии, которое нам необходимо для осуществления исследования.
В настоящее время существуют различные методы анализа кариотипа: от появившихся в лабораторной практике давно и ставших стандартным рутинным анализом, до инновационных молекулярных современных генетических тестов, обладающих невероятно высокой точностью и скоростью производства.
Возможности нашей лаборатории — методы последних поколений, которые исключают недостатки и неточности стандартизованных рутинных методов. В одном клиническом случае можно ограничиться таргетным (целевым) исследованием отдельных хромосом, дефекты в которых встречаются с наибольшей частотой. В другом случае мы порекомендуем вам полногеномный метод молекулярного кариотипирования (то есть, исследующий полностью все хромосомы и на все известные своей клинической значимостью дефекты, даже самые мельчайшие, недоступные современным микроскопам).
Почему мы не исследуем абортивный материал стандартным цитогенетическим методом?
Стандартный цитогенетический анализ кариотипа — метод, давно использующийся в отечественных цитогенетических лабораториях. Однако с появлением и бурным развитием более современных методов генетической диагностики — молекулярно-цитогенетических, молекулярно-генетических, которые превосходят по своей точности и диагностической значимости в 100-1000 раз, стандартное кариотипирование можно считать устаревшим по отношению к более современным и востребованным технологиям. Тем более, что стоимость молекулярных методов не намного превышает классический цитогенетический.
Цитогенетический анализ кариотипа осуществляется методом микроскопии, то есть с использованием различных модификаций микроскопов, различных алгоритмов обработки и подготовки препаратов абортивного материала для обеспечения визуализации хромосомного материала, различной степени подготовки и профессионализма цитогенетиков, оценивающих полученный результат. То есть так или иначе присутствует определенный эффект субъективизма в оценке и трактовке, а значит и не исключен процент ложных результатов.
Недостатки
Данный метод кариотипирования возможен только при условии доставки в лабораторию «живых» клеток материала, способных к делению. Отсюда — сложности в транспортировке с соблюдением особых условий, затруднения при доставке из отделенных регионов, удорожание транспортной услуги из-за особых преаналитических требований, длительное время для деления клеток (период исследования составит от 15 до 26 дней).
Другой вопрос — возможные и отнюдь не редкие случаи ложных результатов из-за невозможности данным методом исключить контаминацию материнским генетическим материалом исследуемый образец. Зачастую кариотип матери выдается за кариотип плода. А поскольку кариотип матери не отклонен от нормы, причина не будет установлена.
Образец может быть загрязнен и другим биологическим материалом, всё зависит от условий, в которых отбирался образец абортивного материала.
При неблагоприятном стечении перечисленного выше — шанс установить причину упущен, абортивный материал просто утилизирован.
И наконец, ограничения диагностической ценности метода из-за его низкой разрешающей способности (что может, а что не может выявить метод). Метод в 100% выявит анеуплоидии (численные отклонения в наборе хромосом), установит пол плода ( при наличии в кариотипе Y хромосомы — мужской пол), и может увидеть, что потерян крупный фрагмент/участок хромосомы, либо появился такой же большой дополнительный фрагмент. Огромное количество микроперестроек, которые также могут привести к серьезным последствиям — потеря беременности, рождение ребенка с тяжелым хромосомным заболеванием, остаются за пределами возможности данного метода.
Наша альтернатива — молекулярное кариотипирование на микроматрицах — шанс за одно исследование быстро, достоверно, без «осечек» либо найти причину, либо исключить.
КРЕДО — тест первой линии в диагностике причин невынашивания беременности — ускорен, автоматизирован, точен, достоверен, удобен, доступен по цене.
Тест, который устранил недостатки иных методов.
Тест, который объединил в себе требуемые диагностические цели.
Тест, который прошел многолетнюю практику после первой клинической апробации и набрал достоверную статистику.
Тест, который исключит лишние затраты на диагностику и подчас безрезультативное лечение, а стало быть оптимален с точки зрения экономии средств.
Тест, который не заставит вас волноваться по поводу возможной «лабораторной неудачи» или «лабораторной ошибки»
Тест, который доступен из любого региона.
Тест, который устроит вашего врача своими диагностическими и полезными возможностями, реально поможет вам в борьбе с невынашиванием.
КРЕДО — тест первой линии в диагностике причин невынашивания беременности.
Неоспоримые преимущества
О технологии молекулярного кариотипирования
Мы осуществляем молекулярный анализ хромосомного материала на основе технологии aCGH- сравнительной геномной гибридизации на микроматрицах. Использование нескольких форматов таких однонуклеотидных микроматриц позволяет нам обеспечить полногеномное покрытие (одновременно исследуются все хромосомы) и добиться определенных поставленных целей исследования с фокусированием на наиболее значимых синдромных областях и около 1000 функционально значимых генах.
В основе метода — автоматизированный анализ CNVs / SNPs после гибридизации проб ДНК пациента и референсной ДНК на микрочипе. Микрочип — это изготовленная промышленным способом микроматрица с иммобилизованной ДНК, содержащая геномные фрагменты, с известными нуклеотидными последовательностями. Каждый фрагмент — это зонд/маркер/различны по длине и специфичности. Определенный тип микрочипа используют под определенные задачи в зависимости от присутствующих на платформе маркеров.
Что можно выявить с помощью тестов КРЕДО:
В 100% все анеуплоидии по всем хромосомам
Все клинически значимые известные делеции/ дупликации в пределах разрешающих характеристик микроматрицы, включая субмикроскопические дефекты.
Контаминацию материнскими клетками
Тесты имеют ограничения
— Нельзя выявить сбалансированные структурные перестройки
— Точечные мутации генов
— Мозаицизм низкого уровня Перейти к выбору исследований
Кариотипирование супругов. Анализ на кариотип
Кариотип и кариотипирование супругов
Кариотипирование супругов – это углубленное лабораторное обследование для выявления изменений кариотипа, которое сдает пара в тех случаях, когда необходимо понять причину бесплодия, невынашивания беременности, а также заранее исключить генетические проблемы перед протоколом ЭКО и планированием беременности.
Кариотип – хромосомный набор человека с совокупностью признаков. Генетический фактор занимает достаточно большой процент среди супружеских пар с бесплодием, невынашиванием беременности, а также в группах мужчин с тяжелым нарушением сперматогенеза.
Анализ на кариотип сдают один раз в жизни. Поскольку это важный генетический анализ, то рекомендуется сдавать в специализированных центрах. В нашей лаборатории кариотипирование проводят высококвалифицированные лабораторные генетики. Анализируется материал всех 23 пар хромосом. Результат выдается согласно международной цитогенетической номенклатуре.
В норме результаты кариотипа выглядят следующим образом:
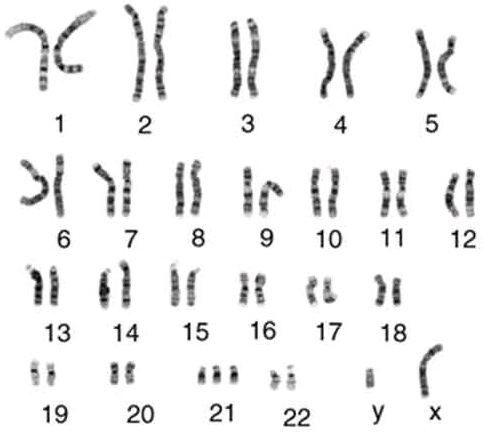
46, XX – нормальный женский кариотип;
46, XY – нормальный мужской кариотип.
Изменения кариотипа могут представлять собой изменения количества хромосом (анеуплоидии) либо структуры хромосом (или аберрации: транслокации, инверсии и др.). Внешне здоровый человек может быть носителем хромосомных аномалий, которые могут являться причиной бесплодия, невынашивания беременности или рождения у супружеских пар детей с пороками развития.
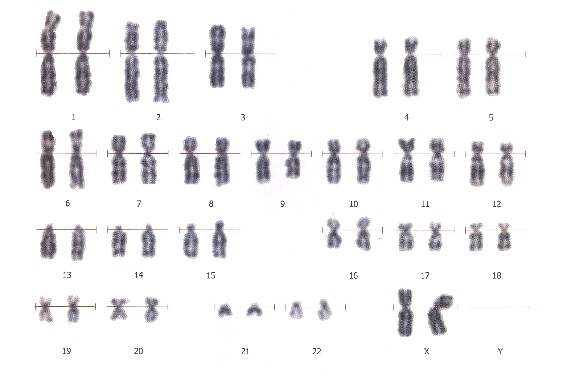
46, XX – нормальный женский кариотип 46, XY – нормальный мужской кариотип
46, XY, +21 – дополнительная хромосома 21 (синдром Дауна)
Классическим методом определения кариотипа является цитогенетический. Также этим методом выполняют кариотипирование супругов. Метод основан на культивировании клеток крови с последующим приготовлением и фотографированием препаратов окрашенных хромосом. Метод ХМА представляет собой современную молекулярную технологию исследования кариотипа и показан при задержке развития и роста человека, наличием врожденных пороков развития (ВПР) у детей, аутизме, подозрении на микроделеционные синдромы.
В Лаборатории ЦИР кариотипирование супругов проводят цитогенетическим методом:
Что такое аберрации?
Почему экспертного уровня?
Мы являемся одной из немногих клиник, работающих более 20 лет в области репродукции. В нашей лаборатории цитогенетики кариотипирование проводится специалистами высокого уровня, где идет просмотр каждой хромосомы.
Как сдать анализ на кариотип. Подготовка.
Смотрите также:
«Замершая» беременность: каковы причины? Какое значение имеет генетический фактор в развитии «замершей» беременности?
Анализ на кариотип (кариотипирование). Как интерпретировать анализ на кариотип? Отвечает Гузов И.И.
ГЕНЫ и БЕРЕМЕННОСТЬ. Генетические причины невынашивания беременности.
Мозаичность кариотипа
Выявление мозаицизма кариотипа зависит от процентного содержания его (если есть) в кариотипе и от выбранной методики анализа. Однозначно при ХМА более вероятно обнаружение мозаицизма в пределах разрешающей способности (наличие более 25% в кариотипе). Также можно обнаружить мозаицизм при наличии его в исследуемых клетках в Определении кариотипа с аберрациями цитогенетическим методом. В связи с ограничениями цитогенетического метода если процент мозаицизма мал, то, скорее всего, его можно не увидеть.
Хромосомный микроматричный анализ (ХМА)
Однако для диагностики ряда заболеваний, связанных с хромосомными аномалиями, существует более современная технология исследования кариотипа – хромосомный микроматричный анализ. Анализ на кариотип выполняется молекулярно-генетическим методом aCGH (микроматричная сравнительная геномная гибридизация), который в отличие от классического цитогенетического метода, имеет высокую разрешающую способность, позволяющую обнаружить более мелкие структурные изменения кариотипа.
Методы диагностики хромосомной патологии