карнозин что это развод
Карнозин что это развод
Окислительный стресс. Патогенез большинства заболеваний включает избыточную активацию свободно-радикальных процессов, нарушение функционирования систем антиоксидантной защиты, что неизбежно приводит к формированию в организме окислительного стресса (ОС). Механизмы формирования ОС при разных патологиях довольно универсальны и связаны, в первую очередь, с нарушением гомеостаза и окислительно-восстановительных процессов. Основными мишенями повреждения в организме в условиях ОС являются молекулы белков, липидов и нуклеиновых кислот, которые подвергаются окислительной модификации и в дальнейшем, как правило, не способны выполнять свои функции. В связи с этим поиск и разработка способов коррекции окислительного стресса являются крайне актуальной проблемой современной медицины. Один из способов, который может быть эффективен в клинических условиях, заключается в применении веществ, обладающих широким спектром антиокислительного действия, так называемых антиоксидантов.
Классификация антиоксидантов. До сих пор не существует единой классификации антиоксидантов, что во многом обусловлено их большим разнообразием, различиями химической структуры и молекулярных механизмов, благодаря которым обеспечивается антиоксидантная защита биомолекул. Антиоксиданты могут быть донорами протонов, хелаторами ионов металлов переменной валентности, могут предотвращать развитие цепных окислительных процессов, локально снижать концентрацию кислорода и предотвращать его включение в окисление, переводить перекиси в стабильные продукты окисления, инактивировать свободные радикалы и др. [15]. Чаще всего антиоксидант обладает каким-либо преимущественным механизмом действия в организме, хотя зачастую обеспечивает свой эффект благодаря одновременному влиянию на разные звенья метаболизма по нескольким механизмам.
Условно выделяют две основные группы антиоксидантов: природные и синтетические. Существуют также вещества – синергисты, которые обладают низким антиоксидантным эффектом, но способны усиливать эффект других антиоксидантов (к ним можно отнести, например, лимонную и никотиновую кислоты). Группа природных антиоксидантов самая многочисленная и включает вещества, выделенные из растительных и животных тканей. На растительных компонентах основаны многие биологически активные добавки, обладающие антиоксидантными свойствами. Они составляют существенную часть фармакологического рынка. К природным антиоксидантам относятся также ферменты (супероксиддисмутаза, каталаза, глутатионовая система и др.), неферментные соединения – белки (альбумин, трансферрин, ферритин, лактоферрин, церулоплазмин), низкомолекулярные соединения (витамины Е и С, убихинон, билирубин, мочевая кислота, стероидные гормоны и др.). К группе синтетических антиоксидантов относятся многие лекарственные препараты, тормозящие или блокирующие процессы свободнорадикального окисления, такие, например, как дибунол, эмоксипин, пробукол и др.
По способности растворяться в разных средах различают гидрофильные (аскорбиновая и мочевая кислоты, цистеин, карнозин и др.) и липофильные (токоферолы, ретинол, билирубин и др.) антиоксиданты. Существует деление антиоксидантов по принципу их действия: антиоксиданты прямого действия обладают непосредственными антирадикальными свойствами, которые можно обнаружить в тестах in vitro. У антиоксидантов косвенного действия антиоксидантный эффект является опосредованным и проявляется в результате их влияния на синтез и превращение жизненно-важных биологически активных веществ (ферментов, витаминов, гормонов и др.).
Выбор антиоксидантов для использования в медицине. Накоплен обширный экспериментальный и клинический материал по использованию антиоксидантов. В медицине главным образом их используют в качестве дополнительных средств к базовой терапии. Многие лекарственные препараты кроме основного терапевтического эффекта проявляют и антиоксидантные свойства, как, например, гепатопротекторы (карсил, легалон, гептрал и др.), препараты, используемые при лечении сердечно-сосудистой и неврологической патологии (мексидол, эмоксипин, актовегин, кортексин, реамберин и др.). Однако в зависимости от условий и концентрации антиоксиданты могут проявлять и противоположное антиоксидантному – прооксидантное – действие. Известно, например, что каротины являются полиненасыщенными соединениями, поэтому сами могут окисляться по радикальному механизму и выступать в качестве прооксидантов. В определенных условиях, например, в присутствии ионов металлов переменной валентности, прооксидантный эффект проявляет аскорбат. Витамин Е как антиоксидант наиболее эффективен в комплексе с другими жиро- и водорастворимыми восстановителями (аскорбиновой кислотой, убихиноном, флавоноидами), в отсутствие которых он быстро инактивируется или переходит в токофероксильный радикал, способный инициировать новые цепи окисления ненасыщенных липидов, то есть тоже становится прооксидантом [15].
Выбор конкретного антиоксиданта, точные показания и противопоказания к его применению пока недостаточно разработаны для каждого конкретного заболевания. Нет информации о взаимодействии лекарственных средств природного происхождения с синтетическими препаратами. Кроме того, антиоксиданты могут вызывать аллергические реакции, обладать токсичностью, проявлять низкую эффективность, не всегда поддаются стандартизации, сохраняется также возможность их передозировки и т.д. Поэтому поиск веществ с максимальным антиоксидантным действием и минимальными побочными эффектами в условиях ОС продолжается и остается важной проблемой. В идеале анитоксидант должен проявлять выраженное антиоксидантное действие в широком диапазоне концентраций, быть природным, гидрофильным, обладать хорошей биодоступностью, быть нетоксичным и не образовывать токсичных продуктов при взаимодействии с активными формами кислорода, не оказывать негативных эффектов в случае передозировки, иметь хорошую совместимость с другими препаратами.
Основные свойства карнозина. Многочисленные литературные источники, а также собственный опыт работы, позволяют предполагать, что антиоксидант карнозин – природный дипептид β-аланил-L-гистидин – отвечает практически всем требованиям, предъявляемым к идеальному антиоксиданту. Он синтезируется и содержится в мышечной и нервной ткани человека, легко усваивается и проникает через гематоэнцефалический барьер, обладает высокой биодоступностью и мембраностабилизирующим действием, относится к низкомолекулярным гидрофильным антиоксидантам прямого действия, хотя способен оказывать и опосредованное влияние на систему антирадикальной защиты организма [3]. Об опосредованном действии карнозина свидетельствуют, в частности, результаты экспериментов, проведенных на крысах, которые показали, что карнозин ускоряет метаболизирование кортизола и норадреналина, высвобождающихся в кровь животных при стрессе [42]. Снижение уровня гормонов стресса в крови опосредованно приводит к снижению выраженности ОС. Кроме того, у карнозина не выявлено побочных эффектов, к нему нет привыкания, нет опасности его передозировки, он не накапливается в организме при длительном применении, так как его избыток подвергается расщеплению ферментом карнозиназой на составляющие аминокислоты, которые легко выводятся из организма [3].
Первые положительные биологические эффекты карнозина объясняли его рН-буферными свойствами, однако после выявления его прямого антиоксидантного действия [23], карнозин стали рассматривать не только как буфер для протонов, но и как буфер для металлов с переменной валентностью и активных форм кислорода, то есть как классический антиоксидант. В последующем были выявлены антигликирующие [39], антикросслинкинговые [40] свойства карнозина, которые являются, по сути, отражением его антиоксидантных эффектов.
Клиническое применение карнозина. Создателями первой инъекционной лекарственной формы карнозина были ученые Харьковского физиотерапевтического института. При его введении подкожно по 0,5–1,0 мг (курс состоял из 12–15 инъекций) была получена высокая терапевтическая эффективность при лечении инфекционных и ревматических полиартритов, язвенных заболеваний желудочно-кишечного тракта [17, 29]. Позже было продемонстрировано положительное действие карнозина при заживлении ран роговицы [31] и ткани легкого [20]. Большое место в изучении ранозаживляющего действия карнозина принадлежит японским исследователям. Ими был создан препарат Z-103 на основе комплексного соединения, образуемого карнозином и ионами цинка (L-карнозин-Zn2+), который обладал выраженным противоязвенным эффектом, уменьшал повреждение слизистой желудка, вызванное разными формами стресса и химическими агентами [47]. Японским ученым принадлежит и приоритет использования карнозина при онкологических заболеваниях [49]. Карнозин (3 г/день) в сочетании с радиотерапией при лечении больных раком молочной железы значительно снижал побочные эффекты облучения – радиационное повреждение кожи, интоксикацию организма, повышал иммунитет и увеличивал вероятность излечения в несколько раз. Карнозин оказался эффективным и для предупреждения кахексии, вызываемой химиотерапией при лечении рака (2 г/день в течение 10 дней перед интенсивной химиотерапией) [49]. В экспериментальных исследованиях на культурах опухолевых клеток показано, что карнозин способен полностью подавлять пролиферацию глиобластомы человека, при этом обнаружено снижение уровня активных форм кислорода и повышение активности митохондриальной супероксиддисмутазы в клетках опухоли [22].
Отечественным ученым принадлежит приоритет открытия способности карнозина предотвращать возрастное помутнение хрусталика глаза [4]. Основной причиной помутнения хрусталика при старческой катаракте являются свободнорадикальные реакции, приводящие к окислительной модификации липидов и белков кристаллинов тканей глаза. В ходе развития катаракты в хрусталике происходит значительное снижение эндогенных антиоксидантов глутатиона и карнозина. В клинических исследованиях была доказана эффективность препарата в виде глазных капель для лечения катаракты, содержащего 5 %-й раствор карнозина. Позже при разработке глазных капель был успешно применен природный дипептид, родственный карнозину, N-ацетилкарнозин [34]. Карнозин в виде 5 %-го раствора успешно использовали и для лечения сезонного аллергического риноконьюнктивита, при этом отпадала необходимость дополнительного назначения антигистаминных препаратов [2]. Карнозин нашел свое применение и для лечения воспалительных заболеваний пародонта у пациентов с несъемными ортодонтическими конструкциями: 5 %-й раствор этого дипептида оказывал выраженное иммунокоррегирующее действие и повышал активность ферментов антиоксидантной защиты в слюне [25].
Карнозин успешно применяют в кардиологической практике. В Центре сердечно-сосудистой хирургии им. А.Н. Бакулева используют кардиоплегический раствор, содержащий L-карнозин и N-ацетилкарнозин, при операциях на остановленном сердце, что позволяет в несколько раз увеличить длительность операции без признаков некротического повреждения тканей сердца в операционном поле [5].
В настоящее время в России в качестве источника карнозина часто применяют таблетированную биологически активную добавку под названием севитин. Каждая таблетка севитина содержит 0,15 или 0,25 грамм карнозина. Благодаря работам, проводимым в Московском Научном центре неврологии по изучению биологических свойств карнозина (севитина), было показано, что этот препарат способствует восстановлению мозгового кровообращения и поддержанию функционального состояния сердечно-сосудистой системы, оказывает регулирующее действие на активность иммунной системы [24]. Проводятся исследования, направленные на получение новых карнозин-содержащих препаратов для использования в клинических условиях. Имеются сообщения о создании и испытании нанокомплексов, содержащих карнозин, включенный в состав фосфолипидных наноструктур [13]. Использование таких нанокомплексов позволяет обеспечить устойчивость карнозина к действию карнозиназы при его доставке к месту назначения, что может существенно увеличить эффективность воздействия этого дипептида.
Применениее карнозина при психоневрологических и психических расстройствах. Известно, что ОС развивается при болезни Паркинсона и Альцгеймера [46], при инсульте [38], неврозах [1], шизофрении [26], депрессии [10], при аддиктивных расстройствах, в частности, при алкоголизме [21, 41, 50]. Клетки нервной системы очень чувствительны к свободнорадикальному окислению в силу многих факторов: высокой интенсивности обменных процессов и высокого уровня потребления кислорода, большого количества липидов с полиненасыщенными жирными кислотами, повышенного содержания связанных ионов железа (индукторов окисления) и низкого содержания его белков-переносчиков, образования активных форм кислорода в ходе клеточного метаболизма, которые выполняют в нейрональных клетках функцию вторичных мессенджеров, участия свободных радикалов в нейрорегуляции и др. [3, 15]. Именно это определяет особую необходимость защиты клеток нервной ткани от свободно-радикального окисления с помощью природных антиоксидантов, способных преодолевать гематоэнцефалический барьер, к которым относится и карнозин.
Положительные результаты были получены при добавлении карнозина (2,0 г/сутки) к базовой терапии больных с хронической дисциркуляторной энцефалопатией. Такое лечение приводило к повышению устойчивости липопротеинов плазмы крови к Fe2+-индуцированному окислению, стабилизации эритроцитов по отношению к кислотному гемолизу, интенсификации дыхательного взрыва лейкоцитов и усилению эндогенной антиоксидантной защиты организма, улучшению когнитивных функций головного мозга пациентов [6]. То есть карнозин оказывал антиоксидантный, мембраностабилизирующий и иммуномодулирующий эффекты при данной патологии.
Существенное улучшение клинического состояния пациентов наблюдалось при введении карнозина в дозе 1,5 г/сут в течение 30 дней дополнительно к традиционной терапии при лечении болезни Паркинсона [28]. Использование карнозина позволило снизить токсические эффекты базовой терапии (побочные действия антипаркинсонных препаратов). У больных отмечалось статистически значимое уменьшение неврологической симптоматики (улучшение координации движений). Была выявлена положительная корреляция между активацией антиоксидантного фермента супероксиддисмутазы в эритроцитах и снижением неврологической симптоматики. Добавление карнозина в схему лечения приводило к достоверному снижению гидроперекисей в липопротеинах плазмы крови и значительно увеличивало сопротивляемость липопротеинов низкой и очень низкой плотности к Fe2+-индуцируемому окислению, а также к уменьшению количества окисленных белков в плазме крови. Таким образом, добавление карнозина к базисной терапии значительно улучшало не только клинические показатели, но и повышало антиоксидантный статус организма у пациентов с болезнью Паркинсона.
Успешное применение карнозин нашел и при шизофрении. Рандомизированное двойное слепое плацебо-контролируемое исследование выявило, что включение карнозина (2,0 г/сут) в качестве дополнения к основной терапии при лечении больных шизофренией улучшало когнитивные функции пациентов [35].
Коррекция окислительного стресса карнозином у больных алкоголизмом. Доказано, что у больных алкоголизмом ОС вносит большой вклад в формирование соматических осложнений [19], нарушение иммунного статуса [9, 11], индукцию апоптоза [36]. При алкоголизме важную роль в формирование ОС может вносить этанол, концентрация которого в организме больного существенно превышает норму, а также токсический метаболит этанола – ацетальдегид [8], уровень которого в организме также возрастает при алкогольной интоксикации. Ацетальдегид способен связываться со многими биологическими молекулами (белками плазмы, гемоглобином, факторами свертывающей системы крови, липидами и др.), образуя с ними альдегидные аддукты, которые откладываются и накапливаются в различных тканях (печени, мозге, сердце, мышцах, кишечнике) [43, 48].
Высокие показатели окислительной модификации биомолекул и активности аминотрансфераз сыворотки крови обнаружены у больных алкоголизмом, находящихся в состоянии абстиненции [7]. В другой работе повышенное содержание карбонилированных белков и активности аминотрансфераз сыворотки крови выявлено у пациентов с алкогольным делирием, инфицированных вирусами гепатита С или иммунодефицита человека [30]. Показана взаимосвязь между уровнем окисления (карбонилирования) белков плазмы крови с тяжестью проявлений абстинентного синдрома у пациентов [16]. Есть мнение, что метаболической основой возникновения алкогольного психоза является накопление ацетальдегида, который, взаимодействуя с серотонином, образует токсические продукты, обладающие галлюциногенными свойствами [12]. У больных алкогольным делирием с преобладанием психотического компонента выявлено повышенное содержание окисленных белков в эритроцитах, в плазме крови и низкий уровень ПОЛ [18]. Высокое содержание окисленных белков наблюдалось и у больных с алкогольной энцефалопатией [14]. Таким образом, активация свободно-радикальных процессов, приводящая к накоплению продуктов окислительной модификации биомолекул, вносит существенный вклад в клиническое течение алкоголизма и может определять его особенности, что делает крайне важным изучение эффектов антиоксидантов при данной патологии.
Проведено специальное плацебо-контролируемое исследование эффективности карнозина при коррекции ОС у больных алкогольной зависимостью на этапе формирования ремиссии [21, 32]. Больные после базового лечения принимали карнозин в дозе 1,2 г/сут в течение одного месяца вне стационара. Отмечено, что после лечения в стационаре в организме больных сохранялся ОС на высоком уровне. Через один месяц, в течение которого проводилось исследование, в группе сравнения (у больных, не принимавших никаких препаратов на этапе формирования ремиссии), выраженность ОС осталась на том же уровне, что и в начале исследования. В группе больных, которые принимали карнозин, отмечалось достоверное снижение карбонилированных белков и продуктов ПОЛ в плазме крови до величин, соответствующих здоровым лицам. Прием пациентами карнозина в течение месяца приводил также к повышению активности СОД плазмы и снижению активности аминотрансфераз сыворотки крови. Эти результаты показывают, что прием карнозина эффективно снижает выраженность ОС в организме больных алкоголизмом. При этом нежелательных побочных эффектов не наблюдалось.
Защита карнозином биомолекул от окисления, индуцированного этанолом и ацетальдегидом in vitro. В экспериментальных исследованиях было доказано, что карнозин в концентрации 5 мМ повышает устойчивость эритроцитов больных алкоголизмом к гемолизирующему действию кислоты [44], подавляет окислительную модификацию белков и липидов плазмы крови, вызванную как этанолом, так и ацетальдегидом. Методом электрофореза в полиакриламидном геле выявлено, что инкубация крови с ацетальдегидом приводит к появлению высокомолекулярных белков в плазме, которые не обнаружены ни в контрольных образцах, ни в образцах с этанолом. Это свидетельствует об ацетальдегид-индуцируемом образовании белковых агрегатов, которые образуются в результате свободнорадикального окисления. В образцах крови с ацетальдегидом, в которые был добавлен карнозин, высокомолекулярных белков не выявлялось. То есть карнозин препятствовал ацетальдегид-индуцируемому образованию агрегатов белков плазмы крови. В целом эти исследования показали, что положительный эффект карнозина при лечении больных алкоголизмом может быть обусловлен, в том числе, и способностью этого дипептида защищать белки и липиды от окислительного повреждения, вызванного этанолом и ацетальдегидом.
Применение карнозина при физиологических состояниях, сопровождающихся активацией свободно-радикальных процессов. ОС может развиваться не только при патологических процессах, но и при больших физических нагрузках, а также при физиологическом старении организма. Поэтому уже сегодня карнозин находит широкое применение как общеукрепляющее средство для здоровых людей в условиях физического и психологического напряжения, при действии различных неблагоприятных факторов, в экстремальных условиях. Карнозин применяют для ускорения процессов восстановления утомленных мышц и повышения их работоспособности у спортсменов [33] и у здоровых пожилых людей, стремящихся к активному образу жизни [37]. В экспериментальных условиях было показано геропротекторное действие карнозина. В опытах с использованием специально выведенной линии быстростареющих мышей было доказано, что включение в их рацион карнозина приводит к замедлению процесса старения животных за счет повышения антиоксидантного статуса их организма [27]. Есть сообщения об антистрессорном действии карнозина, а также о возможном его использовании у людей, страдающих нарушениями сна [24]. Перспективны разработки использования карнозина в косметической отрасли, что подтверждают имеющиеся данные о способности карнозина предотвращать структурные изменения коллагена в коже, препятствовать потере ее эластичности [45].
Заключение
Представленные данные об успешном использовании карнозина при разных патологиях и при физиологических состояниях, сопровождающихся активацией свободно-радикального окисления, демонстрируют перспективность использования карнозина в качестве эффективного антиоксиданта, протектора тканей от различных неблагоприятных факторов, индуцирующих развитие окислительного стресса.
Не доверяйте рекламе, или Потенциальная связь метаболизма L-карнитина и развития атеросклероза
Не доверяйте рекламе, или Потенциальная связь метаболизма L-карнитина и развития атеросклероза
Повышенное потребление L-карнитина набирает все большую популярность благодаря его благотворному влиянию на состояние человека. Однако отсутствие побочных эффектов чрезмерного потребления L-карнитина не было доказано.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Обильное потребление мясных продуктов в развитых странах связывают с повышенным риском сердечнососудистых заболеваний, объясняя это высоким содержанием насыщенных жиров и холестерина в мясе. Но так ли это? Исследования 2013 года не подтвердили связи между потреблением насыщенных жиров и повышенным риском развития сердечнососудистых заболеваний [1], что подтолкнуло ученых к поиску других факторов, приводящих к патологии. Тут-то и вспомнили про еще одну особенность мясных продуктов — обильное содержание L-карнитина.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучшее новостное сообщение».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Думайте, что покупаете!
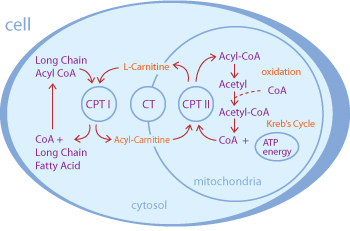
Рисунок 1. Участие L-карнитина в транспорте жирных кислот из цитоплазмы в митохондрию для β-окисления и получения энергии. CPT — карнитин—пальмитоилтрансфераза, CT — карнитин—ацилкарнитинтранслоказа, CoA — кофермент A.
Впервые L-карнитин был выделен двумя русскими учеными в 1905 году. Следовательно, сейчас идет уже второй век с момента открытия и начала изучения роли этой молекулы в организме человека [2]. Это один и самых исследуемых компонентов пищи. Пища, а именно красное мясо — основной источник карнитина у всеядных животных; тем не менее, немного L-карнитина синтезируется из лизина и в самом организме.
Кроме того, все больше и больше людей потребляет L-карнитин в качестве пищевых добавок. Помимо интернет-магазинов, магазинов спортивного питания и аптек, карнитин стал встречаться даже на полках продуктовых магазинов нашей страны, в том числе и в составе витаминов, энергетических напитков, шоколадных батончиков и прочего. Купить L-карнитин или продукты с его содержанием может кто угодно. В большинстве случаев L-карнитин принимают, видимо, в надежде интенсифицировать разрушение жиров, так как считается, что он осуществляет транспорт жирных кислот в митохондриальный матрикс, где происходит их разрушение с выделением энергии (рис. 1).
Реклама L-карнитина обещает быстрое похудение, увеличение мышечной массы, улучшение умственной и физической формы, устойчивости к стрессу, детоксикацию организма и многое другое. Надо сказать, что многие положительные эффекты карнитина действительно научно доказаны, но не стоит забывать о том, что до сих пор неизвестно, вреден ли избыток карнитина для здоровья.
Норма потребления L-карнитина для взрослого человека составляет 300 мг, тогда как для похудения и улучшения спортивных показателей оптимальными считаются дозы от 500 мг до 2 г в сутки. В надежде же обрести идеальное тело, прилагая при этом минимум усилий, люди в несколько раз превышают норму, не задумываясь о возможных последствиях. А зря. Ведь мы знаем, что метаболические пути в организме недостаточно изучены, и что практически все лекарства — да что там, даже витамины при их чрезмерном употреблении — имеют побочные действия. И L-карнитин не является исключением! Исследования 2013 года показали, что метаболит L-карнитина — триметиламин оксид (ТМАО) — вещество, способствующее развитию атеросклероза [3].
Коварные бактерии, или новый взгляд на метаболизм L-карнитина
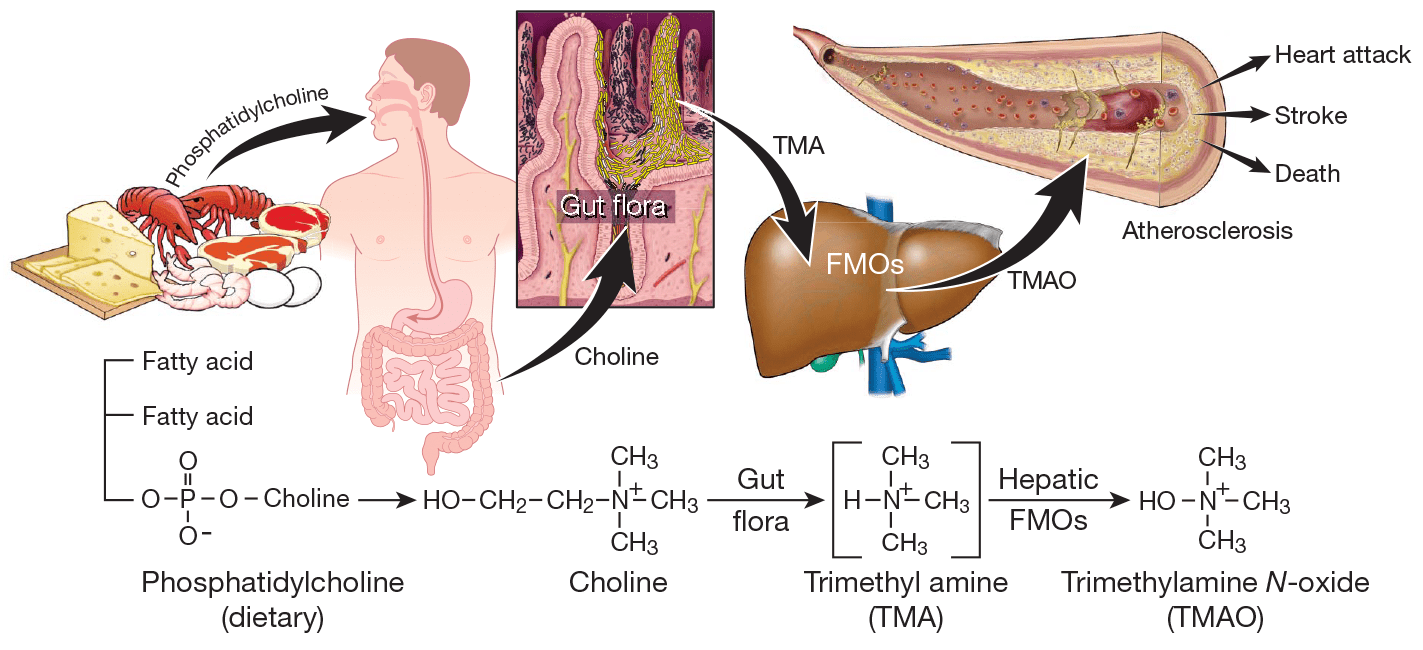
Задуматься о возможной связи L-карнитина с развитием атеросклероза заставило открытие 2011 года, показавшее связь метаболизма холина — структурного аналога L-карнитина — с патогенезом сердечнососудистых заболеваний [3]. Главным источником холина служит фосфатидилхолин — одна из самых распространенных молекул клеточных мембран, в больших количествах содержащаяся пище животного происхождения.
Как оказалось, холин используется некоторыми кишечными бактериями для синтеза интермедиата триметиламина (ТМА) (рис. 2). В свою очередь, ТМА быстро абсорбируется и окисляется ферментами семейства FMO (флавинмонооксигеназа, FMO3 — главный фермент процесса) в печени до ТМАО, вызывающего развитие атеросклероза.
Рисунок 2. Схема синтеза кишечной флорой метаболита фосфатидилхолина, стимулирующего развитие атеросклероза. Фосфатидилхолин служит источником холина, который некоторые бактерии кишечника способны использовать для синтеза ТМА. ТМА, в свою очередь, быстро преобразуется ферментом флавинмонооксигеназой в ТМАО, уровень которого показал строгую корреляцию с развитием атеросклероза.
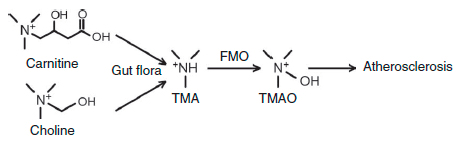
Использование бактериями триметиламинной группы холина для синтеза ТМА поднимает вопрос о существовании подобных метаболических путей для аналогичных соединений, включающих эту группу. Одна из таких молекул — как раз карнитин (рис. 3). Возникшее предположение о связи продукции ТМАО из L-карнитина подтвердилось исследованиями 2013 года [1], хотя предшествующие эксперименты на крысах не выявляли такой связи [4].
Рисунок 3. Схема синтеза ТМАО, приводящего к развития атеросклероза. Карнитин и холин — триметиламины, получаемые с пищей, — используются для синтеза ТМА микрофлорой кишечника, который быстро окисляется флавинмонооксигеназой до ТМАО.
Метаболит L-карнитина — одна из причин развития сердечнососудистых заболеваний
Два независимых клинических исследования показали связь концентрации L-карнитина и ТМАО в плазме крови с развитием коронарной и периферической недостаточностей, а также сердечнососудистых заболеваний в целом. В первом исследовании участвовала группа из 2595 человек [1], во втором — проводился трехлетний кардиологический контроль 4000 пациентов [5].
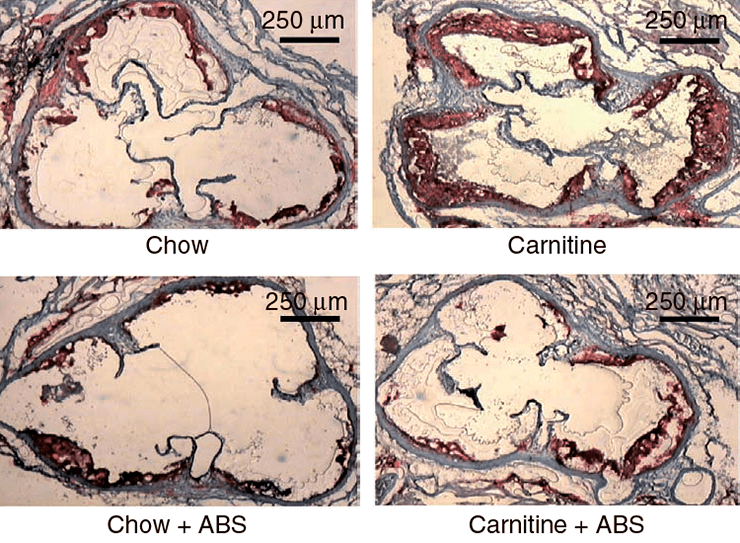
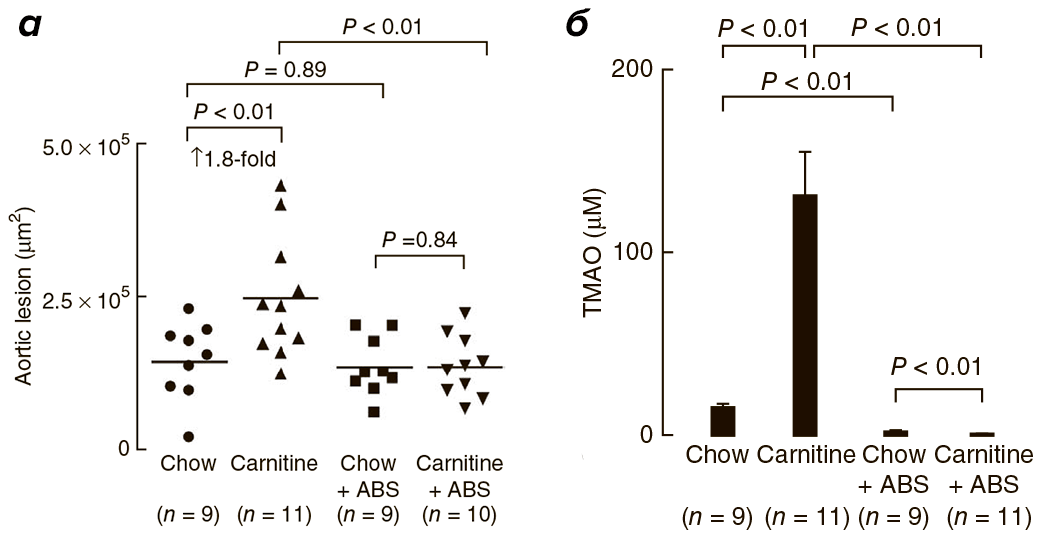
Исследования на мышах также подтверждают корреляцию высокого уровня L-карнитина и ТМАО с развитием патологий сердечнососудистой системы [1]. С четырехнедельного возраста четыре группы мышей получали питание определенного типа: 1) обычное, 2) с повышенным содержанием карнитина, 3) с добавлением антибиотиков или 4) с повышенным содержанием карнитина и добавлением антибиотиков. Сравнение ткани корней аорты у мышей по достижении 19-недельного возраста выявило двойное увеличение области атеросклеротического повреждения при добавлении L-карнитина в корм (рис. 4, 5а). У мышей, получающих L-карнитин в комплексе с антибиотиками, нарушений не возникало. Следовательно, виновники развития сердечнососудистых нарушений — бактерии, участвующие в образовании ТМАО, уровень которого значительно возрастает при потреблении L-карнитина (рис. 5б) и коррелирует с развитием атеросклероза.
Рисунок 4. Срезы корней аорты 19-недельных мышей. Окраска гематоксилином. Chow — нормальное питание, ABS — отсутствие антибиотика.
Рисунок 5. а — Оценка площади атеросклеротического повреждения корней аорты у мышей в зависимости от типа питания. б — Зависимость уровня ТМАО от типа питания мышей. Chow — нормальное питание, ABS — отсутствие антибиотика.
Вспомним про веганов (радикальные вегетарианцы, не употребляющие никаких продуктов животного происхождения) и вегетарианцев, не употребляющих красное мясо с высоким содержанием L-карнитина, и задумаемся, есть ли у них в кишечнике группа бактерий, ответственная за образование ТМА, окисляющегося до ТМАО (рис. 3)?
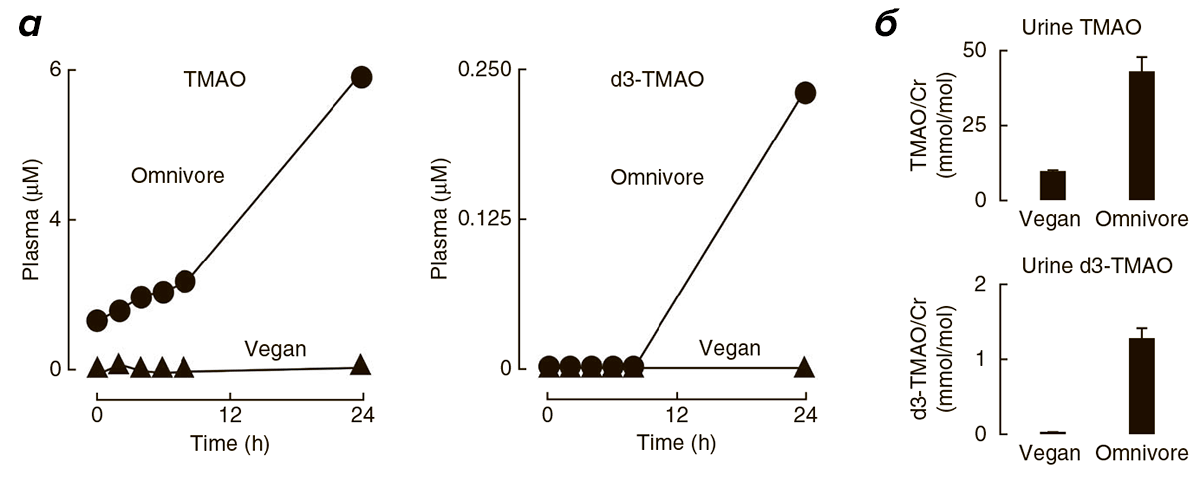
Не секрет, что пищевые предпочтения определяют состав микробиоты [6]. Так, продолжительный избыток карнитина в пище приводит к изменениям состава флоры кишечника, способствуя процветанию бактерий, участвующих в синтезе ТМАО [1]. Сниженное потребление L-карнитина и холина у веганов и вегетарианцев, напротив, не дает им развиваться. Бактерий, синтезирующих ТМАО, практически не остается, и даже при включении L-карнитина в рацион людей, длительное время соблюдающих растительную диету, уровень ТМАО в плазме крови и моче остается низким (рис. 6).
Рисунок 6. Сравнение уровней ТМАО в плазме крови (а) и в моче (б) после приема L-карнитина у веганов и людей, практически ежедневно потребляющих продукты из красного мяса. Синтез ТМАО (или его d3-меченного аналога) после потребления мясного стейка и L-карнитина (или d3-метил карнитина) незначителен у веганов (больше 5 лет отказывающихся от животных продуктов), в отличие от людей, регулярно потребляющих красное мясо. Полученные данные были дополнительно проверены и подтверждены на людях, следующих обычной диете, и людях, ведущих веганский или вегетарианский образ жизни более года.
Из этого можно предположить, что низкий уровень ТМАО и есть основная причина хорошего состояния сердечнососудистой системы веганов и вегетарианцев. Ведь статистика показывает нам более редкую встречаемость сердечнососудистых заболеваний [7], [8] и на 29% сокращенный риск смерти от ишемии сердца для людей этой группы [8].
Эксперименты также говорят о том, что соблюдение сбалансированной растительной диеты приводит к снижению давления, уровня холестерина в крови и риска возникновения атеросклероза [8–10]. Так, отказ от животной пищи может сократить прием лекарств при сердечнососудистых нарушениях. В одном из исследований группе пациентов с атеросклерозом был предложен полный переход на растительную пищу. Через год уже у 82% группы наблюдались улучшения [11]. Повторение эксперимента приводило к сходным результатам [12].
Но, быть может, преимущества соблюдения растительной диеты связаны вовсе не с отсутствием синтеза ТМАО, а с низким содержанием насыщенных жиров и холестерина в рационе? Ведь широко бытует мнение о том, что именно потребление большого количества насыщенных жиров и холестерина является главным фактором риска развития атеросклероза. Однако исследования 2013 года не подтвердили данной связи [1]. Примечательно также, что развитие атеросклеротических поражений у мышей происходило в отсутствие изменений в составе и содержании липидов, липопротеинов, глюкозы и уровня инсулина. Более того, у таких мышей не удалось выявить и признаков ожирения.
Так что возможно, кишечные бактерии, участвующие в синтезе ТМАО, — главные виновники развития атеросклероза. Если это так, то использование антибиотиков — новый возможный способ борьбы с сердечнососудистыми заболеваниями, а также их предотвращения. Как для человека, так и для мышей уже определены роды бактерий, предположительно участвующих в синтезе ТМАО. И хотя полученных данных пока недостаточно для выявления общего таксона, ответственного за синтез ТМАО, дальнейшие исследования вскоре прояснят ситуацию.
Насколько опасен атеросклероз и какова же роль ТМАО в его развитии?
Большинство исследователей склоняется к тому, что развитие атеросклероза представляет собой воспалительный процесс в сосудистой стенке, ключевую роль в котором играют макрофаги [15]. В развитии атеросклероза участвуют в основном жиры, входящие в состав липопротеинов низкой и очень низкой плотности (ЛПНП и ЛПОНП) [16], [17]. В случае проникновения в стенки артерий ЛПНП и ЛПОНП окисляются, привлекая макрофаги, которые в норме поглощают окисленные жиры и передают их на липопротеины высокой плотности (ЛПВП), способствуя их утилизации.
Однако возможна гиперактивация фагоцитоза окисленных жиров макрофагами: образуются так называемые пенистые клетки, продолжающие накапливать окисленные жиры во внутриклеточном пространстве, не передавая на ЛПВП. В конце концов, такие макрофаги гибнут и разрываются; активируется агрегация тромбоцитов, что приводит к увеличению свертываемости крови. При этом поглощенные ранее жиры изливаются наружу, что способствует активации все новых и новых макрофагов. Образуются фиброзные бляшки, в которых накапливаются омертвевшие ткани; в дальнейшем эти бляшки кальцифицируются. Это приводит к деформации сосудов и сужению просвета вплоть до полной закупорки.
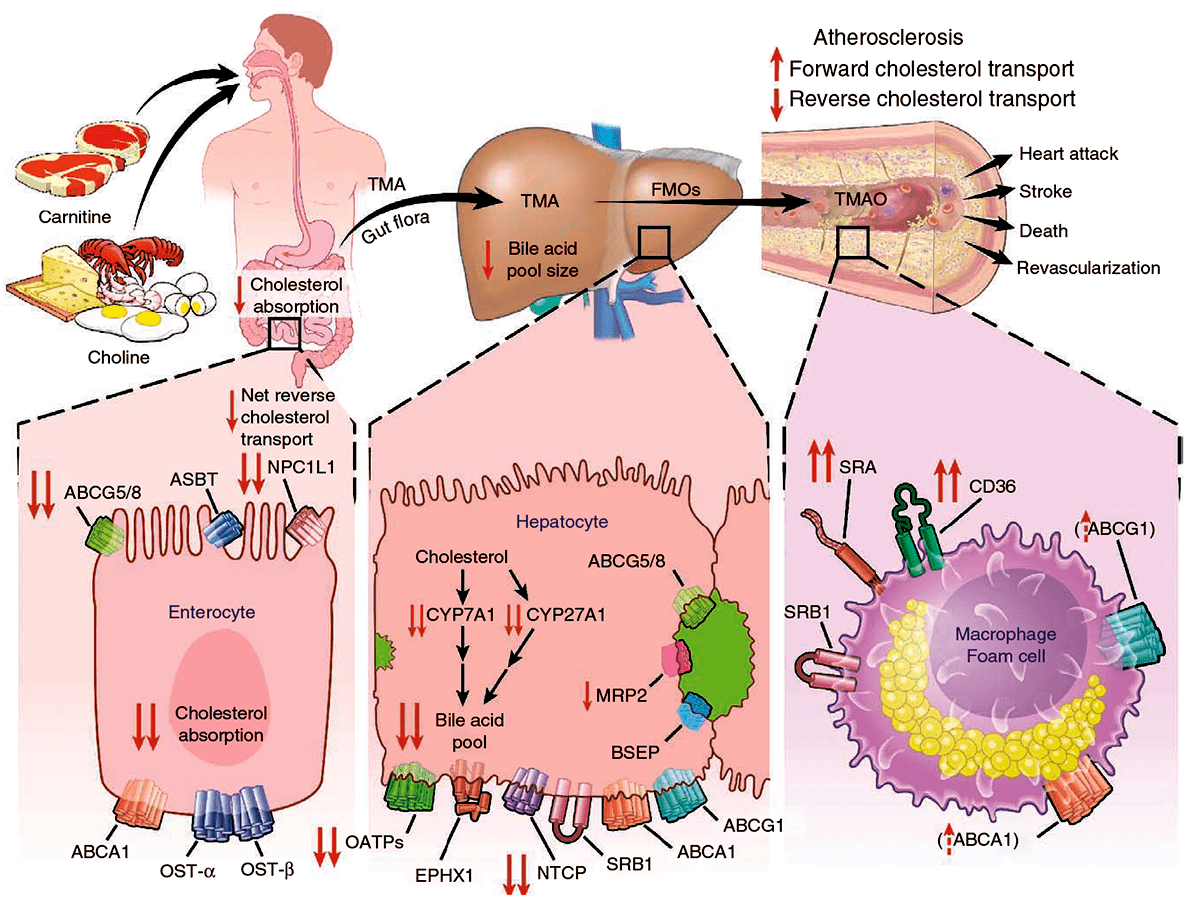
Одним из факторов, способствующих возникновению воспаления, является ингибиторное действие ТМАО на обратный транспорт холестерина и стимуляция экспрессии рецепторов SRA и CD36 на их внешней мембране, что и ведет к нарушению поглощения модифицированных липопротеинов [3], [18], [19]. Другой фактор, вызываемый ТМАО — ингибирование накопления желчи в печени и снижение экспрессии белков, ответственных за синтез и транспорт желчных кислот. Как первый, так и второй факторы связаны с развитием атеросклероза (рис. 7), однако детали механизмов действия ТМАО на обратный транспорт холестерина, синтез и транспорт жирных кислот остаются неизвестны.
Рисунок 7. Общая схема предполагаемого метаболического пути, посредством которого микробиота влияет на развитие атеросклероза. Кишечные бактерии усваивают L-карнитин и холин, формируя ТМА, а затем ТМАО. ТМАО воздействует на метаболизм холестерина и стерина в макрофагах, печени и кишечнике. Он подавляет обратный транспорт холестерина, увеличивает экспрессию рецепторов SRA и CD36 макрофагов, способствуя образованию пенистых клеток.