кератиноциты у собак что это
Бактериальные дерматиты у собак: особенности патогенеза и лечебная тактика
Тиханин В. В., Карпецкая Н. Л., Ветеринарная клиника доктора Тиханина, Санкт-Петербург
Бактериальные дерматиты у собак встречаются достаточно часто, но лишь 20% из них первичны, остальные имеют в своей первооснове какие-либо другие заболевания (блошиный аллергический дерматит, демодекоз, а также гипотиреоз, гиперкортицизм, гипо-, авитаминозы, реже сахарный диабет или врожденные иммунодефициты). Описывается гистологическая и патоморфологическая картина поверхностного и глубокого дерматитов, обсуждаются принципы терапии заболевания.
Бактериальные дерматиты, особенно местные, встречаются у собак довольно часто. Вместе с тем, надо иметь ввиду, что нередко им предшествуют или сопутствуют другие заболевания. Так, по нашим наблюдениям, количество первичных поражений составляет не более 20% от всех бактериальных дерматитов, и в каждом таком случае в качестве первоосновы следует подозревать некое другое заболевание, чаще всего демодекоз или блошиный аллергический дерматит. Только тогда, когда первооснова заболевания не обнаруживается, дерматит рассматривается как первичный.
Понятие «первичный» вовсе не означает идиопатический. Первичный — в смысле отсутствия фоновых кожных поражений, однако, у таких собак всегда имеется некая системная патология, способствующая инфекционному поражению кожи. Если она не выявляется, это означает, что мы не сумели ее выявить: то ли в силу нежелания углубленно обследовать собаку, то ли в силу экономии средств владельцами, не желающими оплачивать дополнительные исследования, то ли в силу недостаточности имеющейся в нашем распоряжении лабораторной и инструментальной базы, то ли в силу ограниченности современных возможностей ветеринарной науки в отношении диагностики этих заболеваний. В качестве такой патологии выступают гипотиреоз и гиперкортицизм (спонтанный или ятрогенный), гиповитаминозы, реже сахарный диабет или врожденные иммунодефициты.
Буллезное импетиго — поверхностный пиодерматит, вызываемый стафилококками, в некоторых случаях в гное обнаруживают также Pseudomonas sp. и E. coli. В отличие от простого импетиго, протекающего с наличием мелких пустул без образования эрозий, данное заболевание развивается практически всегда на фоне гиперадренокортицизма, сахарного диабета, гипотиреоза или других заболеваний и сопровождается истощением и ослаблением организма собаки.
Гистологическое исследование биоптата кожи показывает, что гнойники формируются в толще эпидермиса, преимущественно под роговым слоем. Его отторжение в виде пластов сопровождается появлением обширных эрозий. Волосяные фолликулы при этом не повреждаются. Поверхностный харакер поражения обусловливает незначительность реакции со стороны расположенных в дерме тучных клеток, что находит свое отражение в отсутствии зуда, а следовательно, и отсутствию более глубоких поражений, поскольку собака не травмирует себя.
Глубокие пиодерматиты характеризуются поражением дермы на всю толщу, а иногда и вовлечением подкожной жировой клетчатки. Они могут проявляться общим ухудшением состояния собаки и заживают, как правило, с образованием рубцов. Если поражение строго локализовано, то возможно, что в его основе — инфицированная рана. Если же поражение носит диффузно-очаговый характер или сопровождается поражением кожи целой анатомической области, то следует предположить наличие фонового заболевания. Зоны пораженной кожи при глубоких дерматитах выглядят обычно красными, и практически всегда характеризуются наличием язв.
Гистологическое исследование кожного биоптата показано в хронических случаях, когда обычное лечение эффекта не дает, и имеется подозрение на наличие демодекоза или другого фонового поражения кожи.
На микроскопическом уровне как в зоне язвенного поражения, так и далеко за его пределами, определяются обширные участки воспалительной инфильтрации, образующие местами сливные поля. В инфильтрате обычно присутствует смесь из нейтрофильных лейкоцитов и плазматических клеток. В меньшей степени представлены лимфоциты. Значительная примесь макрофагов может свидетельствовать о возможной грибковой инфекции, особенно если прослеживается тенденция к формированию гранулем и появлению гигантских многоядерных клеток. В то же время существует мнение, что макрофагальная реакция развивается в ответ на появление в глубоких слоях дермы частиц разрушающихся кератиноцитов. Глубокие дерматиты проявляются фолликулитами с выходом воспалительного инфильтрата за пределы фолликулов в более глубокие слои кожи, иногда с формированием фурункулов, хотя абсцессы, как таковые, наблюдаются редко. Не все авторы согласны с такой точкой зрения и описывают абсцессы с формированием гнойных фистул, открывающихся на поверхность кожи.
В условиях хронического воспаления, как правило, наблюдается плоскоклеточная метаплазия в сальных железах. Метаплазия — это стойкое превращение генетически родственных тканей одной в другую. Традиционно она рассматривается как компенсаторно-приспособительная реакция и чаще всего наблюдается в эпителиальных тканях. На первый взгляд, эпителий сальных желез, который рассматривается как многослойный кубический, имеет сходный с эпидермисом фенотип — не случайно при ожогах кожи IIIа степени эпителий сальных желез и других дериватов кожи становится источником регенерации эпидермиса. В условиях агрессии снижение интенсивности апоптоза приводит к более значительной выработке зрелыми клетками кейлонов, что тормозит пролиферацию базальных клеток и создает условия для ороговения эпителиоцитов. Эпителий с более выраженным роговым слоем должен лучше защищать подлежащие ткани. Так и бывает при многих хронических поражениях кожи, когда наблюдается акантоз и гиперкератоз эпидермиса. Можно полагать, что это типовая реакция многих эпителиев: респираторного при хроническом бронхите, секреторного в предстательной железе при хроническом простатите, переходного при хроническом цистите.
В случаях одиночных длительно незаживающих язвенных поражений гистологическое исследование выявляет разрастание в дне язвы грануляционной ткани без характерного для нее разделения на слои и, на наш взгляд, свидетельствует о нарушении процессов регенерации, тем самым объясняя отсутствие желаемого клинического эффекта.
Глубокие бактериальные пиодерматиты практически всегда сопровождаются язвенными дефектами кожи и никогда — эрозивными. Это, по-видимому, является отражением различных механизмов образования дефектов. В условиях глубокого пиодерматита в патологический процесс всегда вовлекаются сосуды дермы, что ведет к тромбартериолиту, а это, в свою очередь, проявляется микроинфарктами кожи с последующим формированием язв.
Следует иметь в виду, что в развитии бактериального дерматита, образно говоря, виноваты не бактерии, а организм животного, поскольку около 90% всех бактериальных агентов при таких дерматитах составляют Staphylococcus intermedius и другие микробы, являющиеся нормальной микрофлорой кожи собаки. Следовательно, лечение бактериального дерматита должно состоять не только в борьбе с бактериями, но и в устранении неблагоприятного фона и поддержании иммунитета и регенераторных возможностей организма животного.
Основные принципы терапии бактериальных дерматитов можно сформулировать следующим образом.
Перечисленные положения особенно применимы при лечении глубоких дерматитов. В отдельных случаях антибиотикотерапия может длиться до 12 недель (до клинического разрешения заболевания) и еще не менее 2 недель после видимого выздоровления.
В случае ограниченного пиодерматита (когда в течение 10-14 дней не наступает заметного улучшения), рекомендуется хирургическое иссечение (если этому нет препятствий) пораженного участка кожи. Во-первых, опыт показывает невысокую эффективность терапевтического ведения таких ограниченных пиодерматитов, во-вторых, предлагаемый подход экономит средства хозяев, затрачиваемые на антибиотики, сокращает сроки лечения и не сопровождается иммуносупрессией и дисбактериозом кишечника, характерными для длительной и интенсивной антибиотикотерапии.
Диагностическое значение изменения морфологии лейкоцитов
Большинство токсических изменений отражает асинхронность созревания между ядром и цитоплазмой. Во время нормального гранулоцитопоэза удлинение и пикноз ядра происходят одновременно с конденсированием хроматина и исчезновением цитоплазматических белков (РНК – в виде рибосом и шероховатой эндоплазматической сети, которые придают синий цвет цитоплазме). В результате ускоренного созревания в периферическую кровь попадают незрелые клетки. Они могут быть более крупными (гигантизм), с остатками шероховатой эндоплазматической сети, рибосомами, менее конденсированным хроматином. Эти клетки также могут иметь пенистую или вакуолизированную цитоплазму.
Нейтрофильная токсичность встречается как у палочкоядерных, так и у сегментоядерных нейтрофилов. Нейтрофильную токсичность в мазке крови оценивают субъективно и полуколичественно. Различают легкую, умеренную и выраженную нейтрофильную токсичность.
30% измененных клеток – выраженная нейтрофильная токсичность.
Далее каждый вид нейтрофильной токсичности оценивается в баллах или «+».
Различают 5 основных видов нейтрофильной токсичности:
Возможно появление телец
Деле в цитоплазме нейтрофилов при длительном хранении образца крови (более суток). Следовательно, их появление следует интерпретировать с осторожностью. Наличие 1-2 телец Деле в цитоплазме нейтрофилов оценивается как легкая нейтрофильная токсичность, 3-4 – как умеренная, более 4 – как выраженная.
В отличие от бело-розовой цитоплазмы «здорового» нейтрофила, у токсически измененной клетки цвет цитоплазмы будет варьироваться от серо-голубого до темно- синего. Подобное диффузное неравномерное окрашивание цитоплазмы нейтрофилов связано с наличием рибосом и остатков шероховатой эндоплазматической сети. Изменение цвета цитоплазмы от неоднородно серого до светло-голубого оценивается как легкая нейтрофильная токсичность, окрашивание цитоплазмы в равномерно голубой цвет – как умеренная, от синего до темно-синего – как выраженная.
Ядерный хроматин у таких клеток более рыхлый, тонкий, менее конденсированный. Могут встречаться клетки, значительно превосходящие в размере нейтрофилы здоровых животных (гигантские нейтрофилы). Гигантские нейтрофилы возникают в результате пропуска одного из клеточных делений в костном мозге. Эти клетки могут иметь как нормальную морфологию ядра, так и гипосегментированные ядра. Появление подобных клеток мы можем часто наблюдать в крови у кошек, реже – у собак. Гигантские нейтрофилы всегда свидетельствуют о выраженной нейтрофильной токсичности. Появление гигантских нейтрофилов в крови характерно для тяжелых воспалительных процессов или дисгранулопоэза.
Основные причины появления гигантских нейтрофилов в крови кошек:
1. тяжелые бактериальные инфекции (пиоторакс, пиометра и т. д.);
2. острая миелоидная лейкемия (ОМЛ);
3. миелодиспластический синдром;
4. вирусная лейкемия кошек (FeLV);
5. вирус иммунодефицита кошек (FIV);
6. панлейкопения (в результате временной гранулоцитарной гипоплазии).
Под токсической зернистостью принято понимать появление мелких красных зерен (гранул) в цитоплазме нейтрофилов. Данный вид нейтрофильной токсичности характерен для лошадей, коров, лам, верблюдов, он редко встречается у собак и кошек. Эти зерна представляют собой первичные гранулы, сохранившие способность окрашиваться с той же интенсивностью, как это в норме свойственно гранулам промиелоцитов. Токсическую зернистость следует дифференцировать от гранул, содержащихся в цитоплазме нейтрофилов животных с лизосомными болезнями накопления. Ее следует отличать от розовой окраски вторичных гранул, которая не является признаком токсичности. Следует также помнить, что у кроликов, морских свинок, птиц и рептилий вторичные гранулы нейтрофилов окрашиваются в красный цвет (гетерофилы). Токсическая зернистость всегда свидетельствует о выраженной нейтрофильной токсичности.
Степени тяжести нейтрофильной токсичности:
Тельца Деле+
Базофилия цитоплазмы+
Пенистость цитоплазмы++
Темная серо-синяя пенистая цитоплазма+++
Токсическая зернистость+++
Следует помнить, что общеклинический анализ крови (ОАК) должен обязательно включать в себя подсчет лейкограммы вручную и оценку морфологии лейкоцитов. Врач-лаборант всегда должен указывать любой вид нейтрофильной токсичности в бланке результата ОАК. Автоматический подсчет лейкограммы очень сомнителен и не способен оценить изменения морфологии нейтрофилов. Для исследования морфологии нейтрофилов не рекомендуется использовать быстрые красители (например, лейкодиф). Оптимальной окраской считается окраска по Романовскому или Паппенгейму. Токсические изменения часто указывают на тяжелый воспалительный процесс и сопровождаются выраженным нейтрофильным лейкоцитозом со сдвигом ядра влево и появлением незрелых клеток (промиелоцитов, миелоцитов и метамиелоцитов), что является плохим прогностическим признаком. Пациентам с подобной картиной крови необходимы ежедневные исследования общеклинического анализа крови для оценки реакции на проводимое лечение. Важно помнить, что некоторые животные могут иметь сдвиг влево без нейтрофильной токсичности и токсические изменения без сдвига влево (редко). В последнем случае врач- клиницист должен искать другие причины появления токсичности (например, миелодисплазии, длительное хранение образца крови и т. д.). Появлению нейтрофильной токсичности способствуют инфекционные процессы, опухолевые, метаболические. В случае нейтрофилии со сдвигом ядра вправо, нейтропении или при отсутствии изменений в лейкограмме оценка морфологии нейтрофилов может оказатьдополнительную помощь врачу-клиницисту в постановке диагноза.
Кератоз
БЕСПЛАТНАЯ КОНСУЛЬТАЦИЯ: поможем врачам и владельцам клиник выбрать оборудование для лечения кератоза
Оглавление
Кератоз (актинический кератоз, солнечный кератоз, старческий кератоз, actinic keratosis) — предраковое состояние кожи, возникающее вследствие длительного пребывания человека под открытым солнцем.
В нашей компании Вы можете приобрести следующее оборудование для лечения кератоза:
Чаще всего актинический кератоз кожи возникает у людей пожилого возраста, однако в последнее время наблюдается тенденция к омоложению этого заболевания. Согласно статистике, чем больше времени человек провел на открытом солнце за свою жизнь и чем больше солнечных ожогов он получил, тем выше риск развития кератоза в процессе старения.
Несмотря на то что значительное число случаев сквамозно-клеточной карциномы имеют связь с актиническим кератозом, риск прогрессирования последнего в рак кожи относительно низкий. К сожалению, в настоящее время не выработано надежных гистологических критериев, которые смогли бы точно предсказать, какие случаи актинического кератоза трансформируются в рак кожи, а какие нет. По разным оценкам, вероятность этого события находится в пределах 0,025–20%.
Этиология и патогенез кератоза
Одним из весомых факторов развития кератоза является постоянное воздействие ультрафиолетового излучения. Особую роль играет ультрафиолет спектра В (UVB, 290–320 нм) и А (UVA, 320–400 нм) — он индуцирует р53-зависимый апоптоз кератиноцитов эпидермиса. Такие апоптотические кератиноциты часто называют «клетками солнечного ожога» (Sunburn Cells, SBCs) — их можно обнаружить при гистологическом исследовании эпидермиса, который подвергался чрезмерному воздействию солнечного света или ламп солярия.
В развитии кератоза большое значение имеет УФ-индуцированная мутация гена-супрессора опухолей ТР53, который имеет отношение к вышеназванному белку p53. Базальные кератиноциты с мутантным ТР53 не подвергаются апоптозу, что позволяет им передавать генетические аномалии новым клеткам. Похожие изменения обнаруживаются при сквамозно-клеточной карциноме и других злокачественных опухолях.
Актиническому кератозу может способствовать общее подавление иммунного ответа в организме. К группе риска относятся пациенты, прошедшие трансплантацию органов или тканей и принимающие иммунодепрессанты.
Некоторые лекарственные препараты могут действовать в качестве фотосенсибилизаторов, повышая чувствительность кожи к ультрафиолету и способствуя развитию кератоза кожи.
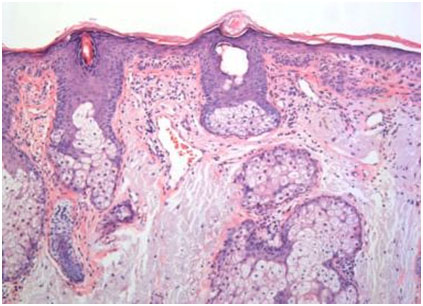
При микроскопии кератотических очагов обычно заметны диспластические изменения базального слоя эпидермиса, сопровождающиеся паракератозом и солнечным эластозом различной степени выраженности. Фиксируется увеличение размеров и плеоморфизм ядер, гиперхроматоз, рост митотической активности или атипичный характер митозов, цитоплазматическая бледность.
Выросты диспластического эпидермиса могут распространяться вглубь сосочкового слоя дермы, и в некоторых случаях их трудно отличить от поверхностного инвазивного плоскоклеточного рака кожи. Диспластические эпидермальные изменения, как правило, не затрагивают придатки кожи (сальные и потовые железы, волосы, ногти) (рис. 1).
Рис. 1. Гистологические признаки кератоза (www.medscape.com)
В эпидермисе наблюдается умеренный гиперкератоз с дисплазией базальных кератиноцитов и формированием небольших выростов, распространяющихся в сосочковый слой дермы. Заметно наличие солнечного эластоза. Диспластические изменения в первую очередь затрагивают межфолликулярный эпидермис.
Клинические особенности кератоза
Обычно актинический кератоз появляется в областях, которые подвержены активному и/или частому воздействию ультрафиолета — это руки, лицо, лоб, уши и шея. Аналогичные поражения на губах называются актиническим хейлитом.
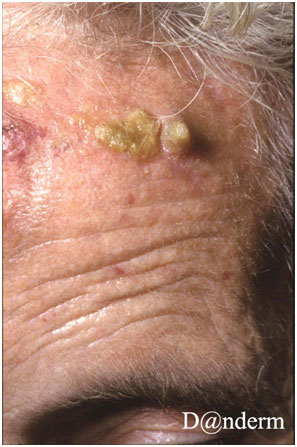
Клиническая картина кератоза представлена небольшими (несколько миллиметров) красными чешуйчатыми папулами или бляшками с уплотненным и утолщенным эпидермисом, которые могут сопровождаться локальным покраснением (рис. 2). Зачастую присутствует более одного очага поражения с видимыми признаками вторичной травмы от расчесывания. В некоторых случаях может формироваться гиперкератозное образование цилиндрической формы — кожный рог.
Описаны следующие варианты актинического кератоза:
При пигментном актиническом кератозе присутствует выраженная пигментация кератиноцитов базального слоя эпидермиса, которая клинически и гистологически имитирует меланоцитарную пролиферацию.
Типичным местом возникновения гипертрофической формы является тыльная поверхность рук. Данные поражения часто формируются вследствие механического раздражения и натирания кожи.
При лихеноидной форме кератоза кожи отмечается наличие лимфоцитарного инфильтрата в сосочковом слое дермы.
Акантолитический кератоз может имитировать другие состояния, связанные с акантолизом — болезнь Гровера, болезнь Дарье, бородавчатую дискератому и себорейный кератоз с акантолизом.
Клиницисту важно помнить о том, что актинический кератоз может трансформироваться в плоскоклеточный рак кожи (с низким риском последующего метастазирования).
Рис. 2. Актинический кератоз на лбу пациента (Danish national service on dermato-venereology)
Принципы лечения кератоза кожи
В качестве меры профилактики развития кератоза рекомендуется постоянно использовать солнцезащитные средства с SPF 30+. Однако здесь важно соблюдать баланс между фотозащитой кожи и возможным дефицитом витамина D, связанным с недостатком солнечного света. При активной инсоляции или длительном нахождении на улице использование УФ-фильтров оправдано, но, если основное время пациент проводит в помещении, в солнцезащитной косметике обычно нет необходимости.
Некоторые лекарственные препараты уменьшают риск появления актинического кератоза. Например, было установлено, что при регулярном приеме нестероидных противовоспалительных средств частота развития кератоза снижается. Лекарства могут использоваться и для лечения кератоза кожи, однако их следует назначать в тесном контакте с дерматологами и врачами других специальностей. Например, пациенту можно порекомендовать 5-флуорацил, имиквимод, топическую комбинацию диклофенака и гиалуроновой кислоты.
В терапии поверхностных явлений кератоза могут быть использованы возможности химических пилингов.
Устранить папулы и кожный рог можно с помощью криотерапии — локальной заморозки жидким азотом. Для этого также можно применить хирургическое вмешательство.
Проблема актинического кератоза успешно решается аппаратными методами, среди которых особо можно выделить неаблятивный фракционный фототермолиз, а также традиционную и фракционную лазерную абляцию. Последняя хорошо сочетается с фотодинамической терапией — в этом случае фракционный СО2-лазер служит средством внутрикожной доставки фотосенсибилизаторов.
Наиболее распространенные причины формирования бактериального воспаления кожи у собак. Лечебные меры.
Кожа как орган физической, химической и иммунной противобактериальной защиты
Кожа по своей сути – это покровный орган, формирующий первую линию защиты против патогенов, которые могут проникать в организм «хозяина» из внешней среды.
Основной фактор физической защиты представлен роговым слоем, кератиноциты которого плотно расположены и покрыты продуктами секреции сальных желез, образующих своеобразную защитную эмульсию на поверхности кожи.
Непредельные жирные кислоты, которые продуцируются сальными железами, в особенности же линолевая кислота, обладают выраженной противобактериальной защитой. В состав упомянутой защитной эмульсии входят и водорастворимые составляющие, представленные неорганическими солями и протеинами, обладающими способностью ингибировать бактериальные патогены. Такая совокупность антибактериальных свойств непредельных жирных кислот и неорганических соединений создает на поверхности кожи химические факторы защиты (Muller & Kirks «Small animal dermatology», 2000.).
Кожа, являясь одной из основных тканей, изолирующих организм от воздействия окружающей среды, находится под постоянным многоэтапным контролем иммунной системы. На клеточном уровне контроль иммунной системы за кожей обеспечивается высокой концентрацией как в эпидермисе, так и в собственно дерме антигенпрезентирующих клеток (клетки Лангерганса, дермальные дендритные клетки и макрофаги), существованием популяции постоянно обновляющихся специфических Т-лимфоцитов, а также наличием в составе дермальных лимфатических фолликулов В-лимфоцитов, плазматических клеток и естественных киллеров.
Кроме того, далеко не последнюю роль в функционировании иммунной системы в коже играют и основные клеточные элементы этой ткани. Под действием ряда провоспалительных стимулов кератиноциты, фибробласты и эндотелиальные клетки способны экспрессировать молекулы главного комплекса гистосовместимости класса II и участвовать в представлении антигена лимфоцитам. Эти же клетки являются источником растворимых регуляторных факторов (хемокинов и цитокинов), оказывающих существенное влияние на миграцию, размножение, созревание и функционирование макрофагов и дендритных клеток (ИЛ-1, ИФН), Т- и В- лимфоцитов (ИЛ-10, трансформирующий фактор роста-бета) и т. д.
Таким образом, имеющиеся в литературе данные указывают на тесную взаимосвязь иммунной системы и кожи, позволяющую ряду авторов рассматривать кожу в качестве иммунокомпетентного органа (Козлов И. Г. «Иммунопатогенез дерматологических заболеваний». М. 2007).
Бактериальный фон кожи у собак: резидентные и транзиторные микроорганизмы
Со здоровой кожи собак можно высеять значительный спектр различных так называемых нормальных обитателей кожи. Их классификация предполагает такие понятия, как резидентные и транзиторные бактерии. Подобное разделение понятий вызвано способностью к размножению тех или иных бактериальных организмов.
К резидентным относят бактерии, которые способны к размножению на поверхности кожи собак, – бактерии Micrococcus; коагулазонегативные стафилококки, особенно Staphylococcus epidermidis и Staphylococcus xylosus; α-гемолитические стрептококки; бактерии Clostridium, Propionibacterium acnes; бактерии Acinetobacter, а также разнообразные грамотрицательные аэробные бактерии и иные микроорганизмы.
К транзиторным бактериям, которые не обладают способностью к размножению на поверхности здоровой кожи собак, относятся Escherichia coli, Proteus mirabilis, бактерии вида Corynebacterium, Bacillus, Pseudomonas, другие бактерии.
Основным патогеном, который наиболее часто вызывает бактериальное воспаление кожи у собак, является Staphylococcus Pseudointermedius. Существуют различные вариации штаммов этих бактерий. Одни из них относятся к резидентной, а другие к транзиторной флоре.
Изучение свойств Staphylococcus Pseudointermedius позволило исследователям ответить на вопрос, почему именно эти микробные организмы наиболее часто являются причиной воспаления кожи у собак. В связи с этим было обнаружено, что стафилококки обладают способностью к выраженной адгезии с поверхностью кератиноцитов, и эти бактерии воздействуют на иммунную систему как суперантигены.При этом считается, что Staphylococcus Pseudointermedius не обладает высокой патогенностью и лишь вызывает вторичные инфекции.
Основные причины развития бактериального воспаления кожи у собак
В качестве предрасполагающих факторов, вызывающих развитие бактериального поражения дермы собак, рассматривают некоторые кожные, метаболические, иммунные нарушения, а также первичные паразитарные и грибковые инфекции. В связи с этим выделяют ряд причин, которые (собственно) и приводят к развитию вторичного бактериального процесса: себорейные нарушения, аденит сальных желез, фолликулярные дисплазии; гипотиреоидизм, гиперадренокортицизм; первичные и вторичные иммунодефициты, аллергии; демодекоз, дерматофитии.
Особенный интерес представляют иммунные нарушения, которые во многом являются ключевыми в развитии бактериальной инфекции.
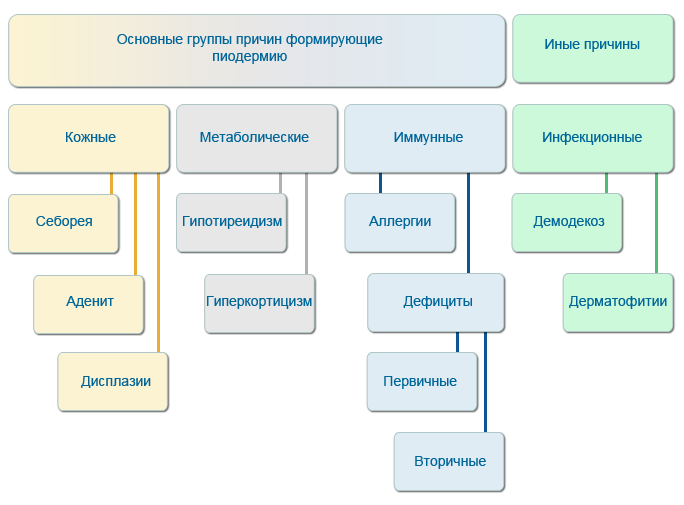
Чаще всего формируются вторичные иммунодефицитные состояния, возникающие в целом ряде случаев: на фоне применения иммуносупрессивных средств из-за перенесенного стресса или наличия заболеваний эндокринной системы, или прочих причин. Однако для собак актуальными являются также первичные иммунодефициты, обусловленные генетическими предпосылками. Они могут соотноситься с конкретными породами собак, например нарушение процессов биоцидности нейтрофилов у добермана-пинчера, ирландского сеттера, веймарской легавой; отсутствие С3 компонента комплемента у бретонского эпаньоля; нарушение функции естественных киллерных клеток у бультерьера; снижение общего количества В- и Т-лимфоцитов, нарушение общего количества и соотношения хелперных и цитотоксических Т-лимфоцитов при глубокой пиодермии немецких овчарок.
Первичные иммунные нарушения могут и не зависеть от породных признаков. К такому примеру, присущему для многих пород собак, можно отнести низкий уровень продукции иммуноглобулинов классов IgA и IgM.
Наиболее часто встречающиеся нозологические формы при пиодермиях у собак
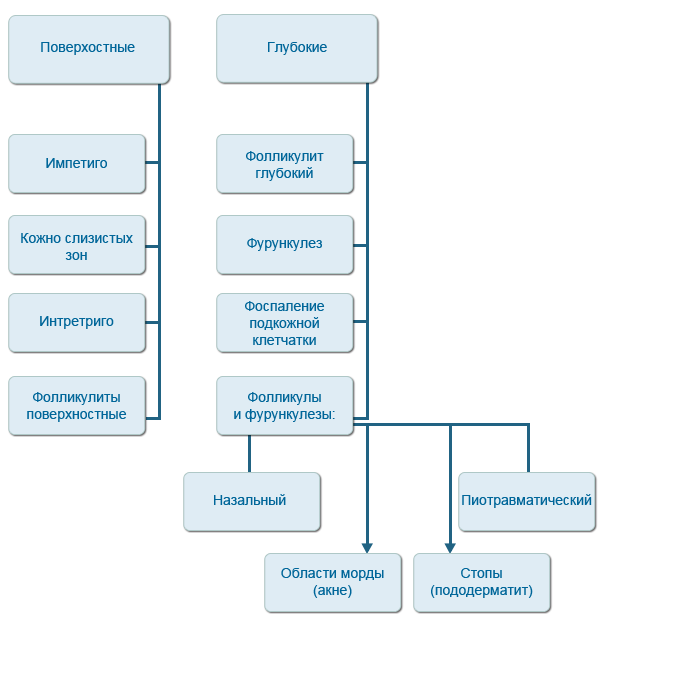
Бактериальное воспаление кожи собак, в зависимости от глубины проникновения процесса, принято разделять на поверхностные и глубокие пиодермии.
Поверхностные пиодермии включают импетиго у молодых собак, пиодермию кожно-слизистых зон, интертриго, а также поверхностный бактериальный фолликулит.
Глубокие пиодермии в ряду нозологий содержат глубокий фолликулит, фурункулез, воспаление подкожной клетчатки, пиотравматический фолликулит и фурункулез, назальный фолликулит и фурункулез, фолликулит и фурункулез области морды (акне).
Нозологические формы пиодермии.
Терапевтические подходы при антибактериальной терапии
Эффективность лечебных мер при антибиотикотерапии может определяться следующими факторами: наличием первичных заболеваний, глубиной и тяжестью воспалительного процесса, правильностью выбора и адекватностью дозы применяемого препарата, верным курсом лечения по принципу его продолжительности.
Если бактериальный процесс имеет поверхностный характер, а область поражения ограничена (импетиго), то бывает достаточно только местного лечения бактериального воспаления кожи посредством применения антибактериальных мазей. Такие мази могут содержать один из следующих компонентов: мупироцин, неомицин, гентамицин, бацитрацин или иные препараты выбора для местной терапии.
В том случае, если поверхностная пиодермия имеет распространенный характер, могут использоваться шампуни с содержанием перекиси бензоила, ацетата хлоргексидина или этиллактата. Шампуни могут применяться с интервалом 1 раз в 3-7 дней, что позволяет значительно уменьшить содержание бактерий на коже животного, имеющего микробные дерматиты. Чаще шампуни применяются в совокупности с системной антибиотикотерапией.
СЕГОДНЯ РЕЧЬ ИДЕТ О ТОМ, ЧТО ВЕТЕРИНАРНЫЙ МИР ВСЁ ЧАЩЕ СТАЛКИВАЕТСЯ С УСТОЙЧИВОЙ ФОРМОЙ БАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ (МЕТИЦИЛЛИН-РЕЗИСТЕНТНОСТЬЮ И МУЛЬТИ-РЕЗИСТЕНТНОСТЬЮ БАКТЕРИЙ). А ЭТО ОЗНАЧАЕТ, ЧТО: 1) ЕСЛИ ЕСТЬ ВОЗМОЖНОСТЬ НЕ ИСПОЛЬЗОВАТЬ СИСТЕМНЫЕ АНТИБИОТИКИ ВООБЩЕ, ЛУЧШЕ ИХ НЕ ИСПОЛЬЗОВАТЬ; 2) ЕСЛИ ТАКОЙ ВОЗМОЖНОСТИ НЕТ, ТО ИСПОЛЬЗОВАТЬ ИХ КРАЙНЕ РАЦИОНАЛЬНО! НИЖЕ РЕЧЬ ПОЙДЕТ О ТЕРАПЕВТИЧЕСКИХ ПОДХОДАХ ПРИ ГЛУБОКИХ ПИОДЕРМИЯХ. ПРИМЕНЯЯ ИХ, НЕ СЛЕДУЕТ ЗАБЫВАТЬ О ПУНКТЕ 2), ЗДЕСЬ ОБОЗНАЧЕННОМ.
При распространенном характере поверхностной пиодермии и при всех случаях глубокого бактериального воспаления кожи используются антибиотики общего действия. Среди них рассматривают целый перечень препаратов:
Антибиотики узкого спектра действия: эритромицин: 15 мг/кг каждые 8 часов; клиндамицин –5 мг/кг, каждые 12 часов; линкомицин – 5-15 мг/кг каждые 8 часов; тилозин (10-20 мг/кг каждые 12 часов).
Несмотря на такой значительный перечень препаратов, которые были применяемы исследователями при бактериальном поражении кожи у собак, на практике применяется лишь незначительный ряд антибиотиков.
Поскольку бактериальное воспаление кожи чаще всего требует достаточно длительной терапии и бактериальная устойчивость стала реальной угрозой, то выбор антибиотика, на наш взгляд, лучше всего осуществлять, учитывая минимальный риск возникновения нежелательных последствий по причине его применения. В связи с этим в нашей практике мы наиболее часто используем такие препараты, как цефалексин (22-30 мг/кг 2 раза в сутки); амоксициллин-клавуланат (22-30 мг/кг 2 раза в сутки). Это антибиотики первого выбора.
Длительность курса терапии определяется наличием остаточных клинических признаков пиодермии. Так, если при осмотре и при пальпации глубоких очагов поражения кожи не выявляется остаточных признаков воспаления, то последующий курс, с нашей точки зрения, может дополнительно составлять еще 7-14 дней. Это позволяет избегать возможности формирования рецидивов, связанных с тем, что курс лечения антибиотиком оказался недостаточно длительным. По- возможности, мы стараемся не использовать даже антибиотики первого выбора дольше 6 недель
Поскольку пиодермии имеют первичные предпосылки для своего развития, то в целом ряде случаев, несмотря на принятые лечебные меры, возникают рецидивы бактериального воспаления кожи у собак.
Поэтому, важно осуществлять поиск первопричины (см. первую схему даннйо публикации)
В случае формирования рецидива вторым этапом врачебной тактики может явиться смена антибиотика (хотя, чаще, мы сразу же прибегаем к посевам). Если после второго курса лечения уже иным антибиотиком пиодермия сохраняется или рецидивирует, тогда следует принять во внимание однозначную необходимость посевов на бактериальные среды с целенаправленным подбором антибиотика.
Если и после этого, не были достигнуты позитивные результаты лечения, возможно речь идет о рецидивирующей пиоедрме. В некоторых источниках предложены схемы такой, пожизненной терапии (приведены и обсуждаются ниже). Но их целесообразность вызвает большое сомнение, особенно в связи с вышеобозначеннной проблемой развития усточивых форм инфекций. Возможно, отдельным пациентам, такие схемы могут быть применимы, с обязательным использованием местных антисептических средств для кожи. И все более и более актуальными становятся альтернативные схемы лечения (применение аутовакцин, применение бактериофагов, и прочие).
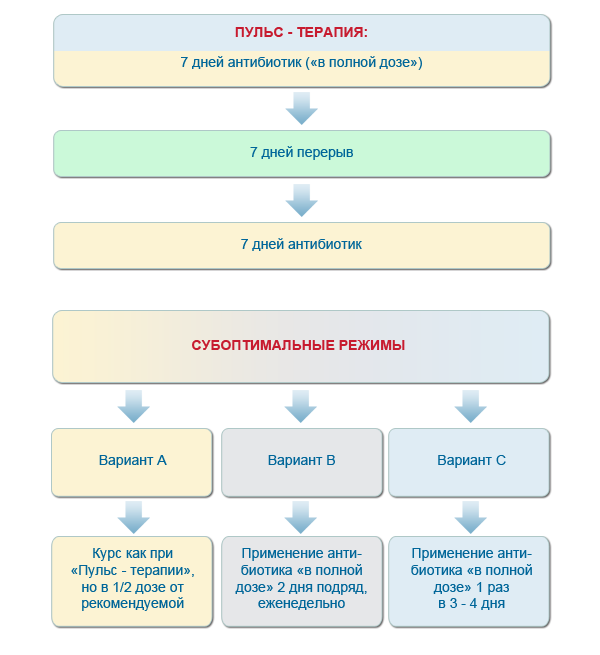
Ряд исследователей предлагает различные схемы терапии антибиотиков для : начинают с применения антибиотика до момента достижения клинического эффекта, затем может применяться пульс-терапия – каждые 7 дней в полной дозе с перерывом в течение 7 дней. Некоторые авторы рекомендуют субоптимальные режимы дачи антибиотика, например, после достижения клинического эффекта применять его в полной дозе – 2 дня подряд каждую неделю или 1 раз в три-четыре дня.
Применение аутогенных бактериальных вакцин
В ряде случаев на фоне применения аутогенных бактериальных вакцин достигался хороший результат. В российских условиях применяются вакцины, предназначенные для медицинской практики, например человеческая стафилококковая вакцина (схема применения: подкожно в нарастающей дозировке, ежедневно: 0,1; 0,2; 0,3; 0,4; 0,6; 0,8; 1,0 мл; далее – ежедневно по 1,0 мл до достижения эффекта).