кетоны в моче у ребенка что это значит норма
Детский многопрофильный медицинский центр для детей от 0 до 18 лет
Детский многопрофильный медицинский центр для детей от 0 до 18 лет
АЦЕТОН В МОЧЕ У РЕБЕНКА
Ацетон в моче (ацетонурия) у ребенка появляется в результате большого скопления кетоновых тел в крови. Когда их концентрация становится высокой, они начинают накапливаться, после чего почки сами выводят их вместе с мочой. Данное состояние может быть спровоцировано нарушением жирового обмена и нарушением функции усвоения углеводов.
Синтез кетоновых тел происходит в печени, они играют важную роль в организме человека, с их помощью нормализуется функция организма и восполняется источник энергии.
Нормальным и безопасным считается уровень ацетона в моче — 1—2 мг на 100 мл мочи, в суточном объеме мочи — 0.01—0.03 грамма.
При нормальной работе всех систем и органов кетоновые тела выводятся вместе с мочой и не задерживаются в крови. Повышение уровня ацетона в моче может указывать на временные нарушения у многих здоровых детей, а также свидетельствовать о наличии какого-либо заболевания и представлять угрозу для малыша.
Причины повышения ацетона в моче:
В большинстве случаев ацетонурия у детей объясняется незрелостью ферментной системы, а также другими физиологическими факторами, к которым относятся:
— переохлаждение, либо перегревание;
— обезвоживание организма;
— длительное голодание, низкокалорийное питание, бедное углеводами;
— нерациональное питание с большим количеством жиров, белков;
— переедание;
— постоянный стресс, переутомление;
— длительные переезды.
Бывают и более серьезные причины появления ацетона в моче:
— инфекционные заболевания, сопровождающиеся повышением температуры тела до высоких цифр, рвотой, жидким стулом;
— сахарный диабет, другие заболевания, связанные с нарушением обмена веществ;
— обострение хронических заболеваний;
— интоксикация при пищевых и других отравлениях;
— травмы и др.
Симптомы при повышенном ацетоне в моче:
Если вовремя не обратиться за врачебной помощью и не устранить провоцирующие факторы, ситуация может ухудшиться и привести к ацетонемическому синдрому.
Ацетонемический синдром-это комплекс симптомов, которые проявляются при повышении уровня ацетона в моче.
Проявления ацетонемического синдрома:
При появлении вышеперечисленных симптомов следует незамедлительно обратиться за медицинской помощью.
Диагностика ацетонурии
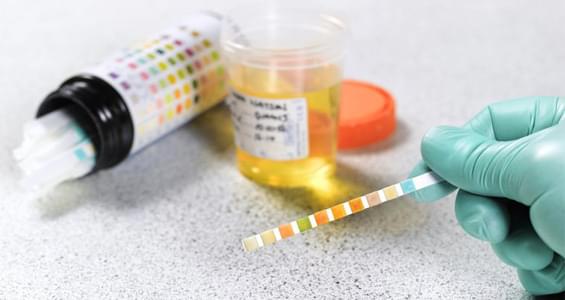
При возникновении симптомов ацетонурии, появлении запаха ацетона изо рта(от мочи)ребенка, необходимо провести обследование, включающее в себя: развернутый анализ крови, общий анализ мочи, биохимический анализ крови( общий белок, глюкоза). Также, уровень кетонов в моче, можно определить и в домашних условиях, с помощью специальных тест-полосок.
Детям, страдающим ацетонемическим синдромом, рекомендовано регулярно проводить следующее обследование: УЗИ органов брюшной полости, раз в полгода делать лабораторные анализы мочи и крови, тест на усвоение глюкозы.
Диета при повышенном уровне ацетона в моче
Если у ребенка хотя бы раз наблюдалась повышенная концентрация ацетона, то в дальнейшем важно придерживаться определенных правил в питании малыша:
— рекомендованы каши, приготовленные на воде (рисовая, гречневая, овсяная, кукурузная),супы на овощном бульоне,нежирные сорта мяса( приготовленные на пару), свежие фрукты,сахар, мед – в разумных пределах, печенье.
Остались вопросы? Запишитесь на прием к врачу-педиатру!
Телефон для записи на прием (391) 200—50—03
Поднялся ацетон у ребенка: что делать родителям?
Согласно медицинской статистике, каждый пятый родитель сталкивается с ситуацией, когда у ребенка внезапно поднимается высокая температура, а изо рта исходит сильный запах ацетона, напоминающий некоторым запах моченых яблок. Все это сопровождается сильной рвотой и тошнотой. Подобные симптомы напоминают классическое отравление, поэтому многие родители сразу начинают лечить ребенка сорбентами и промываниями. Не многие могут заподозрить ацетонемический синдром у детей и правильно оказать первую помощь.
В этой статье рассмотрим механизм возникновения высокого уровня ацетона в крови у ребенка, его причины и симптомы. Узнаем, почему повышается ацетон при температуре и какие лекарства использовать при ацетоне?
Повышение ацетона не болезнь, а симптом
У людей в детском возрасте уровень глюкозы очень низкий. Когда инсулина не хватает, то организм начинает использовать альтернативный источник – жиры. Это заставляет организм сжигать жир в качестве альтернативного источника получения энергии, которая необходима мышцам и тканям. В процессе этих биохимических превращений образуется вещество под названием ацетон.
Сильный запах ацетона изо рта у ребенка указывает на протекание агрессивных процессов в организме, связанных со значительным повышением уровней кетоновых тел, возникающих в ответ на нарушение усвоения белков, жиров и углеводов. Кетоны или кетоновые соединения – это вещества, вырабатываемые в качестве побочных продуктов печенью при недостатке глюкозы для превращения в энергию. Кроме того, при дефиците инсулина уменьшается использование кетонов в мышечных клетках, что также увеличивает их содержание в организме.
Существует 3 типа кетоновых тел:
Ацетоацетат и бета-гидрокси-масляная кислота отвечают за перенос энергии из печени в другие ткани тела. Ацетон, при этом, оказывается наименее используемым веществом. Он разрушается и выводится в виде отходов через дыхательные пути или мочу. Поэтому то, повышение ацетона так чувствуется в дыхании ребенка и легко обнаруживается в моче.
Механизм запуска ацетонемического синдрома:
Незначительное присутствие кетонов в крови считается нормальным явлением для организма. Они выводятся, главным образом, через легкие, поэтому их количество в моче с помощью тестов (например, Цито-тест) не обнаруживается.
Норма кетонов в моче здорового человека – их полное отсутствие.
Безопасные уровни не вызывают патологический запах ацетона со рта у ребенка и не ухудшают его общее самочувствие. Однако, несбалансированное питание с преобладанием жиров и белков, способствует чрезмерному накоплению кетоновых соединений и организм переходит в состояние кетоза.
Причины повышения ацетона у детей
Повышенный ацетон у новорожденных может появиться, если малыш находится на искусственном вскармливании из-за нарушений пищеварения и дефицита ферментов.
Симптомы ацетона у ребенка
При кетоацидозе запах ацетона у детей определенно не является единственным признаком. Типичные симптомы ацетона включают сильную тошноту, рвоту, сильную боль в животе и обезвоживание, напоминая отравление. Также наблюдается озноб, сухость во рту, спутанность сознания, после активного периода тревоги и спазмов, ребенок испытывает сонливость и усталость. Данная болезнь особенно распространена среди детей в возрасте от 18 месяцев до 5 лет.
Диагностика повышенного ацетона у ребенка
Если от ребенка пахнет ацетоном, необходимы некоторые лабораторные исследования для выяснения диагноза. Для этого необходим ряд клинических анализов:
Нормой ацетона в крови у детей считается показатель ниже 0,6 ммоль/л, уровень 0,6-1,5 ммоль/л может указывать на развитие диабетического кетоацидоза, а >1,5 ммоль/л – на сам кетоацидоз.
Уровень кетонов в крови (ммоль/л)
Уровень кетонов в моче
негативный или следы
Диагнозацетонемического синдрома, как правило, подтверждается наличием высокого уровня глюкозы в крови наряду с аномальными уровнями кетонов и кислотностью крови. При этом, причина его возникновения может быть различной. Поэтому дополнительно может быть назначены исследования гормональной панели, в частности уровня гормонов щитовидной железы (T3, T4 и TTG) и наличия антител. В зависимости от клинической картины ребенку иногда следует пройти УЗИ печени и почек.
При подозрении на повышенный ацетон у ребенка, родители могут проверить его в домашних условиях. Для этого необходимо иметь тест-полоски, например Ацетонтест или CITOLAB, которые можно приобрести в любой аптеке. Используют их независимо от времени суток и приема пищи.
Для проведения домашнего теста необходимо собрать мочу в чистый контейнер и следовать инструкции производителя на упаковке. Как правило, схема достаточно проста:
Крайне важно запомнить ситуации, при которых необходимо как можно быстрее определить уровень кетонов в моче:
Особенно важно делать диагностику людям с диабетом первого типа, при котором иммунная система атакует и разрушает клетки поджелудочной железы, вырабатывающие инсулин.
Высокий ацетон у детей: лечение
Как мы уже выяснили, запах ацетона у детей не является самостоятельным заболеванием. В связи с этим лечение будет зависеть от основной патологии, вызвавшей этот симптом. Самостоятельно придумывать лечение ребенку не стоит. Поставить диагноз и подобрать лечение должен терапевт. Чтобы не терять время до начала осмотра, ребенку можно поднять уровень сахара. Вы можете приготовить сладкий компот или сок из клюквы, облепихи, а также настой из шиповника. Особенно эффективным считается отвар из изюма. Эти ягоды укрепляют иммунитет, улучшают обменные процессы и нормализуют работу пищеварительной системы. Тяжелые состояния, в частности, ацетоновый криз, требуют госпитализации и внутривенного введения физиологического раствора глюкозы, сорбентов и электролитов (Ресорбилакт, Трисол, раствор Рингера).
Ацетоновый синдром у ребенка начинается с приступов тошноты и рвоты, вызывая серьезные нарушения водного-электролитного баланса и падению уровня глюкозы. Поэтому лечение ацетона у детей основано на возобновлении именно этих показателей. Чтобы облегчить состояние маленького пациента важно очистить кишечник и желудок от скопившихся токсинов. Для этого рекомендуется промыть желудок слабым содовым раствором и дать малышу сорбент, например активированный уголь, Атоксил, Сорбекс, Энтеросгель и др.
Восстановить электролитный баланс поможет Регидрон, Хумана Электролит, а также щелочная минеральная вода без газа. Пакет Регидрона разводят в 1 литре теплой воды для приема по 5-10 мл на каждый килограмм массы тела, который необходимо выпить в течение 1 часа после каждого приступа рвоты. Существует правило, согласно которому можно восполнить объем жидкости и электролитов в организме ребенка с тошнотой и рвотой: пейте небольшими количествами (по 5-15 мл), но каждые 10-15 минут.
Если рвота становится непобедимой, то в экстренных ситуациях детям с 1-го года дают Церукал или Метоклопромид. Терапевтическая разовая доза для детей в возрасте 2-14 лет составляет 0,1 мг на 1 кг массы тела.
После ацетонового кризиса детский организм находится в ослабленном состоянии. Чтобы его поддержать, необходимы витаминные комплексы(Аскорутин, Ревит, Ундевит), источники аминокислот и гепатопротекторы (Бетаргин, Энерлив, Гепафорте), которые восстановят метаболические процессы и ускорят регенерацию клеток печени.
Диета при ацетонемии: что можно кушать ребенку при высоком уровне ацетона?
Во время острого периода заболевания диета основывается на обильном режиме питья. Пища в этот период должна быть легко перевариваемой и содержать в основном углеводы. Через неделю можно подключать кисломолочные продукты. Еще через две недели можно давать постное мясо, допускаются бананы. Постепенно рацион необходимо расширять списком разрешенных продуктов, кроме молока (от него нужно отказаться на 1-2 месяца).
В первый день повышения ацетона у ребенка старайтесь его не кормить. Необходимо лишь питье каждые 5 минут. Если он захочет есть, предложите сухие домашние крекеры. На второй день будет уместен рисовый суп без мяса, на третий день – любая каша на воде. Из злаков лучше готовить рис, овес или гречку.
Рекомендуемые продукты
Следует исключить из рациона
Ацетон у ребенка
Что такое ацетонемический синдром или ацетон у ребенка?
Первое, что нужно запомнить: ацетон у ребенка — это не болезнь (не связан с вирусной или бактериальной инфекцией), а сигнал, что в организме закончилась глюкоза и в крови возник переизбыток кетоновых тел. Кетоны — это группа веществ, образующихся в печени, продукты неполного окисления жиров в виде ацетона и подобных ему соединений.
Как возникает ацетон
Детский организм устроен также, как и взрослый, но отдельные органы работают еще не в полную силу. Углеводы, получаемые из пищи, перерабатываются в желудке и в кровь поступает глюкоза, большая часть которой идет на получение энергии, а часть накапливается в печени в виде гликогена.
Запас глюкозы (гликоген) и у взрослых и у детей активно расходуется при повышении физической и психической нагрузки, но у детей он значительно меньше, поэтому заканчивается быстрее. В ход идут жиры, при распаде которых также образуется небольшое количество энергии, но одновременно появляются кетоны. Если детский организм не получит вовремя глюкозу, жиры начнут расщепляться слишком активно, и кетонов образуется большое количество.
Быстро распространяясь с кровью по всему организму, они отравляют его. Ацетон раздражает рвотный центр и вызывает постоянную (ацетонемическую) рвоту, появляется запах ацетона при дыхании и ацетон в моче, возникает опасность обезвоживания.
Что способствует появлению ацетона в моче и крови ребенка
Основные признаки
Опасные симптомы — нужна срочная помощь
Диагностика ацетонемического синдрома
Первые признаки проявляются в двух-трехлетнем возрасте, к семи-восьми годам могут участиться, в 12-13 лет, как правило, прекращаются.
Если у ребенка впервые появился ацетон необходимо обязательно обратиться к педиатру, например, к специалисту медицинского центра «Таврия». Ацетонемический синдром определяется только врачом, так как запах ацетона в моче может быть признаком инсулиновой недостаточности, существует риск появления сахарного диабета. В этих случаях требуется срочная консультация эндокринолога, гастроэнтеролога и психотерапевта, получить которую можно здесь же в центре.
Кроме того, существует первичный идиопатический ацетономический синдром, где главный провоцирующий фактор — наследственная предрасположенность.
Лечение ацетона у детей
Синдром гиперкетонемии у детей и подростков: патогенез, причины, диагностика
В статье представлены современные данные о физиологии энергетического обмена и роли в нем кетоновых тел. Рассмотрены основные причины избыточного образования кетонов, методы диагностики, подходы к лечению.
The article presents modern data on the physiology of energy metabolism and the role of ketone bodies in it. The main causes of excessive ketone formation, diagnostic methods, approaches to treatment are considered.
Часть 1
Кетоновые тела (ацетоновые тела) — группа органических соединений, являющихся промежуточными продуктами обмена углеводов, жиров, белков. Кетокислоты — это продукт метаболизма ацетил-коэнзима А (ацетил-КоА), который при дефиците пищи образуется либо из собственных белков, либо из жира. К кетоновым телам относятся β-оксимасляная кислота (β-оксибутират), ацетоуксусная кислота (ацетоацетат) и ацетон.
Физиология энергетического обмена
Кетоновые тела синтезируются в основном в митохондриях печеночных клеток из ацетил-КоА, который объединяет несколько ключевых метаболических процессов клетки. Главная функция ацетил-КоА — доставлять атомы углерода с ацетил-группой в цикл трикарбоновых кислот (ЦТК, цикл Кребса), чтобы те были окислены с выделением энергии. Содержание ацетил-КоА определяет направление клеточного метаболизма в данный момент: будет ли происходить синтез и накопление гликогена, жира и синтез белков или, наоборот, будут расходоваться ранее накопленные энергозапасы в организме.
Образование кетоновых тел является физиологическим процессом и необходимой частью энергетического обмена. В процессе этого обмена происходит «сгорание» и взаимотрансформация углеводов, белков, жиров и других энергосубстратов с образованием энергии, которая либо превращается в тепло, либо аккумулируется в виде аденозинтрифосфата (АТФ).
В условиях дефицита энергии в организме воссоздание энергетических запасов возможно за счет активации глюконеогенеза или синтеза кетоновых тел (кетогенез).
Кетоновые тела играют важную роль в поддержании энергетического баланса организма, а активация кетогенеза является более целесообразной и оптимальной для организма в этих условиях. Кетоновые тела не только сохраняют структурные белки организма, угнетая секрецию и действие глюкагона — мощного стимулятора глюконеогенеза, но и по механизму обратной связи регулируют и ограничивают интенсивность кетогенеза [1].
Глюконеогенез — это метаболический путь биосинтеза глюкозы из не углеводных предшественников, активный в печени, почках, тонком кишечнике. Когда запасы гликогена в организме исчерпываются, печень переходит на синтез его путем глюконеогенеза. Субстратами глюконеогенеза являются: пировиноградная кислота (пируват), молочная кислота (лактат), глицерол, глюкогенные аминокислоты, жирные кислоты.
Трансформация пировиноградной кислоты возможна двумя путями — аэробным или анаэробным. Гликолиз, или путь Эмбдема–Мейергофа, — основной путь утилизации глюкозы в клетках. Одна молекула глюкозы превращается при этом в две молекулы пировиноградной кислоты. Превращение пирувата в ацетил-КоА происходит при участии набора ферментов, структурно объединенных в пируватдегидрогиназный комплекс (ПДК).
При аэробных условиях пируват проникает в митохондрии. Образованный ацетил-КоА в цикле Кребса окисляется до СО2 и Н2О. Основная часть глюкозы расходуется на синтез АТФ в процессе окислительного фосфорилирования.
Если содержание кислорода недостаточно, как это может быть в скелетных мышцах при интенсивной физической нагрузке или в тканях, где нет или очень мало митохондрий (эритроциты, белые мышцы, клетки сетчатки глаза, мозгового слоя коры надпочечников), гликолиз является конечным энергетическим процессом, в результате которого пируват преобразуется в лактат, а последний в продукт анаэробного гликолиза. Он образуется при любых состояниях организма в эритроцитах и работающих мышцах. Избыток лактата поступает в печень, где из него вновь синтезируется глюкоза (глюконеогенез). Таким образом, лактат используется в глюконеогенезе постоянно.
При мышечной работе глюкоза в миоците используется не только на энергетические нужды, но и на обеспечение постоянного притока оксалоацетата в ЦТК. При этом с увеличением продолжительности нагрузки «энергетическая» роль глюкозы снижается [2].
Ацетил-КоА является ключевым метаболитом липидного обмена. Он образуется при β-окислении жирных кислот в митохондриях печени. В матриксе митохондрий печеночных клеток происходит окисление жирных кислот в цикле Кноппа–Линена. Ключевым участником этого процесса является L-карнитин, который транспортирует длинноцепочечные жирные кислоты в митохондрии через внутреннюю мембрану последних. Этот процесс является инсулинозависимым. В норме цитрат образуется путем конденсации оксалоацетата и ацетил-КоА с участием фермента цитрат-синтетазы.
Аминокислоты (лейцин, тирозин, фенилаланин), образующиеся в результате распада мышечных белков, включаются в глюконеогенез при длительном голодании или продолжительной мышечной работе. В процессе катаболизма они превращаются в ацетоацетат и могут использоваться в синтезе кетоновых тел.
Включение лактата, глицерола и аминокислот в глюконеогенез зависит от физиологического состояния организма. При окислении одной молекулы β-оксибутирата образуется СО2 и Н2О и обеспечивается синтез 27 молекул АТФ.
Биологическая роль кетоновых тел
Кетоновые тела играют важную роль в поддержании энергетического баланса. Образовавшиеся ацетоновые тела поступают из гепатоцитов в кровь и разносятся к клеткам различных органов. Ацетоновые тела в норме достаточно хорошо утилизируются клетками периферических тканей, в особенности это касается скелетных мышц и миокарда, которые значительную часть нужной им энергии получают за счет окисления ацетоновых тел. Основным путем активации ацетоацетата в клетках является путь с участием тиафоразы. В гепатоцитах нет этого фермента. Именно поэтому образовавшийся в гепатоцитах ацетоацетат в них не активируется и не окисляется, тем самым создаются условия для «экспорта» ацетоацетата из гепатоцитов в кровь.
У здоровых при усилении липолиза увеличивается скорость утилизации кетоновых тел, которые являются важными источниками энергии при мышечной работе, голодании. Скелетные мышцы и почки используют кетоновые тела даже при их низкой концентрации в крови. Лишь клетки центральной нервной системы в обычных условиях практически не утилизируют ацетоновые тела [3].
Кетоновые тела это часть метаболического регулярного механизма для предотвращения излишней мобилизации жирных кислот и сдерживания протеолиза, что сберегает структурные белки организма. В норме кетоновые тела стимулируют выход инсулина из поджелудочной железы, что угнетает липолиз и таким образом ограничивает доставку липидов в печень и соответственно кетогенез. Во время голодания кетоновые тела являются одним из основных источников энергии для мозга [4]. В норме процессы синтеза и использования кетоновых тел уравновешены. Концентрация кетоновых тел в крови и в тканях обычно очень низка, поэтому содержание кетоновых кислот в плазме крови в норме присутствует в крайне низких количествах и составляет 0,1–0,3 ммоль (0,03–0,2 ммоль/л по ацетону).
Наличие кетоновых тел в моче всегда указывает на развитие патологического состояния в организме. Кетоновые тела удаляются с мочой в различных количествах: ацетон — 3–4%, ацетоуксусная кислота — 30–40%, β-гидроксимасляная — 60–70%.
Лабораторные тесты, выявляющие кетонурию, основаны на реакциях с ацетоацетатом и ацетоном, так как они не реагируют с β-оксибутиратом. Для качественного определения содержания кетоновых тел в моче используют цветные пробы Ланге, Легаля, Лестраде, Герхарда. Количество ацетоацетата в анализе мочи измеряют в плюсах (от одного + до четырех ++++). Присутствие +++ соответствует повышению уровня кетоновых тел в 400 раз, ++++ — в 600 раз. Физиологический кетоз может выявляться при голодании, тяжелой мышечной работе, у новорожденных [5].
Причины избыточного кетоза
Возникающая в патологических условиях гиперкетонемия связана с диссоциацией кетогенеза в печени и утилизацией кетоновых тел в других органах, то есть либо скорость синтеза кетоновых тел в печени превышает скорость их утилизации периферическими тканями организма, либо нарушена утилизации их как источника энергии в других органах.
Повышение содержания кетоновых тел в организме прежде всего вызывается дефицитом углеводов для обеспечения организма энергией, перегрузкой белками и жирами на фоне недостатка легкоперевариваемых углеводов в рационе, истощением организма, ожирением, нарушением эндокринной регуляции (сахарный диабет, тиреотоксикоз и др.), отравлением, травмами черепа и т. д. [4].
Интенсивное образование кетоновых тел происходит также при наличии дефицита оксалоацетата, так как последний является основным регулятором ЦТК. Обычно в клетке имеется баланс между образованием ацетил-КоА (из глюкозы, жирных кислот или аминокислот) и количеством оксалоацетата. Источником оксалоацетата является глюкоза (синтез из пирувата), поступление из фруктовых кислот самого цикла (яблочной, лимонной), образование из аспарагиновой кислоты. При недостаточном количестве оксалоацетата в плазме крови, наблюдаемом при патологических состояниях, концентрация кетоновых тел может значительно повышаться. Не успевая окисляться и представляя собой достаточно сильные органические кислоты, они вызывают развитие метаболического кетоацидоза.
Стимуляция кетогенеза при дефиците пищи, стрессе, длительной рвоте является компенсаторным процессом, в ходе которого восполняется энергетический дефицит за счет кетокислот.
Гиперкетонемия со сдвигом рН в кислую сторону может наблюдаться при угнетении цикла Кребса, в котором происходит «сгорание» кетоновых тел.
Скорость образования кетоновых тел зависит и от скорости окисления жирных кислот в печени, а процесс окисления ускоряется при усилении липолиза (распада жира) в жировой ткани. Интенсивное образование кетокислот происходит также при приеме с пищей так называемых кетогенных аминокислот (лейцина, тирозина, фенилаланина, изолейцина), некоторых белков и большого количества жиров [5].
При умеренном кетозе в крови циркулируют главным образом ацетоацетат и β-оксибутират. Ацетон образуется только при высоких концентрациях кетоновых тел и преимущественно удаляется через легкие.
Однако в экстремальных условиях из кетоновых тел с помощью глюконеогенеза может синтезироваться глюкоза, служащая источником энергии для работы центральной нервной системы.
Ацетоновые тела, накапливаясь в крови и тканях, оказывают ингибирующее действие на липолиз, в особенности это касается расщепления триглицеридов в адипоцитах. Снижение уровня липолиза в клетках жировой ткани приводит к уменьшению притока высших жирных кислот в гепатоциты и к снижению скорости образования ацетоновых тел и, следовательно, снижению их содержания в крови.
При дефиците энергии в результате изменения гормонального статуса и действия внутриклеточных механизмов регуляции нарастает скорость мобилизации жиров и усиливается глюконеогенез из аминокислот и глицерина. Липолиз активируется глюкагоном, адреналином. Длительная стимуляция кетогенеза или нарушение процессов кетолизиса приводят к изменению буферной емкости крови, а при содержании в чрезмерно высоких концентрациях кетоновых тел крови возникает угрожающий жизни декомпенсированный кетоацидоз.
Такая картина характерна при тяжелом течении сахарного диабета 1-го типа, гипогликемии, длительном голодании, стрессах различной этиологии, заболеваниях печени, тяжелой и длительной мышечной работе [6].
Кетоновые тела являются водорастворимыми кислотами, поэтому, в отличие от жирных кислот, они могут проходить через гематоэнцефалический барьер и служат, наряду с глюкозой, источником энергии для нервной ткани, особенно после 3–5 дней голодания, когда концентрация кетоновых тел в крови существенно увеличивается.
Сахарный диабет
Сахарный диабет 1-го типа является самой частой причиной кетоза и кетоацидоза. Ведущую роль в патогенезе кетоацидоза играет абсолютная инсулиновая недостаточность, приводящая к снижению утилизации глюкозы инсулинзависимыми тканями и, соответственно, гипергликемии и тяжелому энергетическому голоду в них. Инсулин влияет на все виды обмена. Дефицит инсулина при сахарном диабете является причиной резкого повышения в крови уровня всех контринсулярных гормонов (глюкагона, кортизола, катехоламинов, тироксина и др.). Они стимулируют мобилизацию липидов из жировых депо и доставку жирных кислот к органам, что является адаптивным механизмом, поставляющим альтернативный субстрат окисления в условиях снижения утилизации глюкозы клетками. Снижается активность липопротеинлипазы (ЛП-липазы) адипоцитов, поэтому свободные жирные кислоты не поступают в жировую ткань. Начинает преобладать эффект глюкагона, стимулирующий кетогенез в печени и гормончувствительную триацилглицерол-липазу (ТАГ-липазу) в адипоцитах.
При сахарном диабете в избыточном количестве начинает образовываться продукт β-окисления жирных кислот — ацетил-КоА. Однако способность цикла Кребса утилизировать данный продукт существенно снижена, так как β-окисление свободных жирных кислот в митохондриях зависит от их транспорта через мембрану митохондрий. А этот процесс является инсулинозависимым.
Если он затруднен, то жирные кислоты быстро превращаются в ацил-КоА, из которого образуется ацетил-КоА. Цикл Кребса и ресинтез жирных кислот не в состоянии полностью использовать избыточно образующийся ацетил-КоА, тем более что цитратный цикл тормозится этим избытком. В норме цитрат образуется путем конденсации оксалоацетата и ацетил-КоА с участием фермента цитрат-синтетазы. Активность последней при декомпенсации диабета снижена, в частности, из-за ингибирующего влияния АТФ, образующейся в избытке при окислении жирных кислот.
Уменьшено и образование оксалоацетата, так как в результате усиленного окисления свободных жирных кислот и повышенного глюконеогенеза увеличивается соотношение NADH/NAD+. Это ведет к недостаточному образованию цитрата и накоплению ацетил-КоА.
Этому процессу способствует увеличение содержания в печени карнитина (особенно в условиях активации эффектов глюкагона). Карнитин стимулирует транспорт жирных кислот в митохондрии клеток печени, где они подвергаются β-окислению, значительно ускоряя кетогенез.
В результате избыток ацетил-КоА становится источником образования больших количеств кетоновых тел: β-оксимасляной, ацетоуксусной кислот и ацетона.
У больных сахарным диабетом 1-го типа нарушается белковый обмен, который характеризуется преобладанием процессов катаболизма в результате активации процесса глюконеогенеза из глюкогенных аминокислот и снижения проницаемости клеточных мембран для аминокислот, что приводит к недостатку в тканях свободных аминокислот и нарушению процесса синтеза белка [6].
Гипоксия тканей вызывает активацию анаэробного гликолиза и повышение содержания лактата, который не может быть утилизирован в результате дефицита лактатдегидрогеназы на фоне дефицита инсулина. Это усугубляет нарушение кислотно-щелочного баланса организма и приводит к возникновению лактоацидоза.
Активное нарастание содержания кетоновых тел при декомпенсации сахарного диабета связано не только с усиленной продукцией, но со сниженной периферической утилизацией. При избыточном накоплении кетоновых тел буферная способность крови быстро истощается, что приводит к развитию декомпенсированного метаболического кетоацидоза. Кетоновые тела начинают выделяться с мочой в виде натриевых солей, а ацетон — также и в составе выдыхаемого воздуха.
Следствием увеличения концентрации ацетоацетата является ускорение образования ацетона, который обладает токсическим свойством. Он растворяется в липидных компонентах клеточных мембран и дезорганизует их. Страдают все ткани организма, а больше всего — клетки нервной ткани. Нарушается работа многих ферментативных систем. Это может проявляться потерей сознания [7].
При сахарном диабете 2-го типа сохраняется минимальная продукция инсулина, что объясняет редкость развития липолиза и состояния кетоацидоза и кетоацидотической комы при нарастании гипергликемии.
Гипогликемия и гипогликемические состояния
Кетотическая гипогликемия является самой частой причиной низкой концентрации глюкозы в крови. Стимуляция кетогенеза в условиях синдрома гипогликемии связана с активацией процессов липолиза при тяжелом энергетическом голоде. По мере истощения запасов гликогена в печени повышается содержание глюкагона, адреналина, норадреналина, кортизола, гормона роста, которые стимулируют глюконеогенез [8, 9].
Из жировой ткани интенсивно метаболизируются жирные кислоты для обеспечения источника энергии для мышечной деятельности и доступной глюкозы для центральной нервной системы. Жирные кислоты окисляются в печени с образованием кетоновых тел — ацетоацетата и β-оксибутирата.
Гипогликемии при дефиците ферментов
Нарушения обмена гликогена, связанные с его патологическим депонированием, проявляются гликогеновыми болезнями. Это группа наследственных нарушений, в основе которых лежит снижение или отсутствие активности ферментов, катализирующих реакции синтеза (агликогенозы) или распада гликогена (гликогенозы).
Дефект фермента глюкозо-6-фосфатазы (болезнь Гирке). Первичное нарушение при болезни Гирке (гликогеноз 1-го типа) происходит на генетическом уровне. Оно состоит в полной или почти полной неспособности клеток продуцировать глюкозо-6-фосфатазу, обеспечивающую отщепление свободной глюкозы от глюкозо-6-фосфата. В результате этого гликогенолиз прерывается на уровне глюкозо-6-фосфата и дальше не идет. Дефосфорилирование с участием глюкозо-6-фосфатазы является ключевой реакцией не только гликогенолиза, но и глюконеогенеза, который, таким образом, при болезни Гирке также прерывается на уровне глюкозо-6-фосфата.
Возникновение устойчивой гипогликемии, которая в реальных условиях неизбежна из-за непоступления в кровь глюкозы как конечного продукта гликогенолиза и глюконеогенеза, в свою очередь приводит к постоянной повышенной секреции глюкагона как стимулятора гликогенолиза. Глюкагон, однако, в условиях прерывания этого процесса способен лишь без пользы для организма непрерывно стимулировать его начальные стадии.
Психическое и соматическое развитие, а также биохимический статус (повышение уровня триглицеридов, холестерина, гиперурикемия, гипофосфатемия) у этих больных резко нарушены. Содержание глюкозы в плазме натощак постоянно снижено, в связи с чем даже при кратковременном голодании развиваются гипогликемические судороги, кетонурия и метаболический ацидоз. Последний обусловлен не только гиперкетонемией, но и повышенным накоплением и образованием в крови пирувата и лактата, что является результатом нарушенного глюконеогенеза. Характерными чертами заболевания являются: олигофрения, задержка роста, ожирение, остеопороз, большой живот (следствие увеличения печени и почек), ксантоматоз, липемия сетчатки, геморрагический диатез.
Диагноз основывается на данных клинической картины, сниженного содержания глюкозы и повышенной концентрации липидов и лактата в крови. Уровень глюкозы в плазме практически не меняется после введения глюкагона. Однако содержание лактата в крови после его введения возрастает. Биопсия печени, специальные гистохимические методы подтверждают недостаточность соответствующих ферментов [10].
Некоторые гипоталамо-гипофизарные синдромы могут сопровождаться гипогликемией: синдром Лоренса–Муна–Бидля–Борде, синдром Дебре–Мари, синдром Пехкранца–Бабинского (адипозогенитальная дистрофия).
Синдром Лоренса–Муна–Бидля–Борде характеризуется ожирением, гипогонадизмом, умственной отсталостью, дегенерацией сетчатки, полидактилией, глубокими дегенеративными изменениями гипоталамо-гипофизарной системы.
Синдром Дебре–Мари — заболевание обусловлено гиперфункцией задней доли гипофиза и гипофункцией аденогипофиза. Проявляется в раннем детском возрасте. Больные инфантильны, низкорослы, с избыточной массой. В клинической картине типично нарушение водного обмена с олигурией и олигодипсией, плотность мочи высокая. Психическое развитие не нарушено.
Синдром Пехкранца–Бабинского — причиной заболевания считают органические и воспалительные изменения гипоталамуса, которые ведут к ожирению, аномалиям развития скелета и гипоплазии половых органов.
Ожирение
Бурное нарастание ожирения во всех возрастных группах людей в большей степени связано с изменением образа жизни: снижение двигательной активности (компьютеризация, автомобилизация, урбанизация), изменения характера питания (переедание) и т. д. Избыточное поступление энергии или снижение ее затраты приводит к увеличению массы тела и развитию ожирения.
Жировая ткань обладает высокой метаболической активностью. В ней непрерывно совершаются интенсивные процессы обмена веществ, такие как синтез и гидролиз липидов, синтез жирных кислот, в том числе из углеводов, их этерификация в триглицериды или нейтральный жир, депонирование и расщепление их с образованием жирных кислот, использование последних для энергетических целей.
Ожирение приводит к значительным метаболическим и обменным нарушениям. Они характеризуются гиперинсулинизмом и нарушением толерантности к глюкозе; инсулинорезистентностью, вызываемой нарушением инсулинорецепторных взаимоотношений; увеличением содержания свободных жирных кислот в крови, склонностью к кетогенезу при голодании и к гипертриглицеридемии. При ожирении понижается активность липолитических ферментов в жировой ткани: липазы триглицеридов, что приводит к их накоплению, и липопротеинлипазы. Расщепление липопротеидов снижается. Гипертрофированные адипоциты слабее, чем гиперплазированные, реагируют на адреналин, норадреналин и другие липолитические вещества [11].
Важным проявлением нарушения межуточного обмена при ожирении является кетоз, связанный с повышенным липолизом, избыточным поступлением свободных жирных кислот в печень. Скорость реакции в ЦТК снижена, так как оксалоацетат используется для глюконеогенеза. В результате скорость образования ацетил-КоА превышает способность ЦТК окислять его. Ацетил-КоА используется для синтеза кетоновых тел. Из-за избытка кетоновых тел нарушается их утилизация.
Этому способствует наблюдающаяся гипогликемия, гиперлипидемия, кетонемия при применении длительной гипокалорийной диеты. А сопутствующий дефицит углеводов тормозит использование ацетил-КоА в цикле Кребса. При дефиците углеводов в организме возникает недостаток энергии в клетках. Усиливается липолиз [12].
Избыток неэстерифицированных жирных кислот, поступающих в печень, вызывает развитие жировой инфильтрации в ней, что нарушает окисление и выведение липопротеидов из печени, обуславливая накопление кетоновых тел. Для эффективного использования продуктов распада жира необходимы продукты углеводного обмена — жиры «сгорают» в пламени углеводов.
Окончание статьи читайте в следующем номере.
ФГБОУ ВО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва