клетки нек293 что это
Клетки нек293 что это
Известно, что липопротеины могут связывать и транспортировать, в том числе и через цитоплазматическую мембрану, ксенобиотики, жирорастворимые витамины, стероидные и тиреоидные гормоны, лекарственные препараты [2]. Показано, что наиболее перспективными переносчиками являются липопротеины высокой плотности (ЛПВП) и их белковый компонент аполипопротеин А-I (апоА-I), образующий комплексы с биологически активными веществами [8; 11]. Многие клетки обладают рецепторами к апоА-I, поэтому апоА-I используют в качестве маркера при конструировании искусственных липосом для их распознавания такими клетками [9; 12]. В литературе появились работы, предполагающие, что одной транспортной ролью функции апоА-I не ограничиваются. Гимаутдиновой с сотрудниками методом малого углового рентгеновского рассеивания было показано, что апоА-I сам по себе и в комплексе с тетрагидрокортизолом (ТГК) связывается с эукариотической ДНК [1]. На коротких олигонуклеотидах было продемонстрировано, что наибольшее сродство комплекс апоА-I-ТГК имеет к олигонуклеотидам, в состав которых входит (GCC)n повторы (n=3-5). При этом в местах взаимодействия возникали однонитевые разрывы ДНК, в результате чего происходило увеличение копирования ДНК на 22-27% [10]. Основываясь на этих данных, мы предположили возможность использования апоА-I для трансфекции клеток млекопитающих плазмидными ДНК (пДНК). Поскольку почти все клетки животных, в том числе и опухолевые, имеют рецепторы к апоА-I [5; 6], комплекс апоА-I(n)-пДНК может быть поглощен этими клетками путем рецептор-обусловленного эндоцитоза. В связи с этим целью настоящего исследования явилось на моделях клеток различных линий (асцитной карциномы Эрлиха, лимфобластов U937 и клеток линии HEК 293Т) изучение возможности использования рекомбинантного и нативного аполипопротеина А-I для трансфекции плазмидными ДНК.
Материалы и методы
Выделение и очистку нативного апоА-I из плазмы крови человека проводили по методике, описанной в работе [11]. Рекомбинантный апоА-I получали из клеток продуцента, сконструированного ранее в нашей лаборатории. Клетки E.coli разрушали ультразвуком, белок из клеточного лизата выделяли с помощью аффинной хроматографии на сорбенте Ni-NTA Superflow (Qiagen, США) с последующим отщеплением лидерной последовательности, как описано в работе [3]. Качество белков анализировали в 12%-ном полиакриламидном геле в денатурирующих условиях по Леммли. Белки обессоливали общепринятым методом диализа против фосфатно-солевого буфера (ФСБ) рН 7,4-7,5 и стерилизовали фильтрованием через фильтр с размером пор 0,22 мкм Syringe-DivenFilters (JetBiofilm, Корея). Стерильные чистые белки хранили при 4 °С либо замораживали.
Спектрофотометрические измерения проводили в ЦКП «Спектрометрические измерения» на базе НИИ биохимии, г. Новосибирск. Измерение концентрации белков при λ=280 нм и концентрации ДНК при λ=260 нм проводили на спектрофотометре Evolution 300 (Thermo Scientific, США). Флуорометрические измерения конъюгата апоА-I-ФИТЦ выполняли на спектрофлуорофотометре RF-5301PC (Shimadzu, Япония).
Получение и очистка плазмидных ДНК. Плазмиды для трансфекции pTagGFP2-С (
5,45 т.п.н.). Плазмиды нарабатывали в клетках E.coli, штамм recA- «NovaXGF» (Novagen, США) в среде LB в присутствии канамицина 30 мкг/мл. Плазмиды выделяли из клеток набором PlasmidMidiprep («Евроген», Россия) согласно инструкции. Качество плазмид и анализ фрагментов ДНК (продуктов ПЦР) осуществляли методом электрофореза в 0,8-1,2%-ном агарозном геле с последующим окрашиванием ДНК бромистым этидием.
Получение конъюгата апоА-I-ФИТЦ. Конъюгат апоА-I-ФИТЦ получали путем инкубации белков с ФИТЦ в течение ночи в карбонатном буфере рН 9,5 в соотношении 12,5 мкг ФИТЦ на 1 мг белка. Конъюгат от непрореагировавшего ФИТЦ отделяли с помощью гель-фильтрации на Sephadex G 25 (1 мг белка на 10 мл смолы, высота колонки 10 см). Профиль элюции регистрировали на УФ-детекторе 2151 (LKB, Швеция) при длине волны 280 нм. Образование конъюгата в полученных хроматографических фракциях подтверждали анализом на спектрофлуорофотометре на наличие характерных для ФИТЦ пиков возбуждения (490 нм) и эмиссии (520 нм), а также в ПААГ.
Работы с культурами клеток. В качестве клеточной модели использовали опухолевые лимфобласты линии U937, клетки асцитной карциномы Эрлиха (АКЭ) и клетки линии HEК 293Т. Клеточная линия U937 была любезно предоставлена Чечушковым А.В. (НИИ экспериментальной и клинической медицины, г. Новосибирск). Клетки АКЭ были любезно предоставлены Калединым В.И. (ИЦиГ СО РАН, Новосибирск), в виде перитонеального экссудата мышей. Выделение и выращивание клеток из перитонеального экссудата мышей проводилось, как описано в работе [4]. Содержание, питание, уход за животными и выведение их из эксперимента осуществляли в соответствии с требованиями «Правил проведения работ с использованием экспериментальных животных» (приложение к Приказу МЗ СССР от 12.08.1977 № 755). Клетки линии HEK 293Т были любезно предоставлены Пыхтиной М.В. (НИИ биохимии, Новосибирск). Выращивание клеток линии U937 и HEK 293Т, а также инкубацию клеток с трансфицирующими веществами проводили в среде RPMI-1640 («Биолот», Россия), рН 7,4, содержащей 10%-ную эмбриональную сыворотку коров, 50 ед/мл пенициллина, 50 мкг/мл стрептомицина. Инкубацию проводили на 24-луночных планшетах (OrangeScientific, США) в СО2-инкубаторе (Cole-Parmer, США) в атмосфере, содержащей 5% СО2 и 95% воздуха, при температуре 37 °С. В случае инкубации клеток АКЭ, для лучшей адгезии клеток планшеты предварительно обрабатывали коллагеном (инкубировали планшеты с раствором коллагена 0,1 мг/мл в течение часа). Клетки снимали с планшетов 0,25%-ным раствором трипсина. Жизнеспособность клеток оценивали методом исключения трипанового синего (Serva, Германия), концентрацию клеток рассчитывали в камере Горяева. Музейные образцы клеток хранили в жидком азоте в среде RPMI-1640 с добавлением 40% эмбриональной сыворотки коров и 10% диметилсульфоксида.
Инкубацию клеток с комплексом апоА-I-ФИТЦ проводили после достижения конфлюентности культурой клеток в лунках на уровне 50-60%. Инкубацию клеток с трансфицирующими реагентами (комплексами пДНК-апоА-I и пДНК-Lipofectamine 2000) проводили после достижения конфлюентности культурой клеток в лунках 80-90% (
Для визуального анализа флюоресценции клеток использовали инвертированный флуоресцентный микроскоп Axiovert 40 CFL (Zeiss, Германия). На вторые сутки после трансфекции клетки визуально анализировались. Уровень трансфекции оценивался как отношение количества флуоресцирующих клеток к общему количеству клеток, наблюдаемых в микроскопическом поле (не менее 20 полей для каждого образца). Результаты статистически обрабатывались и были представлены в процентах как среднее значение и ошибки среднего значения. Статистическую значимость результатов оценивали с помощью программы StatPlus 2009 (StatSoft, USA).
Результаты исследования и их обсуждение
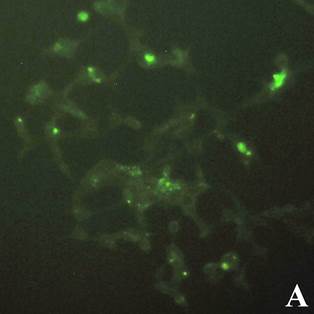
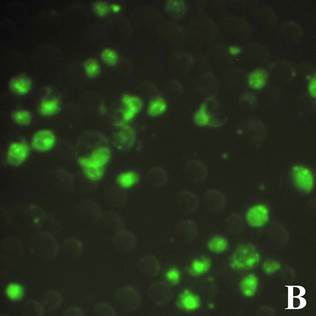
Рис. 1. Флуоресцентная микроскопия клеток линии HEK 239T (А) и U937 (В), инкубированных с конъюгатом апоА-ФИТЦ 50 мкг/мл в флуоресцентном режиме (ув. х 40)
Результаты инкубации клеток с конъюгатом показали, что наибольшее количество светящихся клеток обнаруживалось при максимальной исследуемой концентрации 50 мкг/мл и составляло примерно 1/3 часть от общего числа клеток. В контрольных клетках, инкубированных с апоА-I, подобного свечения не наблюдалось. Результаты также показывают, что количество светящихся клеток при использовании конъюгатов из нативного и рекомбинантного апоА-I было сходным и достоверных различий в образцах с исследуемыми концентрациями обнаружено не было. Это говорит о схожести биологических свойств полученного рекомбинантного апоА-I с нативным белком. Поэтому дальнейшие эксперименты проводились на рекомбинантном варианте белка.
На следующем этапе мы исследовали способность апоА-I трансфицировать клетки плазмидными ДНК. Для этого использовали плазмидные ДНК со встроенным геном зеленого флуоресцирующего белка gfp (pTagGFP2-С) и слитыми генами gfp-апоА-I (pTagGFP2-apoA). Исследовались различные соотношения пДНК и апоА-I по массе от 1:1 до 1:10. Количество пДНК составляло 0,5 мкг на
200000 клеток. В качестве отрицательного контроля клетки инкубировали с пДНК в отсутствии апоА-I. В качестве положительного контроля трансфекцию проводили с теми же препаратами пДНК с Lipofectamine 2000. На следующие сутки после 24 ч инкубации проводили микроскопический анализ клеток.
В результате экспериментов наблюдались флуоресцирующие клетки, экспрессирующие гены gfp и gfp-апоА-I только с препаратом Lipofectamine 2000. Уровень трансфекции являлся низким для клеток U937 и АКЭ и составлял не более 5-10%. Максимальный уровень флуоресцирующих клеток
70% был обнаружен в клетках линии HEK 293T. Низкий уровень трансфекции клеток U937 согласовался с литературными данными, где отмечается сложность данного типа клеток для трансфекции Lipofectamine-подобными препаратами [13].
Количество светящихся клеток, инкубированных с комплексами апоА-I-пДНК, не превышало 0,5%, и достоверного отличия с контрольными образцами обнаружено не было (инкубированных только с пДНК). Это говорит о том, что комплексы апоА-I-пДНК в исследованных соотношениях не проникали в клетки и/или ядра клеток. Вероятной причиной таких результатов могло быть недостаточно специфичное связывание апоА-I с пДНК для формирования стабильных комплексов или распад (диссоциация) комплексов апоА-I-пДНК в инкубационной среде.
Для проверки предположения о недостаточно специфическом связывании апоА-I с пДНК мы исследовали взаимодействие ДНК с апоА-I методом ретардации фрагментов ДНК в агарозном геле. В случае образования комплекса белок-ДНК, такие комплексы в электрическом поле задерживаются в геле (движутся медленнее) относительно свободных молекул ДНК. Данный метод используется для определения специфичности связывания различных белков с ДНК, например с гистоновыми белками [7].
В качестве ДНК использовалась плазмида, содержащая слитые гены gfp и апоА-I (pTagGFP2-apoA,
5,45 т.п.н.) и ампликон гена апоА-I (
750 п.н.). Ампликон гена апоА-I в препаративных количествах получали методом ПЦР. Исследовались два варианта апоА-I – нативный и рекомбинантный. При анализе соотношение ДНК/белок по массе варьировалось от 1:1 до 1:100, количество ДНК на дорожку составляло
Рис. 2. Электрофореграмма анализа ампликонов гена апоА-I, инкубированных с рекомбинантным белком апоА-I
По литературным данным, используемые для трансфекции гистоновые белки или их фрагменты вызывают задержку фрагментов ДНК в геле уже при массовом отношении ДНК:белок, равном 1:0,5 [7]. В наших экспериментах изменения в подвижности не были обнаружены даже при избыточном отношении белка. На основании этих результатов мы предполагаем отсутствие взаимодействия белка апоА-I как рекомбинантной, так и нативной формы с исследуемыми молекулами ДНК. Вероятно, этим и была обусловлена неспособность апоА-I трансфицировать клетки.
Выводы
На модели клеток опухолевых лимфобластов U937, АКЭ и клеток линии HEK 293T была показана способность рекомбинантного и нативного белка апоА-I, меченного ФИТЦ, проникать в клетки. На данных клеточных моделях установлено, что апоА-I неспособен трансфицировать плазмидными ДНК исследуемые клетки. На примере плазмидной ДНК и ампликона гена апоА-I методом ретардации фрагментов ДНК в геле агарозы показано отсутствие специфического взаимодействия молекул ДНК с белком апоА-I.
Эмбриональные клетки везде: что не так с современными клеточными технологиями
Используются ли в вакцинах, в том числе от коронавируса, абортивные материалы? Разбираемся, есть ли этичные способы защитить себя от ковида
Тема этичности вакцин и использования при их разработке клеток ранее абортированных детей всколыхнулась с новой силой. По всему миру христиане и представители пролайф-сообществ обсуждают, правильно ли прививаться с помощью таких препаратов в период пандемии.
Мы решили разобраться в ситуации детально, а заодно узнать, что мешает ученым полностью отказаться от эмбриональных клеточных линий в медицине.
«Растут с колоссальной скоростью»: что такое клеточные культуры и клеточные линии
В связи с разработкой вакцин звучат термины «клеточная культура» и «клеточная линия».
«Клеточная культура» – это клетки одной ткани (например, кожи или ткани почек) человека или животного, которую выращивают в лабораториях в контролируемых условиях. А «клеточная линия» – это источник культуры клеток. Как правило, линия имеет название в виде аббревиатуры букв латинского алфавита и цифр – по ним можно установить, когда и откуда были взяты клетки.
Линий (человеческих и животных) десятки, они имеют определенные международные обозначения и хранятся в специальных банках клеток. Такой банк есть и в России – это так называемая Всесоюзная коллекция клеточных культур, образцы которой рассредоточены по различным научным институтам.
Клеточных линий, полученных в результате абортов, или так называемых эмбриональных линий, в мире гораздо меньше.
В основном известны НЕК-293 (получена из почек эмбриона, абортированного в 1972 году), PER.C6 (получена в 1985 году из клеток сетчатки глаза 18-недельного эмбриона), WI-38 (получена в 1964 году из диплоидных клеток легочной соединительной ткани абортированной девочки, которой было около 12 недель), MRC-5 (получена в 1966 году из легочных клеток 14-недельного мальчика), RA27/3 (получена в США в 1964 году от плода, инфицированного краснухой) и ряд других.
При этом у каждой из этих линий своя «специализация» и свои уникальные свойства. Так, на линии RA27/3 до сих пор выращивают вакцину от краснухи, НЕК-293 печально известна благодаря тому, что компания Senomyx использовала ее для тестирования пищевых добавок.
Линия PER.C6 принадлежит компании Johnson & Johnson и ее исключительное свойство в том, что клетки линии растут с колоссальной скоростью: в одном миллилитре суспензии может содержаться до ста миллионов клеток. Есть и линии-«универсалы», например на MRC-5разрабатывается около 10 вакцин от различных заболеваний.
Использование клеток эмбриональных линий в пищевой промышленности имеет свою историю. В 1999 году американским биохимиком Либертом Стриером из Стенфордского университета была основана компания Senomyx. Своей целью она ставила исследования в области пищевых добавок, усиливающих вкус и запах пищи.
Уникальные вещества, которые разрабатывали химики в Senomyx, могли не только сделать исходный продукт слаще или солонее, но и, например, заблокировать горечь. Тестировали пищевые добавки на эмбриональной клеточной линии HEK293 – это было дешевле, чем давать образцы добровольцам или ставить сложные эксперименты на животных, не способных сообщить о своих ощущениях.
Альтернативой абортивным материалам могли бы служить специальные клеточные линии, культивируемые из клеток-рецепторов ротовой полости, но эта технология была сложнее, и в итоге было принято решение идти по простому и, главное, дешевому пути. При этом клетки линии HEK293 использовались только на этапе тестирования, в конечный продукт они не попадали. Всего на счету Senomyx 113 патентов, несколько сот различных вкусовых добавок, а также сотрудничество как минимум с семью крупнейшими мировыми компаниями, такими как Heinz, Nestle, Pepsi и другими.
В 2010 году, благодаря американской пролайф-организации «Божьи дети» информация о том, что вкусовые добавки, которые входят в состав кетчупов, чипсов, кубиков и супов быстрого приготовления, сливок, шоколада, газированных напитков, выпускаются по неэтичной технологии, стала широко известна. С полным списком продуктов можно ознакомиться здесь.
В результате большинство партнеров Senomyx открестились от сотрудничества с компанией, объявив о том, что обновляют свои продукты. Сайт Senomyx не обновлялся с 2012 года. Каким образом сегодня обстоят дела с тестированием вкусовых добавок в США и в мире, достоверно не известно.
Клетки растут в биореакторах объемом несколько тысяч литров
В медицине и фармакологии эмбриональные клеточные линии в настоящее время используются при создании вакцин (векторных или живых) от кори, краснухи, паротита, гепатита А, бешенства, ветряной оспы, коронавируса. Человеческие клеточные линии нужны для размножения вируса, который потом используют в прививке. Ведь вирусам, в отличие бактерий, нужен «хозяин», и этим «хозяином» становятся клетки клеточной линии.
Их также используют для создания лекарственных препаратов от ревматоидного артрита, гемофилии и муковисцидоза. Кроме того, линию НЕК-293 применяют в исследованиях, посвященных поиску раковых терапий. На ней же выращивают адено-ассоциированный вирус, который служит вектором для доставки генов в препарате «Золгенсма», который применяют при терапии спинально-мышечной атрофии.
Эмбриональные клетки действительно могут делиться практически бесконечно в условиях, созданных для этого в лабораториях. Сторонники этого метода в качестве аргумента, оправдывающего использование абортивного материала, говорят: клеточные культуры, которые используются сегодня, получились в результате длительного деления и уже фактически не являются частью организма некогда абортированного ребенка.
Получение клеточной линии выглядит следующим образом. Ткань или орган, из клеток которых предстоит в будущем развивать клеточную линию, забирают с соблюдением условий асептики, помещают в стерильный солевой раствор и транспортируют в специализированную лабораторию.
В лаборатории ткани и органы тщательно изучают, в том числе на предмет возможного инфицирования. Если установлено, что они «чистые», скальпелем или ножницами измельчают до кусочков размерами не более 1-3 мм, тщательно отмывают от клеток крови в нескольких сменах стерильных растворов, а затем помещают в растворы специальных ферментов, позволяющих изолировать отдельные клетки.
Собственно, эти самые клетки, которые удается выделить с помощью измельчения (иногда для этого даже может понадобиться своеобразное «сито», через которое фильтруют полученный из тканей или органов раствор) – это и есть первичная клеточная культура. Ее можно начинать «растить» с помощью питательной среды и ряда специальных технологий.
Большинство клеточных культур растут в так называемом монослое – то есть на дне пластикового или стеклянного контейнера, располагаясь слоем толщиной в одну клетку. Чтобы они размножались быстрее и эффективнее, были придуманы специальные многоэтажные контейнеры. (Вот так например это выглядит. )
Некоторым типам клеток требуется постоянное перемешивание – для них были изобретены «шейкеры», которые встряхивают сосуды с клетками. Например, в Италии для создания вакцин в заводских условиях используют одновременно 28 тысяч особых роллерных флаконов. Автоматика при этом контролирует температуру и скорость вращения. А когда на заводе заменили гладкие стеклянные флаконы на гофрированные из пластика, увеличив площадь поверхности, получили двадцатикратный прирост клеток, а удвоение клеточной популяции происходит всего за 8 с небольшим часов.
Но лучше всего работает технология, при которой клетки размножаются в виде суспензии в специальном биореакторе. Такие реакторы объемом до 8 тысяч литров работают в странах Европы и в США.
При этом, собственно клетки эмбриональной линии в конечный продукт (прививку) попадать не должны.
Когда вирус размножится в достаточном количестве, его разными средствами отделяют от клеточной культуры, очищают от примесей. Для этого могут использовать разные методы – электрофорез, различные химические вещества, окрашивание и даже многоуровневая фильтрация. Полученный же чистый вирус или его фрагменты добавляют в вакцину вместе с другими веществами, которые обеспечат ее консервацию, стабильность и в дальнейшем – необходимое воздействие на организм.
Если не используют для производства, то используют для тестирования
При производстве некоторых вакцин, впрочем, используются клетки животных – обезьян, кроликов, хомяков, а также куриные эмбрионы, заключенные в яйце. Но все же вирусологи считают, что культуры человеческих клеток являются наиболее совершенной из лабораторных систем для культивирования вирусов, а потом – тестирования их эффективности. Использование клеток человека, в отличие от материала, взятого у животных, дает большую безопасность прививки, так как гарантирует отсутствие реакции иммунной системы на материал другого биологического вида. Технология дешева, поэтому и используется почти повсеместно.
В случае с новейшими вакцинами от коронавируса уже известно, что эмбриональные клеточные линии использовались при разработке как минимум, РНК-вакцины компаний Pfizer и Moderna на стадии лабораторного тестирования. Связь с клеточными линиями, появившимися в результате абортов есть у российской вакцины «Спутник-V» института им. Гамалеи и препаратов компаний компании NOVAVAXAB и INOVIO, которые находятся в стадии клинических испытаний. Такие данные в конце 2020 года опубликовал американский Институт Шарлотты Лозьер – организация, которая стоит на пролайф-позициях, собирает и обнародует информацию относительно абортов и использования абортивного материала в медицинских, научных и иных целях.
Вакцина от коронавируса компании AstraZeneca в качестве вектора использует не человеческий аденовирус, а аденовирус шимпанзе. Однако согласно данным, опубликованным в журнале Nature, при разработке вакцины применялась клеточная линия HEK293.
Любопытно, что вакцинолог из Оклендского университета, председатель Глобального консультативного комитета ВОЗ по безопасности вакцин Хелен Петусис-Харрис, опровергая наличие абортивного материала в конечном продукте, признает, что для создания вакцин на том или ином этапе почти невозможно обойтись без эмбриональных клеточных линий, если не для производства, то, как минимум, для тестирования.
«При изучении вирусов и иммунных реакций в лаборатории неизбежно используются эти клеточные линии для обеспечения надежных результатов, актуальных для людей», – говорит Петусис-Харрис.
Поскольку пока в России из этого списка доступен лишь «Спутник-V», стоит рассказать о нем чуть подробнее. Это векторная вакцина, созданная на ранее разработанной и опробованной в НИЦ им. Гамалеи аденовирусной платформе. Это означает, что в основе вакцины находится вектор, генно-модифицированный вирус, в который встраиваются гены белков внешней оболочки вируса SARS-CoV-2. Вектор доставляет фрагмент генома коронавируса в клетку, вызывая иммунный ответ.
В российской вакцине в качестве вектора используются аденовирусы. Именно аденовирусы и необходимо выращивать на клеточной эмбриональной линии HEK293, поэтому вакцину «Спутник-V» с этой точки зрения можно считать препаратом с этически спорной составляющей.
Вакцина российской компании «Вектор», «ЭпиВакКорона», состоит из искусственно синтезированных коротких фрагментов вирусных белков — пептидов, распознаваемых иммунной системой. Она, по-видимому, не предусматривает работу с клеточными линиями, по крайней мере для производства. (Патент пока не опубликован, так что точных данных нет.) Относительно третьей российской вакцины, над которой пока еще работают в Центре им. Чумакова, данных пока что нет.
Неэтичные клеточные линии можно заменить, но мало кто заинтересован в этом
Сторонники использования эмбриональных клеточных линий в медицине и фармакологии уверяют: полученных десятки лет назад клеточных линий достаточно, чтобы обеспечить потребности всей индустрии, и ситуации, при которых понадобились бы новые аборты в исследовательских или, тем более, коммерческих целях, невозможны.
Сторонники применения клеточных эмбриональных линий часто ссылаются на то, что исследования, которые происходят с участием этих клеток, не требуют новых абортов. Однако абортивный материал так или иначе продолжают использовать в научных целях. Известно, что такие работы идут в Великобритании, Индии, Китае, Сингапуре. В России флагманом в этого рода деятельности считается профессор Геннадий Сухих, который возглавляет ФГБУ «НМИЦ АГП им. В.И. Кулакова» и считается автором методики так называемой «фетальной терапии», в ходе которой применяются абортивные ткани.
Попытку ограничить использование тканей, полученных в результате плановых абортов, в научных целях, предпринял президент США Дональд Трамп в 2019 году. Тогда его администрация фактически заблокировала для ученых из Национального института здоровья возможность получать какие-либо ткани плода для дальнейших исследований. Было также существенно сокращено финансирование такого рода исследований.
Кроме того, в США появился так называемый Консультативный совет по этике исследований тканей плода человека, который за минувшие два года выдал разрешение лишь на те исследования, которые предполагали поиски альтернативных методов, чтобы в будущем полностью отойти от практики использования абортивных отходов.
Накануне инаугурации Джо Байдена к нему обратились представители американского научного сообщества с просьбой отменить мораторий, установленный его предшественником. В своем письме ученые ссылаются в том числе и на тот факт, что это якобы ускорит исследования по поиску лекарства от ковида.
Частично ответ на вопрос о том, почему мировая фарма не переходит на этичные вакцины без использования эмбриональных клеток, дала представитель компании Merck Деб Уомболд. Она объяснила, что в случае с вакциной от кори, краснухи и паротита переключение с линии WI-38 на другую клеточную линию (например, животную) представляет собой серьезный вызов, как с точки зрения эффективности, так и с точки зрения качества вакцины.
«Поскольку процесс разработки вакцины очень сильно зависит от конкретной клеточной линии, на которой он происходит, невозможно просто заменить одну линию другой. И даже если бы это удалось, нет никаких гарантий того, что уровень безопасности и эффективности был бы сравним с уже лицензированными вакцинами», – говорит миссис Уомболд.
Попытки найти альтернативу пока находятся скорее в теоретической области.
Так, доктор наук Кайл Кристофер МакКенна, научный сотрудник Францисканского университета Стьюбенвилла (США), стоящий на католических позициях, считает, что в отличие от использования линии эмбриональных клеток, полученных в результате аборта, можно было бы создать клеточные линии на основе эмбриональных клеток, полученных в результате выкидыша.
Дэвид Прентис, вице-президент института Шарлотты Лозьер, предлагает создавать клеточные линии на основе клеток, полученных в результате амниоцентеза, процедуры забора амниотической жидкости у беременной женщины.
Но здесь снова вступает в игру главный аргумент: существующие эмбриональные клеточные линии – это дешево, в то время как новые технологии потребуют времени на их разработку, изучение и внедрение. К этому готовы далеко не все.
Нужно добиваться разработки этичных технологий
Вопрос этичности вакцин и их связи с абортивными материалами не раз поднимался представителями разных конфессий.
В декабре 2020-го Ватикан заявил, что «в отсутствии альтернативы использование вакцин, произведенных с применением клеточных линий от абортированных эмбрионов, нравственно допустимо, и следует иметь в виду, что отказ от вакцинации по причине неприятия подобных вакцин «может увеличить риски для общественного здоровья».
Официальной позиции Русской Православной Церкви по поводу использования вакцин от коронавируса, которые так или иначе связаны с эмбриональными клеточными линиями, пока нет. Известно, что соответствующие запросы были направлены всем разработчикам российских вакцин, и представители института им. Гамалеи подтвердили, что использовали клеточную линию HEK293 для культивации аденовируса, но при этом подчеркнули, что в конечном продукте абортивных клеток нет, а создатели «ЭпиВакКороны» поспешили заверить, что их вакцина максимально этична.
С другой стороны, в 2009 году, когда разгорелись аналогичные споры по поводу вакцинации от кори, российское Общество православных врачей выступило с заявлением, где признается возможным временное использование вакцин, при разработке которых используется абортивный материал, но говорится следующее: «Вместе с тем мы считаем необходимым решительно высказаться в пользу применения альтернативных (этических) вакцин при их наличии. Необходимо также добиваться от Правительства России, Министерства здравоохранения и социального развития, а также фармацевтической промышленности создания отечественных альтернативных (этических) вакцин или приобретения в странах, их производящих».
Этичные вакцины будущего связаны с растениями?
Из всего вышесказанного можно заключить, что ключевым пунктом в проблеме использования абортивных материалов при создании вакцин является именно запрос на этичные продукты. Похоже, что пока он не будет в достаточной мере сформулирован и озвучен различными организациями, группами и отдельными лидерами мнений, дело не сдвинется с мертвой точки.
И все же, надежда есть, такие работы постепенно появляются. Пример тому – так называемая «растительная» вакцина, над которой трудятся ученые биофака МГУ.
В качестве адъюванта – вещества, которое способствует доставке и правильной экспрессии некоторых антигенов при вакцинации – в ней используется вирус табачной мозаики. Табак заражают вирусом, затем выделяют его из растений, подвергают термической обработке, и он из палочкового становится сферическим. К этой сферической частице добавляют фрагменты белка возбудителя COVID-19, которые за счет свойств растительного вируса отлично к ней прикрепляются, так что не нужно использовать для этого никакие дополнительные химические агенты.
Профессор Алексей Аграновский, руководитель сектора кафедры вирусологии биофака МГУ, заверил «Милосердие.ru», что на стадии дизайна вакцины клеточные эмбриональные линии, равно как и клетки животных, не используются. В дальнейшем, на стадии тестирования будут эксперименты на лабораторных животных, но в целом можно говорить, что эта вакцина станет этически приемлемой.
К слову, по аналогичной технологии в МГУ уже разрабатывали вакцину от краснухи, и в тестах на животных она показала себя безопасной. Есть и ряд других вакцин-кандидатов, над которыми идет работа.
«Эти исследования имеют фундаментальное значение для теоретической науки, потому что чем больше мы знаем, тем больше мы вооружены. Мало ли какие в будущем будут эпидемии – надо иметь возможность использовать разные платформы», – говорит ученый.
«Иметь еще одну вакцину, даже когда уже есть несколько вариантов, это хорошо, – объясняет Алексей Аграновский. – И не только потому, что у людей должен быть выбор. Например, «Спутником-V» можно провакцинироваться один раз, а если возникнет потребность в ревакцинации, есть риск, что она будет неэффективной».
Мы просим подписаться на небольшой, но регулярный платеж в пользу нашего сайта. Милосердие.ru работает благодаря добровольным пожертвованиям наших читателей. На командировки, съемки, зарплаты редакторов, журналистов и техническую поддержку сайта нужны средства.