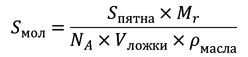клеточная мембрана что это
Клеточная мембрана
Кле́точная мембра́на (или цитолемма, или плазмалемма, или плазматическая мембрана) отделяет содержимое любой клетки от внешней среды, обеспечивая её целостность; регулируют обмен между клеткой и средой; внутриклеточные мембраны разделяют клетку на специализированные замкнутые отсеки — компартменты или органеллы, в которых поддерживаются определённые условия среды.
Содержание
Основные сведения
Клеточная стенка, если таковая у клетки имеется (обычно есть у растительных клеток), покрывает клеточную мембрану.
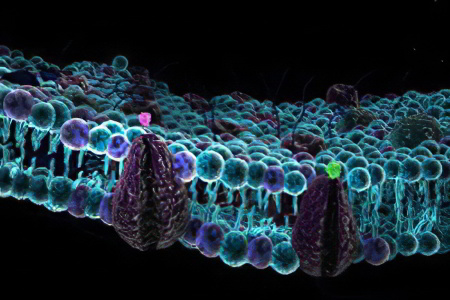
Клеточная мембрана представляет собой двойной слой (бислой) молекул класса липидов, большинство из которых представляет собой так называемые сложные липиды — фосфолипиды. Молекулы липидов имеют гидрофильную («головка») и гидрофобную («хвост») часть. При образовании мембран гидрофобные участки молекул оказываются обращены внутрь, а гидрофильные — наружу. Мембраны — структуры инвариабельные, весьма сходные у разных организмов. Некоторое исключение составляют, пожалуй, археи, у которых мембраны образованы глицерином и терпеноидными спиртами. Толщина мембраны составляет 7—8 нм.
Биологическая мембрана включает и различные белки: интегральные (пронизывающие мембрану насквозь), полуинтегральные (погруженные одним концом во внешний или внутренний липидный слой), поверхностные (расположенные на внешней или прилегающие к внутренней сторонам мембраны). Некоторые белки являются точками контакта клеточной мембраны с цитоскелетом внутри клетки, и клеточной стенкой (если она есть) снаружи. Некоторые из интегральных белков выполняют функцию ионных каналов, различных транспортеров и рецепторов.
Функции
Структура и состав биомембран
Мембраны состоят из липидов трёх классов: фосфолипиды, гликолипиды и холестерол. Фосфолипиды и гликолипиды (липиды с присоединёнными к ним углеводами) состоят из двух длинных гидрофобных углеводородных «хвостов», которые связаны с заряженной гидрофильной «головой». Холестерол придаёт мембране жёсткость, занимая свободное пространство между гидрофобными хвостами липидов и не позволяя им изгибаться. Поэтому мембраны с малым содержанием холестерола более гибкие, а с большим — более жёсткие и хрупкие. Также холестерол служит «стопором», препятствующим перемещению полярных молекул из клетки и в клетку. Важную часть мембраны составляют белки, пронизывающие её и отвечающие за разнообразные свойства мембран. Их состав и ориентация в разных мембранах различаются.
Клеточные мембраны часто асимметричны, то есть слои отличаются по составу липидов, переход отдельной молекулы из одного слоя в другой (так называемый флип-флоп) затруднён.
Мембранные органеллы
Это замкнутые одиночные или связанные друг с другом участки цитоплазмы, отделённые от гиалоплазмы мембранами. К одномембранным органеллам относятся эндоплазматическая сеть, аппарат Гольджи, лизосомы, вакуоли, пероксисомы; к двумембранным — ядро, митохондрии, пластиды. Строение мембран различных органелл отличается по составу липидов и мембранных белков.
Избирательная проницаемость
Клеточные мембраны обладают избирательной проницаемостью: через них медленно диффундируют глюкоза, аминокислоты, жирные кислоты, глицерол и ионы, причем сами мембраны в известной мере активно регулируют этот процесс — одни вещества пропускают, а другие нет. Существует четыре основных механизма для поступления веществ в клетку или вывода их из клетки наружу: диффузия, осмос, активный транспорт и экзо- или эндоцитоз. Два первых процесса носят пассивный характер, то есть не требуют затрат энергии; два последних — активные процессы, связанные с потреблением энергии.
Избирательная проницаемость мембраны при пассивном транспорте обусловлена специальными каналами — интегральными белками. Они пронизывают мембрану насквозь, образовывая своего рода проход. Для элементов K, Na и Cl есть свои каналы. Относительно градиента концентрации молекулы этих элементов движутся в клетку и из неё. При раздражении каналы натриевых ионов раскрываются, и происходит резкое поступление в клетку ионов натрия. При этом происходит дисбаланс мембранного потенциала. После чего мембранный потенциал восстанавливается. Каналы калия всегда открыты, через них в клетку медленно попадают ионы калия.
Клеточная мембрана
Все живые организмы на Земле состоят из клеток, а каждая клетка окружена защитной оболочкой – мембраной. Однако функции мембраны не ограничиваются защитой органоидов и отделением одной клетки от другой. Клеточная мембрана представляет собой сложнейший механизм, напрямую участвующий в размножении, регенерации, питании, дыхании и многих других важных функциях клетки.
Термин «клеточная мембрана» используется уже около ста лет. Само слово «мембрана» в переводе с латыни означает «пленка». Но в случае в клеточной мембраной правильнее будет говорить и совокупности двух пленок, соединенных между собой определенным образом, причем, разные стороны этих пленок обладают разными свойствами.
Клеточная мембрана (цитолемма, плазмалемма) – это трехслойная липопротеиновая (жиро-белковая) оболочка, отделяющая каждую клетку от соседних клеток и окружающей среды, и осуществляющая управляемый обмен между клетками и окружающей средой.
Решающее значение в этом определении имеет не то, что клеточная оболочка отделяет одну клетку от другой, а то, что она обеспечивает её взаимодействие другими клетками и окружающей средой. Мембрана – весьма активная, постоянно работающая структура клетки, на которую природой возложено множество функций. Из нашей статьи вы узнаете все о составе, строении, свойствах и функциях клеточной мембраны, а также о той опасности, которую представляют для здоровья человека нарушения в работе клеточных мембран.
История исследования клеточной мембраны
В 1925 году двое немецких ученых, Гортер и Грендель, смогли провести сложнейший эксперимент над красными кровяными тельцами человеческой крови, эритроцитами. С помощью осмотического удара исследователи получили так называемые «тени»– пустые оболочки эритроцитов, затем сложили их в одну стопку и измерили площадь поверхности. Следующим шагом стало вычисление количества липидов в клеточной мембране. С помощью ацетона ученые выделили липиды из «теней» и определили, что их как раз хватает на двойной сплошной слой.
Однако в ходе эксперимента было допущено две грубейших ошибки:
Использование ацетона не позволяет выделить из мембран абсолютно все липиды;
Площадь поверхности «теней» была высчитана по сухому весу, что тоже неправильно.
Поскольку первая ошибка давала минус в расчетах, а вторая – плюс, общий результат оказался на удивление точным, и немецкие ученые принесли в научный мир важнейшее открытие – липидный бислой клеточной мембраны.
В 1935 году другая пара исследователей, Даниэлли и Доусон, после долгих экспериментов над билипидными пленками пришли к выводу о присутствии в клеточных мембранах белков. Иначе никак нельзя было объяснить, почему эти пленки обладают таким высоким показателем поверхностного натяжения. Ученые представили вниманию общественности схематическую модель клеточной мембраны, похожую на сэндвич, где роль кусочков хлеба играют однородные липидно-белковые слои, а между ними вместо масла – пустота.
В 1950 году с помощью первого электронного микроскопа теорию Даниэлли-Доусона удалось частично подтвердить – на микрофотографиях клеточной мембраны были отчетливо видны два слоя, состоящих из липидных и белковых головок, а между ними прозрачное пространство, заполненное лишь хвостиками липидов и белков.
В 1972 году микробиологи С.Д. Сингер и Г.Л. Николсон смогли объяснить все нестыковки теории Робертсона с помощью новой, жидкостно-мозаичной модели клеточной мембраны. Ученые установили, что мембрана неоднородна, ассиметрична, наполнена жидкостью, и её клетки пребывают в постоянном движении. А белки, входящие в её состав, имеют разное строение и назначение, кроме того, они по-разному располагаются относительно билипидного слоя мембраны.
В составе клеточных мембран присутствуют белки трех видов:
Периферические – крепятся на поверхности пленки;
Полуинтегральные – частично проникают внутрь билипидного слоя;
Интегральные – полностью пронизывают мембрану.
Периферические белки связаны с головками мембранных липидов посредством электростатического взаимодействия, и они никогда не образуют сплошной слой, как принято было считать ранее.А полуинтегральные и интегральные белки служат для транспортировки внутрь клетки кислорода и питательных веществ, а также для вывода из нее продуктов распада и ещё для нескольких важных функций, о которых вы узнаете далее.
Свойства и функции клеточной мембраны
Клеточная мембрана выполняет следующие функции:
Барьерную – проницаемость мембраны для разных типов молекул неодинакова.Чтобы миновать оболочку клетки, молекула должна иметь определенный размер, химические свойства и электрический заряд. Вредные или неподходящие молекулы, благодаря барьерной функции клеточной мембраны, просто не могут проникнуть внутрь клетки. Например, с помощью реакции пероксиса мембрана защищает цитоплазму от опасных для нее пероксидов;
Транспортную – сквозь мембрану проходит пассивный, активный, регулируемый и избирательный обмен. Пассивный обмен подходит для жирорастворимых веществ и газов, состоящих из очень маленьких молекул. Такие вещества проникают внутрь и выходят из клетки без затрат энергии, свободно, методом диффузии. Активная транспортная функция клеточной мембраны задействуется тогда, когда в клетку или из нее нужно провести необходимые, но трудно транспортируемые вещества. Например, обладающие большим размером молекул, или неспособные пересечь билипидный слой из-за гидрофобности. Тогда начинают работать белки-насосы, в том числе АТФаза, которая отвечает за всасывание в клетку ионов калия и выбрасывание из нее ионов натрия. Регулируемый транспортный обмен необходим для осуществления функций секреции и ферментации, например, когда клетки производят и выделяют гормоны или желудочный сок. Все эти вещества выходят из клеток через специальные каналы и в заданном объеме. А избирательная транспортная функция связана с теми самыми интегральными белками, которые пронизывают мембрану и служат каналом для входа и выхода строго определенных типов молекул;
Матричную – клеточная мембрана определяет и фиксирует расположение органоидов относительно друг друга (ядра, митохондрий, хлоропластов) и регулирует взаимодействие между ними;
Механическую – обеспечивает ограничение одной клетки от другой, и, в то же время,— правильное соединение клеток в однородную ткань и устойчивость органов к деформации;
Защитную – как у растений, так и у животных, клеточная мембрана служит основой для построения защитного каркаса. Примером могут служить твердая древесина, плотная кожура, колючие шипы. В животном мире тоже много примеров защитной функции клеточных мембран – черепаший панцирь, хитиновая оболочка, копыта и рога;
Энергетическую — процессы фотосинтеза и клеточного дыхания были бы невозможны без участия белков клеточной мембраны, ведь именно с помощью белковых каналов клетки обмениваются энергией;
Рецепторную — белки, встроенные в клеточную мембрану, могут обладать ещё одной важной функцией. Они служат рецепторами, благодаря которым клетка получает сигнал от гормонов и нейромедиаторов. А это, в свою очередь, необходимо для проведения нервных импульсов и нормального течения гормональных процессов;
Ферментативную — ещё одна важная функция, присущая некоторым белкам клеточных мембран. Например, в эпителии кишечника с помощью таких белков синтезируются пищеварительные ферменты;
Биопотенциальную – концентрация ионов калия внутри клетки значительно выше, чем снаружи, а концентрация ионов натрия, наоборот, снаружи больше, чем внутри. Этим и объясняется разность потенциалов: внутри клетки заряд отрицательный, в снаружи положительный, что способствует движению веществ внутрь клетки и наружу при любом из трех типов обмена – фагоцитозе, пиноцитозе и экзоцитозе;
Клеточный обмен происходит через мембраны, и может осуществляться с помощью трех основных типов реакций:
Фагоцитоз – клеточный процесс, при котором встроенные в мембрану клетки-фагоциты захватывают и переваривают твердые частички питательных веществ. В человеческом организме фагоцитоз осуществляется мембранами двух типов клеток: гранулоцитов (зернистых лейкоцитов) и макрофагов (иммунных клеток-убийц);
Экзоцитоз – обратный процесс, при котором внутри клетки образуются пузырьки с секреторной функциональной жидкостью (ферментом, гормоном), и её необходимо как-то вывести из клетки в окружающую среду. Для этого пузырек сначала сливается с внутренней поверхностью клеточной мембраны, затем выпячивается наружу, лопается, исторгает содержимое и снова сливается с поверхностью мембраны, на этот раз уже с внешней стороны. Экзоцитоз проходит, например, в клетках кишечного эпителия и коры надпочечников.
Строение клеточной мембраны
Клеточные мембраны содержат липиды трех классов:
Фосфолипиды (комбинация жиров и фосфора) и гликолипиды (комбинация жиров и углеводов), в свою очередь, состоят из гидрофильной головки, от которой отходят два длинных гидрофобных хвостика. А вот холестерол иногда занимает пространство между этими двумя хвостиками и не даёт им изгибаться, что делает мембраны некоторых клеток жесткими. Кроме того, молекулы холестерола упорядочивают структуру клеточных мембран и препятствуют переходу полярных молекул из одной клетки в другую.
Но самой важной составляющей, как видно из предыдущего раздела о функциях клеточных мембран, являются белки. Их состав, назначение и расположение весьма разнообразны, но есть нечто общее, что всех их объединяет: вокруг белков клеточных мембран всегда расположены аннулярные липиды. Это особые жиры, которые четко структурированы, устойчивы, имеют в своем составе больше насыщенных жирных кислот, и выделяются из мембран вместе с «подшефными» белками. Это своего рода персональная защитная оболочка для белков, без которой они бы просто не работали.
Структура клеточной мембраны трехслойна. Посередине пролегает относительно однородный жидкий билипидный слой, а белки покрывают его с обеих сторон подобием мозаики, частично проникая в толщу. То есть, неправильно было бы думать, что внешние белковые слои клеточных мембран непрерывны. Белки, помимо своих сложных функций, нужны в мембране для того, чтобы пропускать внутрь клеток и транспортировать из них наружу те вещества, которые не способны проникнуть сквозь жировой слой. К примеру, ионы калия и натрия. Для них предусмотрены специальные белковые структуры – ионные каналы, подробнее о которых мы расскажем далее.
Если взглянуть на клеточную мембрану через микроскоп, то можно увидеть слой липидов, образованный мельчайшими шарообразными молекулами, по которому, как по морю, плавают большие белковые клетки разной формы. Точно такие же мембраны делят внутреннее пространство каждой клетки на отсеки, в которых уютно располагаются ядро, хлоропласты и митохондрии. Не будь внутри клетки отдельных «комнат», органоиды бы слиплись друг с другом и не смогли бы выполнять свои функции правильно.
Клетка – это структурированная и отграниченная с помощью мембран совокупность органоидов, которая участвует в комплексе энергетических, метаболических, информационных и репродуктивных процессов, обеспечивающих жизнедеятельность организма.
Как видно из этого определения, мембрана является важнейшей функциональной составляющей любой клетки. Её значение так же велико, как значение ядра, митохондрий и прочих клеточных органелл. А уникальные свойства мембраны обусловлены её строением: она состоит из двух плёночек, слепленных друг с другом особым образом. Молекулы фосфолипидов в мембране расположены гидрофильными головками наружу, а гидрофобными хвостами внутрь. Поэтому одна сторона плёночки смачивается водой, а другая – нет. Так вот, эти плёночки соединяются друг с другом несмачиваемыми сторонами внутрь, образуя билипидный слой, окруженный молекулами белков. Это и есть то самое «бутербродное» строение клеточной мембраны.
Ионные каналы клеточных мембран
Рассмотрим более подробно принцип работы ионных каналов. Для чего они нужны? Дело в том, что сквозь липидную мембрану беспрепятственно могут проникать только жирорастворимые вещества – это газы, спирты и сами жиры. Так, например, в красных кровяных тельцах постоянно происходит обмен кислорода и углекислого газа, и для этого нашему организму не приходится прибегать ни к каким дополнительным ухищрениям. Но как же быть, когда возникает необходимость в транспортировке сквозь клеточную мембрану водных растворов, таких, как соли натрия и калия?
Проложить в билипидном слое путь для таких веществ было бы невозможно, поскольку отверстия бы тут же затянулись и слиплись обратно, такова уж структура любой жировой ткани. Но природа, как всегда, нашла выход из ситуации, и создала специальные белковые транспортные структуры.
Существует два типа проводящих белков:
Транспортеры – полуинтегральные белки-насосы;
Каналоформеры – интегральные белки.
Белки первого типа частично погружены в билипидный слой клеточной мембраны, а головкой выглядывают наружу, и в присутствии нужного вещества они начинают вести себя, как насос: притягивают молекулу и всасывают её внутрь клетки. А белки второго типа, интегральные, имеют вытянутую форму и располагаются перпендикулярно билипидному слою клеточной мембраны, пронизывая её насквозь. По ним, как по тоннелям, в клетку и из клетки движутся вещества, неспособные проходить сквозь жир. Именно через ионные каналы внутрь клетки проникают ионы калия и накапливаются в ней, а ионы натрия, наоборот, выводятся наружу. Возникает разность электрических потенциалов, так необходимая для правильной работы всех клеток нашего организма.
Важнейшие выводы о строении и функциях клеточных мембран
Теория всегда выглядит интересной и перспективной, если её можно с пользой применить на практике. Открытие строения и функций клеточных мембран человеческого организма позволило ученымсовершить настоящий прорыв в науке в целом, и в медицине в частности. Мы не случайно так подробно остановились на ионных каналах, ведь именно здесь кроется ответ на один из важнейших вопросов современности: почему люди все чаще заболевают онкологией?
Рак ежегодно уносит около 17 миллионов жизней во всем мире, и является четвертой по частоте причиной всех смертей. По данным ВОЗ, заболеваемость онкологией неуклонно увеличивается, и к концу 2020 года может достигнуть 25 миллионов в год.
Чем объясняется настоящая эпидемия рака, и причем тут функции клеточных мембран? Вы скажете: причина в плохой экологической обстановке, неправильном питании, вредных привычках и тяжелой наследственности. И, конечно, будете правы, но если говорить о проблеме более предметно, то причина в закисленности человеческого организма. Перечисленные выше негативные факторы приводят к нарушению работы клеточных мембран, угнетают дыхание и питание.
Там, где должен быть плюс, образуется минус, и клетка не может нормально функционировать. А вот раковым клеткам не нужны ни кислород, ни щелочная среда – они способны использовать анаэробный тип питания. Поэтому в условиях кислородного голодания и зашкаливающего уровня pH здоровые клетки мутируют, желая приспособиться к окружающей среде, и становятся раковыми клетками. Так человек и заболевает онкологией. Чтобы этого избежать, нужно всего лишь употреблять достаточное количество чистой воды ежедневно, и отказаться от канцерогенов в пище. Но, как правило, люди прекрасно знают о вредных продуктах и потребности в качественной воде, и ничего не предпринимают – надеются, что беда обойдет их стороной.
Зная особенности строения и функций клеточных мембран разных клеток, врачи могут использовать эти сведения для оказания направленного, адресноготерапевтического воздействия на организм. Многие современные лекарственные препараты, попадая в наше тело, ищут нужную «мишень», в качестве которой могут выступать ионные каналы, ферменты, рецепторы и биомаркеры клеточных мембран. Такой способ лечения позволяет добиться более высоких результатов при минимальных побочных эффектах.
Антибиотики последнего поколения при попадании в кровь не убивают все клетки подряд, а ищут именно клетки возбудителя, ориентируясь на маркеры в его клеточных оболочках. Новейшие препараты против мигрени, триптаны, сужают только воспаленные сосуды головного мозга, при этом почти никак не влияя на сердце и периферическую кровеносную систему. И узнают они нужные сосуды именно по белкам их клеточных мембран. Таких примеров множество, поэтому можно с уверенностью сказать, что знания о строении и функциях клеточных оболочек лежит в основе развития современной медицинской науки, и спасает миллионы жизней каждый год.
Липидный фундамент жизни
Возникшая в 1970-е годы концепция жидкостно-мозаичной модели биологической мембраны, где липидам отводится пассивная роль «океана», в котором «айсберги» белковых комплексов разыгрывают предназначенные им биологические роли, немного устарела. Согласно современным представлениям, тщательно подобранный эволюцией липидный состав мембран играет роль не менее важную, а, возможно, даже более фундаментальную.
картинка в мраморе: Singer & Nicholson, 1972 [3]
Авторы
Редакторы
Жизнь в том виде, в каком мы ее знаем, невозможно представить без биомембраны, разделяющей «внутренний мир» клетки и всё остальное пространство. Мембрана обеспечивает взаимодействие клетки с внешней средой, избирательно пропуская многие вещества, а также является средой протекания множества биохимических процессов. И хотя большую часть полезной работы выполняют белки, которыми мембрана буквально «нашпигована», роль липидного матрикса не стоит недооценивать. Липиды — это не просто «океан», в котором плавают белки. Это «умный» океан, чьи физико-химические свойства были тщательно подобраны в ходе эволюции так, чтобы создать эффективную платформу для функционирования и взаимодействия мембранных белков.
Вопрос зарождения жизни на Земле вряд ли когда-нибудь получит окончательный ответ, но мало кто сомневается в том, что само ее появление стало возможным лишь в тот момент, когда в «первичном бульоне» (так в биологии принято называть растворенные в доисторическом мировом океане простые органические вещества) стали появляться маленькие изолированные области пространства, ставшие основной ареной для эволюции. В этих «первичных клетках» биохимические процессы могли протекать существенно быстрее, нежели на безбрежных просторах океана, и такое разделение является одной из предпосылок для первых, добиологических, шагов эволюции. Один из теоретиков абиотического происхождения жизни на Земле — академик А.И. Опарин — представлял себе эти «первичные клетки» в виде коацерватов (свободно плавающих липидных пузырьков, внутри которых протекала химическая эволюция). Согласно некоторым современным воззрениям, жизнь могла зародиться в гидротермальных источниках, где «первичная клетка» была образована минеральными отложениями [1]. Так или иначе, именно компартментализация (этим сложным словом обозначают обособленность содержимого клетки от внешней среды, а также подразделение самих клеток на внутренние «отсеки») является одним из непреложных признаков жизни.
Краткая история исследования липидов и биомембран
Структурообразующую функцию биологических мембран выполняют липиды — амфифильные молекулы, имеющие полярную головку и неполярный (гидрофобный) хвост. Они малорастворимы в воде и склонны к образованию моно- и бимолекулярных слоев благодаря своей амфифильной природе. Еще из школьного курса биологии известно, что мембрана состоит из двойного слоя (бислоя) липидов, «прячущих» от воды внутрь гидрофобные и выставляющих на поверхность полярные (гидрофильные) части [2].
где Mr — масcа 1 моля триолеина, NA — число Аводгадро, Sпятна — площадь пятна, Vложки — объем ложки, ρмасла — плотность масла. В результате мы получим значение площади Sмол ≈ 1 нм 2 (на молекулу). Несложно оценить и толщину мономолекулярного слоя, равную размеру одной молекулы триолеина, разделив Vложки на Sпятна — 2,5 нм.
Более ста лет спустя, Чарльз Овертон заметил, что через биомембраны сравнительно легко проникают вещества, хорошо растворимые в липидах, из чего он сделал заключение, что мембрана должна быть образована тонким липидным слоем. Так эксперименты Франклина оказались впереди современных биофизических изысканий. 1925-м годом датируется идея бислойности мембраны: Гортер и Грендель обнаружили, что монослой липидов, выделенных из мембран эритроцитов, ровно вдвое превосходит площадь поверхности самих клеток.
Однако тогда же было замечено, что мембрана содержит значительное количество белков, которые сильно влияют на ее свойства (в частности, поверхностное натяжение). Это открытие повлекло появление концепции мембраны-«сендвича» (Доусон и Доннелли, 1935), согласно которой липидный бислой, как слой масла в бутерброде, заключен между двумя слоями белка. Прошло не одно десятилетие, пока точные данные по соотношению белков и липидов в мембранах различных клеток и современные методы исследования (такие как рентгеноструктурный анализ и электронная микроскопия) не доказали ошибочности этого представления: на самом деле, белки не окружают бислой, — они в него «встроены», подобно элементам мозаики.
Эта метафора дала название последней «классической» теории строения мембраны: «жидкостно-мозаичная мембрана» [3]. Согласно этой теории, мембрана представляет собой липидный «океан», в котором, подобно айсбергам, плавают молекулы мембранных белков. Сравнение с океаном появилось из-за того, что агрегатное состояние липидов в мембране жидкое, а точнее — жидкокристаллическое. Мембрана сравнительно свободно «течет» в плоскости, в то время как вне нее — строго упорядочена геометрией двойного молекулярного слоя.
«Последней классической» эта теория здесь названа потому, что, с одной стороны, она явно устарела, а с другой — современные представления не достигли еще той лаконичной изящности, чтобы их начала запросто можно было изложить в школьном учебнике [4].
Почему мембрана клетки «жидкая»?
Текучесть липидной фазы мембраны обусловлена присутствием в углеводородных цепях большинства структурных фосфолипидов минимум одной ненасыщенной связи, понижающей температуру плавления липида. Проследить такое фазовое поведение достаточно просто на примере растительного масла и маргарина: первое при комнатной температуре жидкое (содержит жиры, включающие ненасыщенные жирные кислоты, — например, триолеин [Tплавления = 5 °C]), второй же, получаемый из растительного масла гидрированием, твердый (двойные связи ацильных цепей насыщены; для соответствующего насыщенного жира — стеарина — Tплавления = 55 °C (!)).
Полиненасыщенные жирные кислоты (в изобилии присутствующие в рыбьем жире) обладают еще более уникальными свойствами: они поддерживают липидный матрикс мембран в «рабочем» состоянии в широком диапазоне температур, что позволяет рыбам быстро погружаться в холодные слои и всплывать обратно. Кстати, эти уникальные качества полиненасыщенных жирных кислот полезны и для человека.
В настоящее время стало понятно, что липидный компонент мембраны — это не просто пассивный носитель белков, которые и выполняют всю работу, но равноправный участник большинства биохимических процессов. На поверку оказывается, что липидный состав мембраны (а она состоит отнюдь не из одного типа молекул липидов!) тщательно оптимизирован эволюцией и позволяет создать необходимые условия для корректной и эффективной работы мембранных белков. Например, частичное взаимное несмешивание липидных компонентов мембраны эукариотической клетки приводит к появлению микроскопических (строго говоря, даже наноскопических) неоднородностей, называемых также мембранными рафтами (от англ. raft — «плот»). Такое сложное фазовое поведение липидного матрикса мембраны активно используется клеткой: упомянутые рафты, предположительно, образуют функциональные платформы, в которых комплексы мембранных белков выполняют все разнообразие своих функций, причем определенные белки предпочитают находиться в рафтовых областях, тогда как другие — в областях между ними.
В данной статье мы постарались осветить современные представления о биофизике липидных компонентов биологических мембран, и в первую очередь, подробнее остановиться на способности липидов к самоорганизации, которая широко используется клетками в своих нуждах.
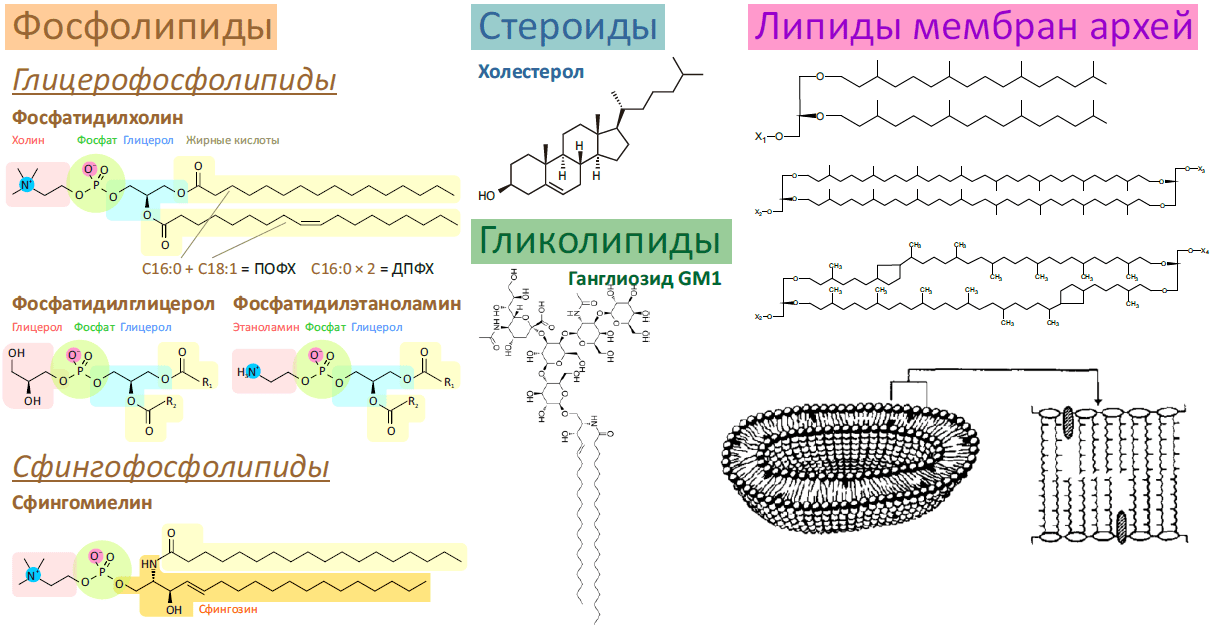
Рисунок 1. Разнообразие липидов — компонентов клеточных мембран. «Комбинаторное» построение большинства липидов (то есть, сочетание разных гидрофобных, гидрофильных и «адапторных» фрагментов) приводит к тому, что в клетке обнаруживается до 1000 разновидностей липидных молекул. Подавляющее большинство из них играет регуляторную роль, либо их роль не изучена. На рисунке показаны только некоторые основные типы липидов, встречающихся в биологических мембранах.
Многообразие биомембран
Не удивительно, что мембраны клеток разных организмов отличаются между собой. Подробное сравнение липидной составляющей различных мембран наводит на мысль, что эти различия носят принципиальный характер, и что «липидный портрет» той или иной мембраны во многом определяет ее функции (помимо «населяющих» эту мембрану белков) [5]. Так, мембраны бактерий отличаются от мембран эукариот тем, что в состав первых входит большое количество отрицательно заряженных фосфолипидов (например, фосфатидилглицеролы), тогда как вторые в основном содержат липиды цвиттерионной природы (то есть, обладая как отрицательным, так и положительным зарядом, в целом они электронейтральны), — например, фосфатидилхолины. Это фундаментальное отличие используется системой врожденного иммунитета многих эукариот, — например, антимикробные пептиды селективно разрушают мембраны бактерий именно благодаря наличию отрицательного заряда на их поверхности [6], [7], а Toll-подобные рецепторы распознают бактериальные патогены благодаря компонентам их клеточной стенки (липиополисахаридам) [8], [9]. (Химическая структура упоминаемых липидов приведена на рис. 1.)
Другая важная особенность эукариот — холестерол (известный также как холестерин), отсутствующий в прокариотических мембранах. Вопреки своей дурной славе у обывателей [12], холестерол играет важнейшую и еще, видимо, не до конца осознанную роль в работе мембран наших клеток (не говоря уже о том, что он является предшественником половых гормонов). Вместе со сфинголипидами (такими как сфингомиелин) холестерол образует рафтовые структуры, придающую эукариотическим мембранам прочность и особую функциональную гетерогенность, о чем подробнее будет сказано ниже.
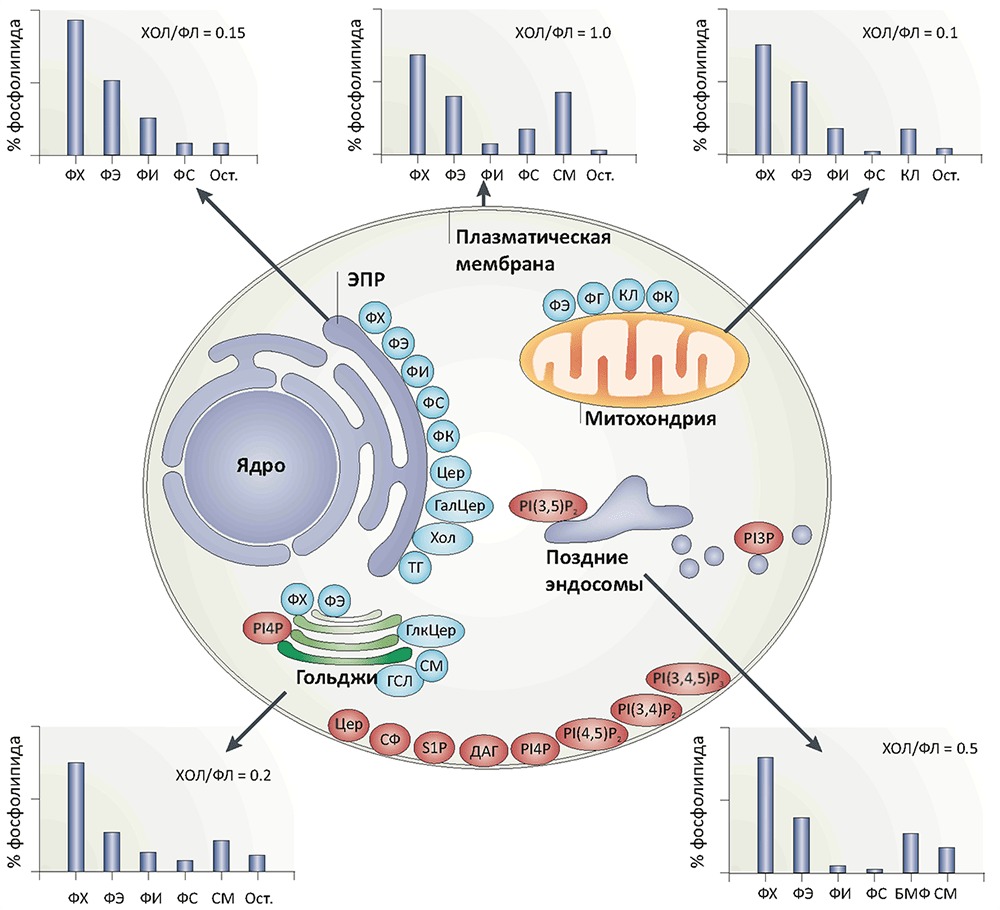
Интересно, что липидный состав разных органелл существенно отличается (рис. 2). Например, липидный состав митохондрий и пластид гораздо больше напоминает бактериальный, нежели эукариотический, подтверждая тем самым химерную гипотезу становления эукариот (эукариогенеза), согласно которой эти органеллы — бывшие бактерии, захваченные во «внутриклеточный плен» путем фагоцитоза какими-то ранними формами эукариот [13]. В эндоплазматическом ретикулуме, являющемся «стартовой точкой» метаболизма большинства липидов, состав обоих листков мембраны примерно одинаковый, однако в аппарате Гольджи, плазматической мембране и эндосомах различия уже весьма существенны, что говорит о наличии активных процессов, создающих эту асимметрию. В частности, фосфатидилсерины (ФС) и фосфатидилэтаноламины (ФЭ) в норме присутствуют только в цитоплазматическом листке плазматической мембраны. Наличие ФС на поверхности клетки может говорить о злокачественном перерождении и запускает программы фагоцитоза и сворачивания крови.
Рисунок 2. Липидный состав различных мембранных структур клеток млекопитающих. Диаграммы показывают липидный состав некоторых клеточных мембран; содержание холестерола (ХОЛ) дано в отношении к суммарному количеству фосфолипидов (ФЛ). Внутри клетки обозначены места синтеза основных фосфолипидов (голубые овалы) и сигнальных липидов (красные овалы) (последних по массе не более 1% от фосфолипидов, за исключением церамидов (Цер)). В эндоплазматическом ретикулуме (ЭПР) синтезируются в основном глицерофосфолипиды, жиры, холестерол и церамиды. Аппарат Гольджи является «поставщиком» сфингомиелина и сложных гликосфинголипидов. Около половины липидов митохондрий (в основном, фосфатидилэтаноламина (ФЭ), фосфатидной кислоты (ФК) и кардиолипина (КЛ)) синтезируется этими органеллами автономно, что, вместе с типично «бактериальным» липидным составом их мембран, говорит в пользу химерной теории эукариогенеза.
Условные обозначения: БМФ — бисмоноацилглицерофосфат; ГалЦер — галактозилцерамид; ГСЛ — гликосфинголипиды; ДАГ — диацилглицерол; КЛ — кардиолипин; СМ — сфингомиелин; ТГ — триацилглицеролы (жиры); ФГ — фосфатидилглицерол; ФИ — фосфатидилинозитол; ФК — фосфатидная кислота; ФС — фосфатидилсерин; ФХ — фосфатидилхолин; ФЭ — фосфатидилэтаноламин; Хол — холестерол; Цер — церамид; PI(?)P — фосфатидилинозитолфосфаты; S1P — сфингозин-1-фосфат; Ост. — остальные липиды.
Совершенно уникальной организацией мембран обладают архебактерии — третий «домен» жизни [10], [11], наряду с бактериями и эукариотами. Эволюционно они считаются более близкими родственниками эукариот, нежели бактерий, хотя по строению липидов мембраны этого не скажешь [14]. Видимо, как адаптация к экстремофильности (способности обитать при высокой температуре и/или солености и/или кислотности), мембраны архей содержат липиды с нетипичным химическим строением (см. рис. 1):
Из всего сказанного следует, что липидный состав мембран отнюдь не является чем-то выбранным раз и навсегда [15]: он претерпел существенные изменения в процессе эволюции. Даже в разные периоды жизни одного и того же организма состав мембран может существенно варьировать. По всей видимости, липидную организацию мембран эукариот можно считать эволюционно наиболее прогрессивной, поскольку она обеспечивает максимально гибкую адаптацию микроскопического окружения под нужды белковых молекул, создавая частично изолированные области в пределах одной, казалось бы, жидкой фазы. Далее мы остановимся на этих аспектах функционирования гетерогенной эукариотической мембраны подробнее.
Латеральная гетерогенность эукариотических мембран
Что же заставило исследователей обратить внимание на то, что мембрана — это нечто более сложно устроенное, нежели липидный «океан», в котором плавают «айсберги» белков, согласно модели Сингера-Николсона? Можно сформулировать три основных аргумента, почему клеточная мембрана должна быть устроена более сложно и организованно, чем это было принято считать в те годы:
В практическом смысле вышеперечисленное обозначает, что липидная компонента, будучи жидкой, тем не менее, способна образовывать частично изолированные области бислоя, обладающие особыми структурными свойствами. Эти участки представляют собой кластеры («островки») молекул липидов, сравнительно более упорядоченные и «твердые», чем окружающая их более «жидкая» фаза. В конце 1990-х такие кластеры получили уже упомянутое название рафтов [17], и то же самое название было дано новой теории организации биологических мембран.
Сосуществование двух жидких липидных фаз — относительно более и менее упорядоченной — оказывается возможным, если липидная смесь содержит как минимум три компоненты: «легкоплавкий» липид (низкая температура плавления, ненасыщенные хвосты), «тугоплавкий» липид (температура плавления выше физиологической, насыщенные хвосты и/или высокая склонность образовывать водородные связи с соседями), а также холестерол. «Тугоплавких» липидов в эукариотической мембране немного, потому что иначе она была бы гелеобразной массой вроде маргарина: основным является сфингомиелин (производное церамида, рис. 1).
Основной фосфолипид плазматических мембран эукариот — пальмитоилолеилфосфатидилхолин (ПОФХ) — содержит двойную связь в остатке олеиновой кислоты, и этого уже оказывается достаточно, чтобы температура плавления этого липида снизилась до −3 °C (по сравнению с его полностью насыщенным аналогом — дипальмитоилфосфатидилхолином (ДПФХ), — температура фазового перехода которого составляет 41,5 °C).
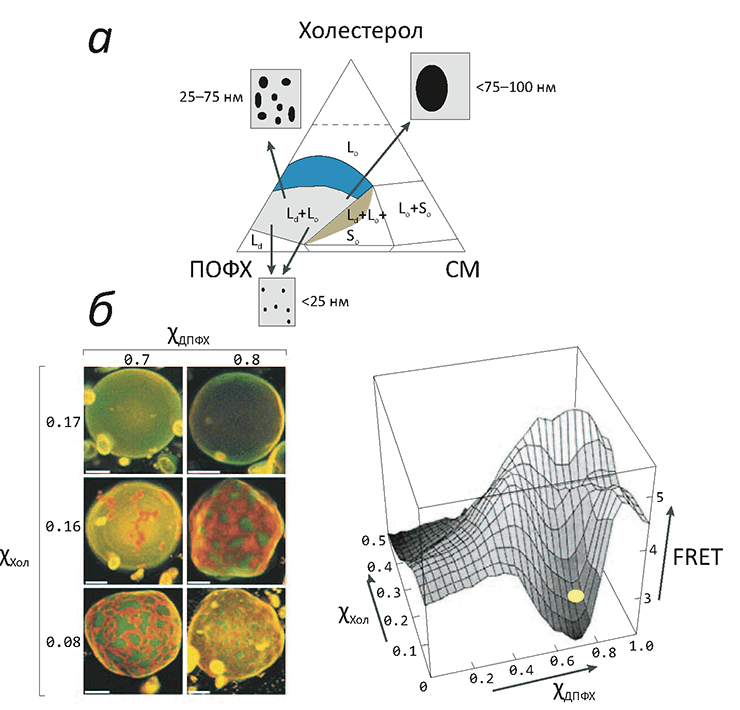
Рисунок 3. «Жидкое упорядоченное» состояние липидов в модельных мембранах. а — Фазовая диаграмма тройной смеси холестерола (Хол), сфингомиелина (СМ) и пальмитоилолеилфосфатидилхолина (ПОФХ) (при 23 °C). Цветные области соответствуют составам, при которых мембрана пребывает в жидком состоянии. Сосуществование жидкой упорядоченной (Lo) и жидкой неупорядоченной (Ld) фаз показано синим цветом: здесь при увеличении концентрации холестерола в диапазоне 10–35% размеры доменов «жидкой упорядоченной» фазы постепенно увеличиваются. б — Образование макроскопических мембранных доменов в гигантских везикулах, состоящих из насыщенного (ДПФХ) и ненасыщенного (ДОФХ) фосфолипидов, а также холестерола. Домены окрашиваются флуоресцентными красителями, «предпочитающими» упорядоченную (Lo) или неупорядоченную (Ld) фазы. При увеличении концентрации холестерола сверх 16% макроскопических доменов уже не заметно, но разделение Lo/Ld продолжает существовать, о чем говорит низкий сигнал резонансного переноса энергии между молекулами красителя разных типов, находящихся в разных доменах (примерное положение двух верхних микрофотографий везикул обозначено справа желтым кругом).
Такая тройная смесь «туго-» и «легкоплавкого» липидов с холестеролом демонстрирует сложное фазовое поведение (рис. 3). По всей видимости, молекулы холестерола играют роль «центров кристаллизации» для доменов из «тугоплавких» липидов, однако его присутствие в то же время не позволяет им образовать твердую (гелевую) фазу. Чтобы точнее понять возможные фазовые состояния в мембране и сложных липидных смесях, ее изображающих, введем следующие обозначения:
Равновесие между Lo/Ld фазами было давно показано на искусственных мембраноподобных системах (например, гигантских везикулах, изготовленных из липидов легочного сурфактанта) (рис. 3б), однако непосредственно в биологической мембране такого разделения (а, значит, и рафтов) пронаблюдать долгое время не удавалось. В чем же дело, если липидный состав искусственных мембран был подобран максимально похожим на мембраны настоящие?
Проблема заключается в том, что в биологических мембранах жидкая упорядоченная фаза сильно «раздроблена», и максимальный размер рафтов не превышает 100 нм, что недоступно для непосредственного наблюдения в оптический микроскоп. (Даже флуоресцентная конфокальная микроскопия, делающая «видимыми» отдельные светящиеся молекулы, в данном случае не сможет сказать, находятся ли определенные белки и пептиды в пределах одного кластера или нет.) Причины, в силу которых в живой клетке рафты не сливаются в крупные домены, видимые в оптический микроскоп (а именно это и происходит в искусственных мембранах), мы обсудим чуть дальше.
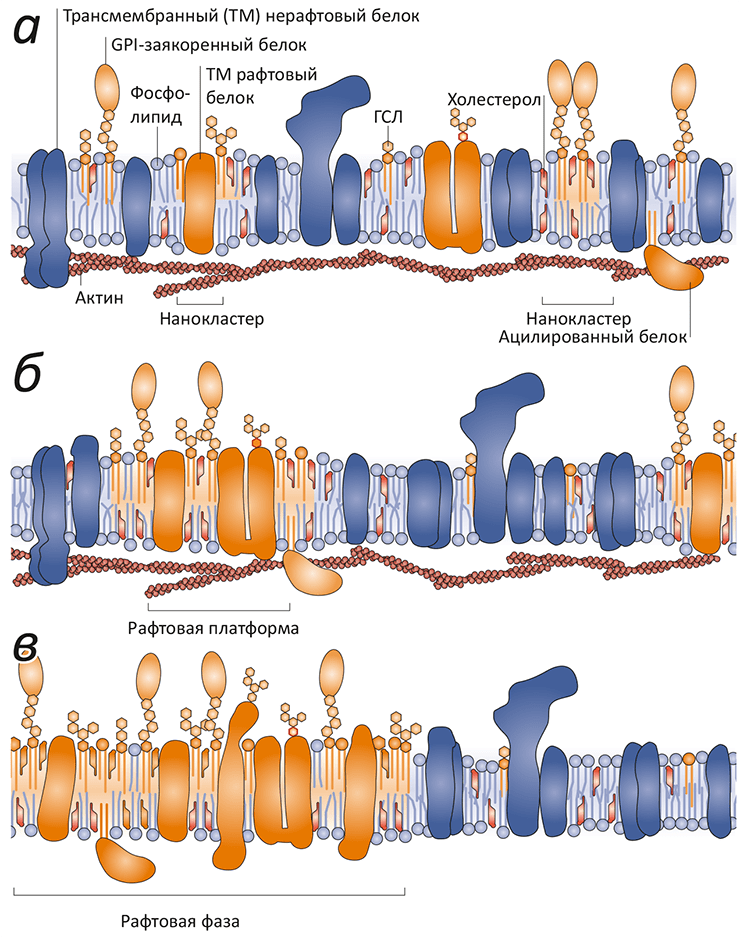
Рисунок 4. Рафтовые неоднородности в мембране различного масштаба. а — Нанокластеры холестерола, сфингомиелина, гликосфинголипидов и белков плазматической мембраны различаются по составу. Считается, что в эти кластеры входят ГФИ-заякоренные белки, трансмембранные (ТМ) белки, специфичные для рафтов, и цитоплазматические белки, связанные с актиновыми филаментами. «Обычные» ТМ-белки не входят в состав рафтов. б — В ответ на внешние сигналы нанокластеры могут сливаться с образованием рафтовой платформы, важной для ТМ передачи сигналов и мембранного транспорта. в — Рафтовая фаза, видимая в микроскоп (ø ≈1 мкм), наблюдается исключительно в равновесных мембранных системах, таких как гигантские синтетические или мембранные везикулы. В «нативных» мембранах постоянный обмен веществом и энергией «дробит» рафтовую фазу до субдифракционных размеров.
На маленьком липидном плоту
Гипотеза рафтов восходит к наблюдению, что гликосфинголипиды в комплексе Гольджи распределены не равномерно, а кластеризуются вместе перед тем, как направляться к полюсам поляризованных эпителиальных клеток. Лабораторное изучение этих кластеров показало, что, в отличие от «обычных» участков мембран, эти кластеры не растворяются в детергенте тритон X-100: они более прочные и устойчивые. Согласно химическому анализу, эти кластеры состоят преимущественно из холестерола и сфингомиелина (рис. 1), а основные белки, неизменно попадающие в эти кластеры — это гликозилфосфатидилинозитол (ГФИ)-заякоренные белки (GPI-anchored proteins). Было сделано предположение, что эти плотные кластеры образуют стабильные «плоты» (размером примерно 50 нм), в которые встроены определенные типы белков. Дополнительно в пользу этой концепции говорил тот факт, что синтетические мембраны, содержащие холестерол и гликосфинголипиды, демонстрируют примерно те же свойства: липиды разделяются на две несмешивающиеся фазы, которые даже можно разглядеть в микроскоп (рис. 3б).
Однако с течением времени стало понятно, что такое представление — противоположная крайность по сравнению с жидкостно-мозаичной моделью Сингера и Николсона: рафты далеко не столь стабильны, как это было постулировано первоначально. По всей видимости, это динамические структуры, постоянно обменивающиеся молекулами липидов и белков с остальной частью мембраны. При этом липиды в рафтах упакованы гораздо более плотно и структурированно, нежели в окружающей «жидкой» мембране. Сравнительно современное определение рафтов звучит так:
Мембранные рафты — это маленькие (10–200 нм), гетерогенные и очень динамичные липидные кластеры (или домены), обогащенные холестеролом и сфинголипидами, и принимающие участие в клеточной компартментализации. В некоторых случаях рафты могут стабилизироваться за счет белок-белковых и белок-липидных взаимодействий, формируя более крупные «рафтовые платформы» [19].
Модель рафтовой гетерогенности показана на рис. 4.
Однако, несмотря на то, что определение рафтам дано, само их существование представлялось до недавнего времени довольно-таки спорным, то есть — не подтвержденным в прямом эксперименте. Как же понимать этот парадокс?
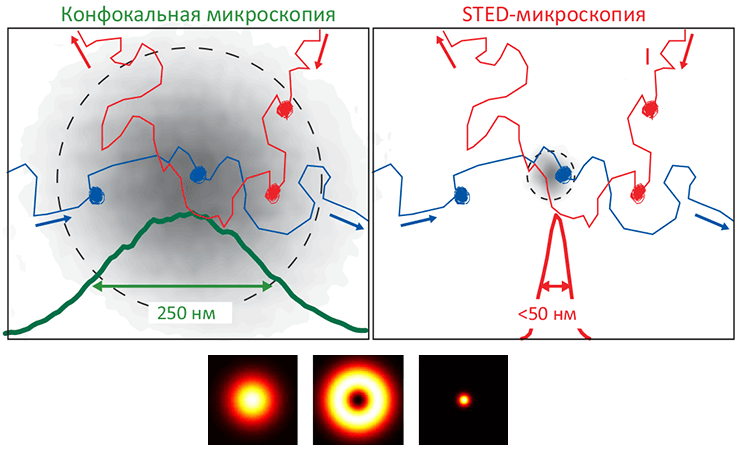
Дело в том, что существование мембранной фракции, не растворимой в детергентах — это еще не повод считать эту фракцию рафтами (функциональными неоднородностями). Непосредственное же изучение этих доменов затруднено в связи с тем, что рафты очень сложно наблюдать «напрямую» из-за их малого размера: типичный их предполагаемый диаметр меньше дифракционного предела оптической микроскопии (≈200 нм). (Здесь речь идет именно об оптическом, а не рентгеновском или электронном излучении, потому что только оно позволяет наблюдать за клеткой неинвазивно, то есть — не разрушая ее.) Правда, в последние годы уже появились экспериментальные методики непосредственного наблюдения рафтовых кластеров (см. таблицу). В частности, одна из разновидностей оптической микроскопии сверхвысокого разрешения — наноскопия индуцировано-истощенного излучения (stimulated emission depletion, STED) — позволила установить, что ГФИ-заякоренные белки в течение достаточно длительного времени (10–20 мс) захватываются в сфинголипидно-холестерольные домены размером
Рисунок 5. Микроскопия подавления индуцированного излучения (STED) — инновационный способ неинвазивного наблюдения липидной динамики мембран в наномасштабе. STED-микроскопия — один из ультрасовременных оптических методов сверхвысокого разрешения, позволяющих «заглянуть за» дифракционный барьер (то есть, различать объекты, меньшие ≈200 нм). Образование «упорядоченной жидкой» фазы (Lo) связано с образованием доменов, обогащенных холестеролом и сфингомиелином, что можно установить при помощи метода флуоресцентно-резонансного переноса энергии (FRET). Однако размер зоны, в пределах которой «обычный» конфокальный микроскоп (слева) позволяет различать детали (≈250 нм), оказывается слишком велик, чтобы точно определить, движутся ли две молекулы совместно (то есть, образуют домен) или независимо. STED-микроскопия с размером «зоны наблюдения» всего 50 нм (справа) позволила установить существование холестерольно-сфингомиелиновых доменов на живых клетках, положив конец спору о существовании рафтов в живых клетках.
Внизу. Принцип STED-методики сходен с конфокальной флуоресцентной микроскопией, но здесь, кроме возбуждающего лазерного импульса (слева), запускающего свечение молекул-флуорофоров, используется также кольцевой формы гасящий импульс (в центре), уменьшающий эффективный радиус зоны возбуждения флуорофоров до ≈50 нм (справа; это в 4–5 раз меньше пресловутого «дифракционного барьера»).
| Метод | Что наблюдает | Пространственное / временное разрешение | Пояснение |
|---|---|---|---|
| Спектроскопия скоррелированной флуоресценции (FCS) | Подвижность флуорофора и латеральная гетерогенность | Чувствителен к кластеризации; использование нескольких цветов | |
| Флуоресцентно-резонансный перенос энергии (FRET) | Сближенность донора и акцептора | ||
| a — Точность в определении центра изображения | |||
Кластеризация липидов in silico
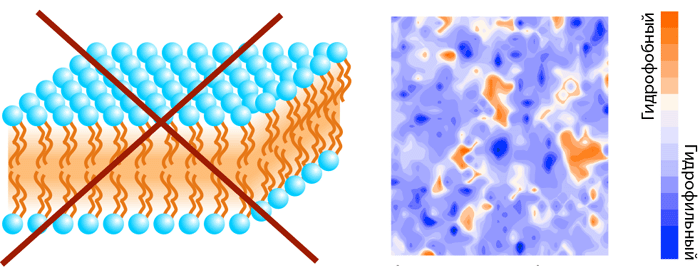
Современные методы молекулярного моделирования позволяют изучить процесс самоорганизации липидных смесей с разной степенью детализации. Расчеты молекулярной динамики (МД; [7], [22]) модельных мембран, в которых все атомы липидов и окружающего растворителя представлены в явном виде, дают наиболее полную информацию. И хотя при таком подробном рассмотрении системы, доступные для моделирования даже на современных суперкомпьютерах, ограниченны в своих размерах (10 2 –10 3 молекул липида) и длительности наблюдения за их динамическим поведением ( −6 c), получаемые результаты дают атомарную картину возникновения мембранных неоднородностей в наномаштабе. Даже в случае однокомпонентной липидной мембраны ее поверхность не является однородно полярной, как это можно предположить из схематического представления липидов в виде «шариков с хвостиками» — часть этих «хвостиков» всплывает на границу вода—мембрана и формирует гидрофобные участки (рис. 6). В итоге мы имеем мозаично организованную поверхность, на которой в полярном «море» рассредоточены гидрофобные «островки» размером до нескольких нм 2 [23].
Рисунок 6. Мозаичная организация поверхности простейшей однокомпонентной мембраны. Слева представлена идеальная модель мембраны, справа — поверхность полноатомной мембраны (ДОФС), раскрашенной по гидрофобности.
При смешивании двух компонентов, например насыщенного (дипальмитоил-) и ненасыщенного (диолеил-) фосфатидилхолинов (ДПФХ и ДОФХ, соответственно), картина усложняется, и наблюдается обособление более «твердой» фазы (ДПФХ) в стабильные нанокластеры, распределенные диффузно в плоскости мембраны [24]. При моделировании трехкомпонентных мембран, в состав которых входят холестерол, сфингомелиеин и ДОФХ даже на небольших временах МД (2×10 −7 с) наблюдается настоящее фазовое разделение, при котором «тугоплавкий» сфингомелеин формирует островок, по границе которого располагается холестерол, обращенный своей «щетинистой» стороной во внешнюю фазу «легкоплавкого» ДОФХ [25].
Увеличить время наблюдения за поведением многокомпонентных мембран in silico, а также размер моделей, позволяет упрощенное («крупнозернистое») описание молекул. Атомы объединяют в обособленные группы — «зерна» (обычно 3–4 атома), — для которых производят расчет МД. Такая методика позволила впервые «увидеть» разделение Lo/Ld фаз в мембране из нескольких тысяч молекул, содержащей 40% насыщенного ДПФХ, 30% ненасыщенного дилинолеилфосфатидилхолина (ДЛФХ) и 30% холестерола, моделируемых в течение 20 мкс [26]. Более того, если к такой модельной мембране добавить трансмембранные спиральные пептиды (минимальные «строительные блоки» большинства мембранных белков), то можно наблюдать, как происходит их сортировка между фазами — моделируемые фрагменты белка предпочитают находиться в более жидкой Ld-фазе (ДЛФХ) и избегают упорядоченной Lo-фазы ДПФХ (рис. 7) [27].
Стоит отметить, что возникновение латеральной гетерогенной структуры в мембране наблюдается не только при смешивании «тугоплавких» и «легкоплавких» липидов, но также любых других отличающихся по своим физико-химическим свойствам — например, заряду полярной головки и склонности образовывать водородные связи с соседями. В частности, в модельной бактериальной мембране, содержащей 70% фосфатидилэтаноламина (ФЭ) и 30% отрицательно зараженного фосфатидилглицерола (ФГ) также наблюдается формирование нанодоменов, — за счет того, что молекулы ФЭ эффективно взаимодействуют друг с другом и вытесняют «невыгодного» партнера ФГ. На «крупнозернистых» моделях была показано, что такая латеральная организация мембран бактерий используется в процессе связывания антимикробными пептидами, которые при этом вызывают рост доменов ФГ и возникновение фазового разделения [28].
Что ограничивает размер рафтов в биомембранах
В реальных экспериментальных системах наблюдается достаточно парадоксальный контраст с искусственными мембранами, разделение фаз Lo/Ld в которых наблюдали неоднократно и при разных условиях. В живой клетке это удалось сделать непосредственно лишь недавно, да и то — используя самые современные технологии субдифракционного наблюдения [21]. В чем же причина такого разительного отличия?
Ведь на границе рафтовой фазы создается поверхностное (линейное) натяжение, а значит, присутствует избыточная свободная энергия, снизить которую можно путем слияния отдельных «плотиков» в одну большую макрофазу. Примерно то же самое наблюдается в супе, мелкие капли жира на поверхности которого постепенно объединяются в более крупные пятна. Фактически, это самое и происходит в искусственных мембранах (например, в мембранных везикулах) — самопроизвольный термодинамический процесс толкает к глобальному разделению Lo и Ld фазы. Но это обозначает, что отсутствие в живой клетке крупных Lo-кластеров — следствие активных процессов, протекающих с затратой энергии. (Возвращаясь к аналогии с супом, мы никогда не увидим одного большого пятна жира в кипящей кастрюле.) С одной стороны, это может происходить «само», поскольку мембрана, как и сама жизнь, — система, далекая от термодинамического равновесия. С другой стороны, эволюция физико-химических свойств мембраны могла направленно выработать такое приспособление, поскольку оно позволяет мембранам выполнять свои функции более эффективно.
Так или иначе, в мембранах протекает ряд процессов, постоянно «дробящих» рафты, — именно поэтому их так долго и не могли с достаточной степенью уверенности «нащупать». Это постоянный обмен веществом и энергией — ведь мембраны представляют собой открытые системы: помимо многочисленных разновидностей везикулярного транспорта, отдельные фрагменты мембраны постоянно «заглатываются» внутрь клетки и после какой-то переработки возвращаются обратно. Кроме этого, специальные белки делят мембрану, подобно «заборчикам», на отдельные участки. С одной стороны, это способствует компартментализации, с другой — также препятствует росту рафтов.
Анализ огромного массива биохимических и биофизических данных относительно липидных доменов в биомембранах, накопившихся за последние 15 лет, привел ученых к выводу, что состав липидного матрикса мембран эволюционно подобран, чтобы при физиологических условиях всегда находиться вблизи фазового перехода (рис. 8). Это способствует образованию в мембранах мезофазы (рафтов), которые, несмотря на свой малый размер и динамическую природу, играют важную (хотя не до конца еще изученную) роль. Какую? Читайте в заключительной части статьи.
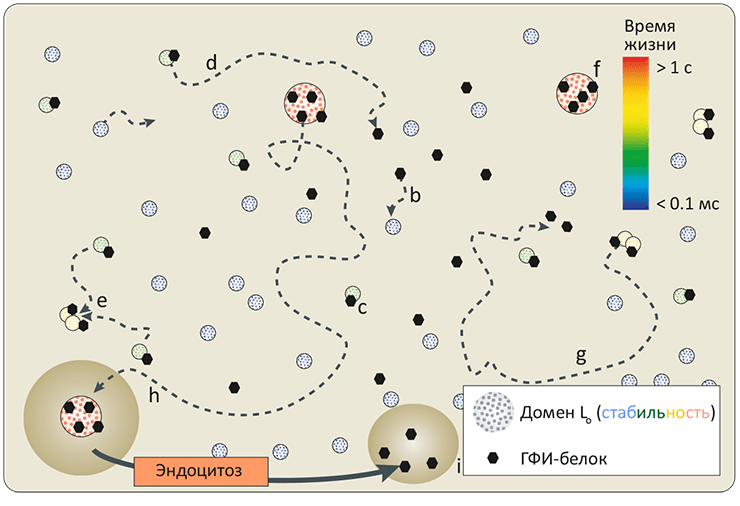
Рисунок 8. Динамическая модель рафтов. Домены «жидкой упорядоченной» фазы (Lo) в мембране гетерогенны как по размеру, так и по времени существования (0,1 мс — 1 с, показано цветом): это зависит от размера, липидного состава и «захваченных» белков, способных стабилизировать рафт. (Длина пунктирных стрелок, изображающих латеральную подвижность доменов, пропорциональна времени жизни.) Маленькие Lo-домены формируются спонтанно и диффундируют в плоскости мембраны (a). Захватив ГФИ-заякоренный или другой рафтовый белок (b), такой домен становится стабильнее и образует комплекс (c), способный или просто распасться (d), или, слившись с другим, увеличить размер (e). Такие столкновения могут привести к формированию более крупного и стабильного Lo-белкового комплекса (f), либо через какое-то время распадающегося самостоятельно, либо захватываемого в эндоцитозный пузырек (h) и «разбираемого» на исходные составляющие (i). Таким образом, рафтовые платформы в биомембранах, хотя и выполняют важные функции, являются динамическими структурами, постоянно возникающими и пропадающими вновь.
Биологическая роль наноразмерных неоднородностей в мембране
Роль такого сложного фазового поведения липидного матрикса мембран еще только предстоит понять в полной мере. Впрочем, сегодня ясно главное — такие свойства позволяют группировать (сортировать) разные белки в частично изолированные области, что позволяет им выполнять предназначенные функции. Также эти свойства определяют то, каким образом мембраны делятся и сливаются, — а это и деление самих клеток, и везикулярный транспорт, и жизненный цикл вирусов, и способность многих токсинов проникать внутрь клеток. Рассмотрим несколько примеров биологической роли рафтов немного более подробно [20]:
Перспективы биофизического изучения мембран
Кажущаяся простота липидного «океана» осталась в прошлом, и сейчас исследователи лишь приблизительно представляют все молекулярные тонкости образования кластеров в липидах. Точно так же далек от понимания и механизм «сортировки» одних белков в рафтовую фазу, а других — в более жидкую область мембраны. Между тем, это понимание дало бы возможность создать стратегию рафт-селективной доставки в клетку различных веществ, — в том числе, лекарств.
Все рассказанное в этой статье относится в первую очередь к мембранам эукариот, — но это еще не обозначает, что у бактерий нет ничего подобного (раз нет и холестерола). Изучение латеральной неоднородности бактериальных мембран может привести к созданию новых поколений антибиотиков, избирательно уничтожающих патогенные микроорганизмы, и свободных от проклятия резистентности, давно уже нависшего над «традиционными» антибактериальными средствами.
История с изучением липидного матрикса мембран в очередной раз показывает, что живая материя устроена значительно сложнее, чем представлялось ранее, и изобретение новых высокоточных методик наблюдения лишь усугубляет эту сложность.
Статья написана в соавторстве с Антоном Полянским и при поддержке РФФИ (конкурс на написание научно-популярных статей), № проекта: 11-04-11516-с. В сокращенном виде она опубликована в «Природе» [31].