кжт это что в медицине
Катехоламинергические полиморфные желудочковые тахикардии (КЖТ)
Одной из наиболее опасных и разнородных клинических групп с высоким риском развития жизнеугрожающих нарушений ритма сердца в молодом возрасте являются аритмии, объединенные под названием: «Катехоламинергические полиморфные желудочковые тахикардии» (КЖТ).
Эта тахикардия была открыта в 70х годах у детей и подростков, у которых были приступы потери сознания на фоне физической или эмоциональной нагрузки.
Клиническим проявлением заболевания является обморок (синкопе) на фоне физической или эмоциональной нагрузки. Вот в этом случае обязательно надо исключать КЖТ, потому что она является самой опасной из всех каналопатий (синдром Бругада, синдром удлиненного интервала QT и другие) так далее, без лечения 80 % больных погибают до 30 лет.
Дальше необходимо медицинские обследования: ЭКГ, холтеровское мониторирование, пробы с физической нагрузкой. Чаще всего КЖТ выявляется именно во время холтеровского мониторирования или на пробах с физической нагрузкой. ЭКГ покоя выявляет выраженное урежение ритма (брадикардию), иногда укорочение интервала PR (время прохождения импульса от предсердий к желудочкам).
Часто на первом холтеровском мониторировании, КЖТ может не выявиться, и необходимо делать повторные исследования, лучше вне клиники, в условиях свободной активности.
Здесь надо сказать, что никогда, ни в коем случае, не пытайтесь при холтеровском мониторировании самостоятельно делать какие бы то ни было нагрузочные тесты вашему ребенку. Все это должно делаться только под контролем врача, при возможности оказания первой помощи, и ни в коем случае не проводите никаких экспериментов, все это может быть очень опасно и закончится трагично.
После диагностики КЖТ начинается лечение. Первым этапом является лекарственная терапия бета-блокаторами (атенолол, обзидан, надолол и др.). Иногда к бета-блокаторам добавляют блокаторы кальциевых каналов (верапомил). При неэффективности медикаментозного лечения, если обмороки сохраняются рассматривается вопрос об имплантации кардиовертера- дефибриллятора и об удалении левого звездчатого ганглия. Физические нагрузки при данном заболевании надо максимально уменьшить, и никакого спорта!
Распространенность КЖТ малоизучена, заболевание чаще встречается у девочек. От описания от единичных больных до небольших групп. Реальная распространенность, значительно выше выявляемых. На практике их примерно треть. Примерно у трети внезапно погибших молодых людей после генетического тестирования нашли мутации в генах ответственных за развитие КЖТ (RYR2, CASQ2). Диагноз поставить достаточно сложно, так как большинство больных годами лечатся от эпилепсии до установления причины обмороков (если успевают).
При всех вариантах каналопатий надо знать, что ребенок живет с этой болезнью всю жизнь, и заболевание и риск такого ребенка велик, и остановка сердца может случиться в любое время, поэтому родителям необходимо позаботится, чтобы это заболевание и риски, были известны администрации школы, детского сада, медсестре, классному руководителю, физруку.
Учителю ОБЖ, необходимо провести несколько уроков посвященных реанимационным действиям по оказанию первой помощи при потери сознания, предварительно обговорив это с директором школы. Аналогичные занятия проводит и наш фонд.
Одной из прогрессивных форм является установка Автоматического Наружного Дефибриллятора (АНД) в школах, спортивных клубах и даже в семьях, где есть несколько больных не только каналопатиями, но и просто пожилые больные с другими болезнями сердца, брать АНД с собой на прогулки, спортивные соревнования у детей, поездки, в отпуск.
Наша организация «Хрустальное Сердце» будет прилагать все свою силу в помощь таким больным и в том числе в приобретении АНД.
При подозрении на КЖТ надо срочно обращаться в клиники, где имеют опыт работы с данными больными, такие как Центр синкопальных состояний и сердечных аритмий у детей и подростков (ЦССССА) ФМБА России на базе ЦДКБ ФМБА России. 115409, Москва, ул. Москворечье 20, тел: 8 (499) 324-5756; 8(985)463-5614 (оба телефона городские), e—mail: csssa@mail.ru.
Гипервентиляционный синдром и дисфункциональное дыхание
Клинические особенности, диагностические критерии гипервентиляционного синдрома (ГВС) и дисфункционального дыхания (ДД) недостаточно знакомы широкому кругу врачей [1, 2, 3]. К одной из исторических вех, связанной с понятиями о функциональных нарушениях
Клинические особенности, диагностические критерии гипервентиляционного синдрома (ГВС) и дисфункционального дыхания (ДД) недостаточно знакомы широкому кругу врачей [1, 2, 3]. К одной из исторических вех, связанной с понятиями о функциональных нарушениях дыхания, относят 1871 год, когда Да Коста (Da Costa Jacob, 1833–1900), американский врач, принимавший участие в Гражданской войне США, применил термин «гипервентиляционый синдром» (ГВС) у пациентов с так называемым «солдатским сердцем». С тех пор для характеристики дыхательных расстройств предлагались различные альтернативные определения: «дыхательный невроз», «нейрореспираторная дистония», «респираторный синдром», «респираторная дискинезия», «идиопатическая гипервентиляция», «нейрореспираторный синдром», «неустойчивое дыхание» и др. Однако указанные термины не получили широкого признания. Они являются достаточно общими и не отражают особенностей нарушений дыхания у конкретного больного [4]. Перечисленные определения нередко связывают с понятием «непонятная одышка» (unexplained dyspnea).
ГВС встречается в 6–11% от числа пациентов общей практики. Соотношение мужчин и женщин составляет 1:4, 1:5; чаще наблюдается в 30–40 лет, но возможно развитие в других возрастных группах, включая детей и пожилых. L. Lum (1987) подчеркивал, что «каждый врач в течение недели может встретить хотя бы одного больного с ГВС». Врачи различных специальностей — невропатологи, кардиологи, пульмонологи, психиатры — могут наблюдать у своих пациентов явления гипервентиляции. Острое течение ГВС встречается значительно реже, чем хроническое, и составляет лишь 1–2% от общего числа больных [2, 6, 7].
Причины развития ГВС довольно многочисленны. Это неврологические и психические расстройства, вегетативные нарушения, болезни органов дыхания, некоторые заболевания сердечно-сосудистой системы, органов пищеварения, экзогенные и эндогенные интоксикации, лекарственные средства (салицилаты, метилксантины, β-агонисты, прогестерон) и др. Считается, что в 5% случаев ГВС имеет только органическую природу, в 60% случаев — только психогенную, в остальных — комбинации этих причин [6].
Важной особенностью развития ГВС является то обстоятельство, что если причины, являющиеся триггерными, устраняются, то гипервентиляция, которая уже не соответствует требованиям конкретной ситуации, сохраняется, сохраняется и гипокапния. Происходит стабилизация гипокапнических нарушений газообмена и формируется «порочный круг» ГВС, который начинает циркулировать автономно, и симптомы могут персистировать достаточно долго — феномен «махового колеса». Эти изменения реакции дыхания указывают на уязвимую систему контроля дыхания, которая не способна поддержать нормальное парциальное давление углекислого газа в крови (РСО2) и кислотно-щелочной гомеостаз [8, 9, 10, 11].
В основе развития клинических проявлений ГВС лежат гипокапнические нарушения газообмена [2, 3, 10]. Среди множества клинических проявлений ГВС одышка является ведущей жалобой и встречается практически в 100% случаев. Одышка может быть единственным клиническим проявлением, но чаще сочетается с другими симптомами.
Основные клинические проявления ГВС
Респираторные: одышка, вздохи, зевота, сухой кашель.
Общие: снижение трудоспособности, слабость, утомляемость, субфебрилитет.
Кардиальные: кардиалгия, экстрасистолия, тахикардия.
Психоэмоциональные: тревога, беспокойство, бессонница.
Гастроэнтерологические: дисфагия, боли в эпигастрии, сухость во рту, аэрофагия, запоры.
Неврологические: головокружение, обмороки, парестезии, тетания (редко).
Мышечные: мышечная боль, тремор.
Диагностика ГВС в первую очередь опирается на знание врачей самых различных специальностей об особенностях клинической картины ГВС. ГВС должен устанавливаться только после проведения дифференциальной диагностики с другими заболеваниями, протекающими с синдромом одышки. Полиморфизм клинических проявлений ГВС вызывает диагностические проблемы. Назначаются многочисленные обследования, дорогостоящие, ненужные, а иногда и опасные для больного. L. Lum (1987), обсуждая диагностические проблемы, называет среди врачебных ошибок бесполезные абдоминальные операции, операции на позвоночнике и других органах, инвазивные исследования, проводимые не без риска, и, что еще хуже, такие диагнозы, как эпилепсия и инфаркт миокарда. Взаимосвязи гипокапнии и ассоциированных с ней симптомов являются чрезвычайно сложными. Многие врачи при регистрации у больных низких значений РСО2 автоматически устанавливают диагноз ГВС, что является неправильным. Известно, что явления гипокапнии могут быть у больных рестриктивными легочными процессами, при лихорадочных состояниях, сердечной патологии, однако при этом «классических» гипокапнических жалоб может и не быть. И наоборот, так называемые гипокапнические жалобы, например тревога, одышка, парестезии и др., встречаются у пациентов с нормокапнией.
В практической медицине больной с ГВС — это пациент, предъявляющий жалобы на одышку, которая не соответствует данным объективного осмотра, показателям клинико-инструментальных исследований дыхания, с диспропорциональной, непонятной одышкой, субъективное восприятие которой является довольно тягостным. К сожалению, при отсутствии достоверных объяснений одышки больные обычно направляются для консультаций в различные лечебные учреждения. В конечном итоге они и формируют основной контингент альтернативной медицины, различных псевдоспециалистов «по тренировке правильного дыхания».
Исследование функции внешнего дыхания, имеющее важное значение в дифференциальной диагностике одышки, не помогает в верификации функциональных нарушений дыхания. Основным подтверждением ГВС служит выявление гипокапнических нарушений газообмена. Снижение РСО2 — прямое свидетельство альвеолярной гипервентиляции. Однако исходная гипокапния у больных с ГВС встречается не так часто. Поэтому в тех случаях, когда у пациента с предположительным ГВС в условиях покоя определяются нормальные значения углекислоты, рекомендуется определение изменений уровня СО2 при различных провокационных тестах. К «золотому стандарту» диагностики ГВС относят пробу с произвольной гипервентиляцией.
Департаментом пульмонологии университета г. Наймиген (Голландия) разработан Наймигенский опросник (Nijmegen questionnaire) для выявления физиологических показателей дизрегуляции вентиляции, сопоставимых с ГВС (табл.). Анкета содержит 16 пунктов, которые оцениваются по 5-балльной шкале (0 — никогда, 4 — очень часто). Минимальные и максимальные достижимые числа — 0 и 64 соответственно.
Данный опросник нашел свое применение прежде всего для скрининг-диагностики ГВС. Существует положение, согласно которому использование данного опросника позволяет корректно предсказывать ГВС в 90% от всех случаев [2, 12].
В последние годы в клиническую практику начинает внедряться понятие «дисфункциональное дыхание» (ДД). Приоритет внедрения термина принадлежит Ван Диксхорну (J. van Dixhoorn), который привел его в работе Hyperventilation and dysfunctional breathing (1997). Основанием для этого явилось понимание, что при функциональных нарушениях дыхания возможны различные изменения паттерна дыхания и значений РCO2, а не только гипокапнические расстройства, характерные для ГВС. ДД может проявляться также быстрым, аритмичным, поверхностным дыханием, частыми вздохами, преобладанием грудного типа дыхания.
Одной из сложных и дискуссионных проблем в пульмонологии является понимание взаимоотношений ГВС, ДД и бронхиальной астмы (БА) [15–18]. С. И. Овчаренко и др. (2002) у 22 из 80 больных БА выявили нарушения дыхания, соответствующие критериям ГВС. Сведений относительно встречаемости дисфункциональных нарушений дыхания при астме немного. Установлено, что среди лиц с диагнозом БА и по крайней мере с одним предписанием антиастматического препарата 29% имеют клинические признаки ДД [19]. Указывается, что ДД может усиливать симптомы БА и приводить к избыточному назначению лекарств.
Достаточно сложным является понимание механизмов развития дисфункциональных расстройств дыхания при БА; существует ряд предположений. К достаточно обоснованным факторам развития гипервентиляции относят тревожные расстройства. Использование больными бронходилататоров (β-2-агонисты, теофиллин), которые обладают эффектами стимуляции дыхания, также относят к факторам развития гипервентиляции. Обсуждается роль изменений перцепции одышки при БА. Анализ существующих проблем взаимосвязи ДД и БА провел M. Morgan (2002), представив следующие ключевые положения:
В зависимости от установления особенностей ДД должна осуществляться и программа лечения больных. При выявлении ГВС релаксирующие методы дыхательной гимнастики проводятся под руководством опытных инструкторов, назначаются β-адреноблокаторы, бензодиазепины [5, 22, 23]. При явлениях гиповентиляции — массаж дыхательных мышц, использование дыхательных тренажеров. Выявление ГВС при БА указывает на необходимость применения методов коррекции функциональных нарушений дыхания. Релаксирующие дыхательные упражнения за счет неспецифических механизмов дыхательного тренинга улучшают качество жизни у этих больных.
По вопросам литературы обращайтесь в редакцию.
В. Н. Абросимов, доктор медицинских наук, профессор
Рязанский ГМУ им. акад. И. П. Павлова, Рязань
Кжт это что в медицине
а) Терминология:
1. Сокращения:
• Каротидно-кавернозная фистула (ККФ)
2. Синонимы:
• Прямая ККФ, ККФ с высоким кровотоком 3. Определения:
• Разрыв/рассечение кавернозного отдела внутренней сонной артерии (ВСА) с формированием единичного отверстия с артериовенозным шунтированием крови в кавернозный синус (КС)
1. Общие характеристики:
• Лучший диагностический критерий:
о Проптоз, дилатация верхней глазной вены (ВГВ) и КС, увеличение размеров глазодвигательных мышц (ГДМ)
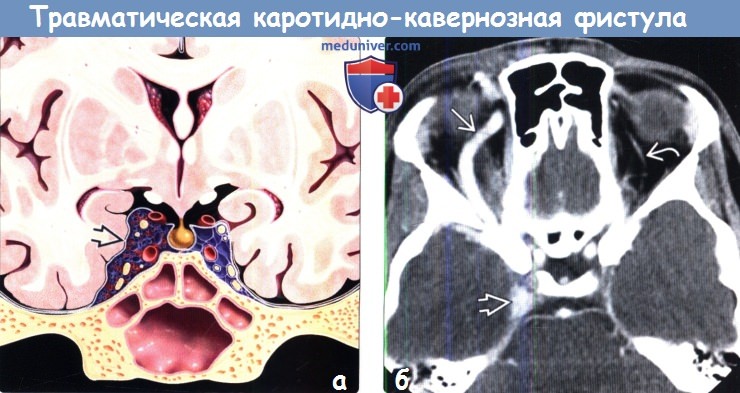
(б) Бесконтрастная КТ, аксиальный срез: определяются классические признаки ККФ. Отмечается расширение правого пещеристого синуса, а также ипсилатеральной верхней глазной вены, диаметр которой более, чем в 4 раза превышает диаметр левой верхней глазной вены.
3. МРТ при травматической каротидно-каверной фистуле:
• Т1-ВИ с контрастированием:
о Признаки аналогичны КТ с контрастированием
• МР-ангиография:
о ↑ сигнала от кровотока в КС и ВГВ:
о Потеря сигнала во ВСА вследствие турбулентного кровотока
4. УЗИ:
• Доплеровское исследование: инверсия кровотока в дилатирован-ных ВГВ (по направлению от интра- к экстракраниальным отделам)
5. Ангиография при травматической каротидно-каверной фистуле:
• Традиционная:
о Раннее заполнение контрастом КС + путей оттока, включая:
— Ретроградное заполнение контрастом ВГВ, угловых + лицевых вен
— Контралатеральный КС
— Каменистые синусы → внутреннюю яремную вену(ы)
о Снижение или отсутствие антеградного кровотока во ВСА за пределами фистулы, зависит от размера дефекта ВСА
6. Рекомендации по визуализации:
• Лучший инструмент визуализации:
о ЦСА является окончательным методом исследования
о КТ/КТ-ангиография могут помочь в постановке предположительного диагноза; для его подтверждения и последующего лечения необходима ЦСА
• Советы по протоколу исследования:
о ЦСА: при съемке используйте метод увеличения и высокую частоту кадров для визуализации точной локализации шунта
о КТ-ангиография: тонкосрезовое сканирование с многоплоскостной реформацией
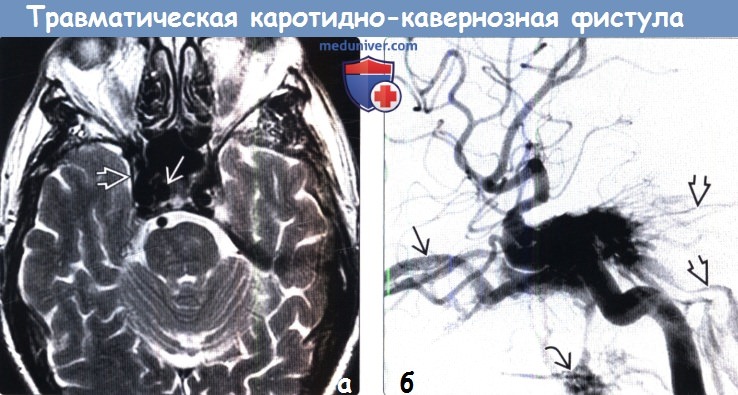
(б) ЦСА, боковая проекция: у пациента с ККФ в артериальную фазу определяется контрастирование пещеристого синуса. Также контрастированы множественные венозные пути оттока крови из пещеристого синуса, включая верхние глазные вены, верхний и нижний каменистые синусы, крыловидное и глоточное венозные сплетения.
в) Дифференциальная диагностика:
1. Непрямая ККФ:
• Также именуется ККФ с низким кровотоком, дуральная артериовенозная фистула (дАВФ) КС
2. Увеличение размеров ГДМ:
• Офтальмопатия Грейвса
• Воспалительная псевдоопухоль, новообразование
в) Патология. Общие характеристики травматической каротидно-каверной фистулы:
• Этиология:
о Перелом костей основания черепа с повреждением ВСА костным отломком
о Повреждение стенки сосуда от растяжения в участке между неподвижными точками рваного отверстия и переднего наклоненного отростка клиновидной кости
• Ассоциированные аномалии:
о Артериализация кровотока в КС с венозным рефлюксом
— Верхние/нижние глазные вены → проптоз, хемоз, ↑ внутриглазного давления → ↓ перфузионного давления в сосудах сетчатки глаза → слепота
— Корковые вены → повышенный риск САК
о Снижение антеградного кровотока во ВСА за пределами ККФ → полушарная ишемия
г) Клиническая картина травматической каротидно-каверной фистулы:
1. Проявления:
• Наиболее частые признаки/симптомы:
о Манифестация возможна в течение нескольких дней или недель после травмы
о Шум при аускультации, пульсирующий экзофтальм, орбитальный отек/эритема, ↓ зрения, глаукома, головная боль
о Полушарная ишемия при ↓ кровотока во ВСА за пределами ККФ
о Тяжелая/быстрая потеря зрения, САК → неотложное состояние
о Очаговый неврологический дефицит → III-VI черепные нервы
2. Течение и прогноз:
• Варианты эндоваскулярного вмешательства включают:
о Трансартериально-трансфистулярная эмболизация съемным баллоном
о Трансвенозная эмболизация
о Pipeline стентирование в области разрыва ВСА
о Coil-эмболизация ВСА или ее эмболизация съемными баллонами (при переносимости пациентом отсутствия антеградного кровотока за пределами фистулы или положительным тестом эмболизации съемным баллоном)
д) Диагностическая памятика:
1. Советы по интерпретации изображений:
• Дилатация ВГВ и КС, проптоз, отек внутриглазничной жировой клетчатки
2. Советы по отчетности:
• КТ/МРТ могут помочь в постановке предположительного диагноза; для постановки окончательного диагноза и последующего лечения необходима ЦСА
е) Список литературы:
Редактор: Искандер Милевски. Дата публикации: 11.3.2019
Спазмолитики: от клинической фармакологии до фармакотерапии
Препараты, относящиеся к группе спазмолитиков, являются одними из самых востребованных и назначаемых врачами различных специальностей. Дисфункция гладкомышечных клеток внутренних органов лежит в основе как хронического, так и остр
Препараты, относящиеся к группе спазмолитиков, являются одними из самых востребованных и назначаемых врачами различных специальностей. Дисфункция гладкомышечных клеток внутренних органов лежит в основе как хронического, так и острого болевого синдрома, при различных заболеваниях органов пищеварения, мочевыводящей системы органов малого таза [1, 2]. Наиболее частой причиной развития боли при патологии внутренних органов, имеющих слой гладкомышечных клеток, является их избыточное сокращение. Симптомы спастической дисфункции органов пищеварения встречаются в 30% случаев при отсутствии органического поражения желудка или кишечника, что обусловливает частое самостоятельное (без врачебного назначения) применение спазмолитических препаратов. Широкое применение препаратов этой группы диктует необходимость постоянно напоминать об их клинической фармакологии, особенно свойствах и переносимости, во избежание как недооценки, так и переоценки лечебных возможностей.
Важно, что, ликвидируя или предотвращая спазмы гладкой мускулатуры, спазмолитики хотя и оказывают выраженное анальгетическое действие, нормализуя функционирование органа, но при этом не вмешиваются в механизмы боли. В отличие от ненаркотических и опиоидных анальгетиков они не представляют существенной угрозы «стирания» симптоматики при тяжелом органическом поражении (маскирование картины и затруднение в верификации диагноза).
Наиболее часто спазмолитики применяются для:
Процесс сокращения мышечной клетки определяется концентрацией ионов кальция в ее цитоплазме, попадающих из внеклеточного пространства через кальциевые (медленные) каналы клеточных мембран. Другой источник кальция — внутриклеточные депо, в большей степени представленные в гладкой мускулатуре толстой кишки и значительно меньше — в тонкой кишке, в том числе 12-перстной. Высвобождение этой фракции ионов кальция приводит к фазовому сокращению мышечной клетки [3]. Одним из наиболее распространенных медиаторов, влияющих на процесс мышечного сокращения, является ацетилхолин. При его взаимодействии с мускариновыми холинорецепторами (М-холинорецепторами) происходит открытие натриевых каналов, вход ионов натрия в клетку и, как следствие, деполяризация мембраны. Деполяризация, в свою очередь, приводит к открытию кальциевых каналов и поступлению кальция внутрь клетки, повышению его внутриклеточной концентрации и мышечному сокращению. Активация ацетилхолином М-холинорецепторов приводит к повышению тонуса, сокращению гладкомышечной клетки, а блокада — к снижению тонуса и расслаблению гладкомышечной клетки, что лежит в основе назначения в качестве спазмолитиков М-холиноблокаторов [4, 5].
Кальций взаимодействует с кальмодулином, активирует киназу легких цепей миозина, которая отщепляет фосфорный остаток от молекулы АТФ, связанной с миозином, что ведет к взаимодействию актина и миозина и сокращению клетки. Важнейшую роль в функционировании мышцы, как известно, играет система циклических нуклеотидов [6]. Циклический аденозинмонофосфат (цАМФ) и циклический гуанозинмонофосфат (цГМФ) тормозят высвобождение внутриклеточного кальция и вход ионов кальция внутрь клетки (цАМФ), ослабляют взаимодействие ионов кальция с кальмодулином. Уровни цАМФ и цГМФ контролируются фосфодиэстеразой (ФДЭ), разрушающей эти нуклеотиды. Таким образом, чем выше активность ФДЭ, тем ниже концентрация цАМФ и цГМФ, тем выше концентрация ионов кальция в цитоплазме и тонус мышечной клетки и, напротив, чем ниже активность ФДЭ, тем выше концентрация цАМФ и цГМФ, тем ниже концентрация ионов кальция в цитоплазме и тонус мышечной клетки. Физиологическая роль ФДЭ многообразна. Выделено 11 изоформ этого фермента [4]. Основные типы ФДЭ, влияющие на тонус гладкомышечной клетки, представлены в табл. 1.
Описанные выше механизмы регуляции концентрации кальция внутри мышечной клетки, которые нарушаются при патологических условиях и приводят к спазму гладкомышечных клеток внутренних органов, подразумевают наличие нескольких мишеней фармакологического воздействия [7]:
М-холинолитики
Это одна из старейших групп лекарственных средств, применяемых в медицине для воздействия на верхние отделы желудочно-кишечного тракта. Они в 5–10 раз эффективнее влияют на моторику желудка, чем толстого кишечника, что связано с неодинаковой плотностью М-холинорецепторов в различных отделах желудочно-кишечного тракта [8]. Наибольшее количество рецепторов — в желудке, значительно меньше — в кишечнике. Классический холинолитик атропин потерял свое значение вследствие большого количества побочных эффектов. Попыткой увеличить безопасность терапии М-холинолитиками было создание гиосцина бутилбромида, относящегося к относительно селективным М-холиноблокаторам, действующим на М1-и М3-подтипы рецепторов, локализованные преимущественно в стенках верхних отделов желудочно-кишечного тракта, желчного пузыря и билиарных протоков. В отличие от атропина препарат не проникает через гематоэнцефалический барьер и имеет низкую (8–10%) системную биодоступность, что накладывает отпечаток на вариабельность в проявлениях эффекта.
Гиосцина бутилбромид накапливается в гладкой мускулатуре желудочно-кишечного тракта, выводится из организма в неизмененном виде почками. Действует преимущественно на желудок, 12-перстную кишку, желчный пузырь. Спазмолитическое действие на тонкую и толстую кишку реализуется в дозах, в 2–10 раз превышающих терапевтические, поэтому при спазмах этих отделов кишечника применение не целесообразно (лучше использовать миотропные спазмолитики, например, дротаверин (Но-шпа)) [9].
Холинолитики успешно применяются при болях в животе, обусловленных спазмом в верхних отделах ЖКТ: дисфункции сфинктера Одди, дискинезии желчевыводящих путей, пилороспазме. Несмотря на то, что гиосцина бутилбромид не проникает в ЦНС, он может вызывать типичные для М-холинолитиков побочные эффекты (в сравнении с плацебо на 4% чаще). Это делает его, как и другие препараты группы, противопоказанным при глаукоме, доброкачественной гиперплазии простаты, органических стенозах желудочно-кишечного тракта, тахиаритмиях [10]. Поскольку препарат продается без рецепта и может вызвать нежелательные эффекты у пациентов, страдающих указанными заболеваниями, важно заблаговременно информировать их об этом. К сожалению, значение селективности действия лекарственных средств часто необоснованно преувеличивается. Так, спорным представляется утверждение, что гиосцина бутилбромид действует только в месте спазма, поскольку М-холинорецепторы расположены не локально.
С точки зрения широты воздействия на органы и системы гиосцина бутилбромид не менее эффективен, чем миотропные средства (дротаверин (Но-шпа)), но его действие, в отличие от миотропных препаратов, может повышать риски при его использовании: его нельзя принимать детям до 6-летнего возраста, одновременно с антидепрессантами (особенно трициклическими), антигистаминными и противоаритмическими препаратами, а также бета-адреномиметиками (высокий риск отрицательного взаимодействия между этими лекарственными средствами). Гиосцина бутилбромид, как и другие М-холинолитики, ухудшает состояние больных с рефлюкс-эзофагитом, грыжей пищеводного отверстия диафрагмы вследствие расслабления нижнего пищеводного сфинктера и увеличения заброса кислого содержимого в пищевод. У пожилых больных с хроническими атоническими запорами, у ослабленных больных существует риск развития непроходимости кишечника. При хронических заболеваниях легких при применении М-холинолитиков может произойти сгущение секрета и увеличиться степень бронхиальной обструкции. У мужчин возможно снижение потенции.
При продолжительном приеме отменять препарат следует постепенно, во время лечения категорически нельзя употреблять алкогольные напитки, находиться на жарком солнце, выполнять интенсивную физическую работу или заниматься спортом (нарушение функций потовых желез препаратом при одновременной инсоляции может вести к тепловому удару).
Таким образом, статус гиосцина бутилбромида как безрецептурного средства не освобождает больного от необходимости периодического врачебного контроля. Именно с этими проблемами связано то, что в настоящее время за рубежом известные у нас М-холинолитики используются все реже. К тому же выраженность их эффекта зависит от исходного тонуса парасимпатической нервной системы, что определяет существенные индивидуальные различия эффективности препаратов у пациентов с различной выраженностью ваготонии.
Ингибиторы фосфодиэстеразы (иФДЭ)
На подавлении активности ФДЭ IV основан эффект традиционных широко применяемых спазмолитиков, таких как дротаверин (Но-шпа). Поскольку ФДЭ IV представлена в гладкомышечных клетках по всей длине кишечника, желче- и мочевыводящих путей, то ее блокада дротаверином (Но-шпа) оказывает универсальное спазмолитическое действие, независимо от степени контракции или причины, ее вызвавшей. Дротаверин, в отличие от гиосцина бутилбромида и других миотропных спазмолитиков, обладает противоотечным и антивоспалительным эффектами (ФДЭ IV типа активно участвует в процессе развития воспаления).
Фармакодинамические свойства лежат в основе патогенетического лечебного эффекта дротаверина и широко используются не только для снятия острого спастического синдрома, но и при обеспечении длительной фармакотерапии, например, при дискинезиях желчных ходов, желчно-каменной болезни, хронических заболеваниях кишечника со спастическим синдромом, сопровождающимся коликообразными или распирающими болями. Отсутствие антихолинергической активности положительным образом сказывается на безопасности дротаверина, расширяя круг лиц, которым он может быть назначен, в частности, снимаются ограничения применения у детей (можно с года жизни), у мужчин пожилого возраста с патологией предстательной железы, а также при сопутствующей патологии и совместном приеме с другими препаратами.
Терапевтическая концентрация дротаверина в плазме при приеме внутрь наблюдается в течение 45 мин. После однократного перорального приема 80 мг максимальная концентрация в плазме достигается через 2 часа, а биодоступность при приеме внутрь составляет 60%. Препарат хорошо проникает в различные ткани, метаболизируется (окисляется) почти полностью до монофенольных соединений, метаболиты быстро конъюгируются с глюкуроновой кислотой. Период полувыведения составляет 16 часов. Около 60% дротаверина при пероральном приеме выделяется через ЖКТ и до 25% с мочой. Наличие лекарственной формы как для энтерального, так и парентерального введения делает возможным широкое использование препарата в экстренной ситуации с последующим переходом на прием внутрь с целью длительного применения. Так, парентеральное введение дротаверина (Но-шпы) обеспечивает быстрый и сильный спазмолитический эффект, что особенно важно при развитии острых, интенсивных коликообразных спастических болей.
Дротаверин (Но-шпа, Но-шпа форте) эффективен при лечении различных желудочно-кишечных заболеваний, характеризующихся спазмом гладкой мускулатуры (дискинезии желчевыводящих путей, спазме сфинктера Одди, пилороспазме, синдроме раздраженной кишки), активно применяется при мочекаменной болезни, повышении артериального давления, нарушениях регионального кровотока, в том числе и для самолечения.
В двойном слепом плацебо-контролируемом клиническом исследовании применение Но-шпы достоверно уменьшало болевой синдром при дискинезии сфинктера Одди у 60% больных, тогда как плацебо в 55% случаев не влияло на интенсивность болевого синдрома. В этом исследовании Но-шпа оказалась в 2 раза более эффективной, чем анальгетики. Результаты исследований показали, что Но-шпа является средством выбора при спазмах гладкой мускулатуры билиарной системы как для монотерапии, так и в комбинации с другими препаратами и хирургическими методами лечения. В двойном слепом рандомизированном исследовании с плацебо-контролем у 62 больных с синдромом раздраженной кишки и запором в течение 8 недель лечения Но-шпой достоверно снизилась боль в животе (на 47%) и метеоризм. В другом рандомизированном двойном слепом исследовании эффективность Но-шпы изучалась у 70 больных в возрасте с синдромом раздраженной кишки в течение 4 недель. Результаты показали, что Но-шпа значительно уменьшает частоту боли по сравнению с плацебо — на 47% (р
М. В. Пчелинцев, кандидат медицинских наук, доцент
Институт фармакологии СПбГМУ им. акад. И. П. Павлова, Санкт-Петербург