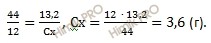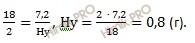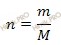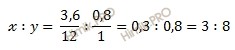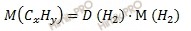что означает плотность по водороду
Как вычислять относительную плотность вещества
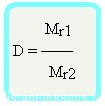
Для того чтобы справиться с задачей, необходимо использовать формулы на определение относительной плотности:
D (воздух) = Mr (газа)/ Mr (воздуха), где:
Все три параметра единиц измерения не имеют.
Mr (воздуха) = 29 (величина постоянная), следовательно формула будет иметь вид:
D (воздух) = Mr (газа)/ 29.
По аналогии выглядит формула на определение относительной плотности по водороду, с тем исключением, что вместо воздуха стоит водород. А значит, и в расчет берется относительная молекулярная масса водорода.
Mr (водорода) = 2, следовательно и формула будет иметь вид:
D (воздух) = Mr (газа)/ 2.
Пример № 1. Вычислите относительную плотность аммиака по воздуху. Аммиак имеет формулу NH3.
Сначала найдите относительную молекулярную массу аммиака, которую можно рассчитать по таблице Д.И. Менделеева.
Ar (N) = 14, Ar (H) = 3 х 1 = 3, отсюда
Mr (NH3) = 14 + 3 = 17
Подставьте полученные данные в формулу на определение относительной плотности по воздуху:
D (воздух) = Mr (аммиака)/ Mr (воздуха);
D (воздух) = Mr (аммиака)/ 29;
D (воздух) = 17/ 29 = 0, 59.
Пример № 2. Вычислите относительную плотность аммиака по водороду.
Подставьте данные в формулу на определение относительной плотности по водороду:
D (водород) = Mr (аммиака)/ Mr (водорода);
D (водород) = Mr (аммиака)/ 2;
D (водород) = 17/ 2 = 8, 5.
Химия, Биология, подготовка к ГИА и ЕГЭ
В ЕГЭ иногда встречаются задачи (часть С последнее задание), где в условии дана относительная плотность вещества по… водороду, кислороду, воздуху, азоту и т.д.
Относительная плотность вещества – отношение плотности вещества Б к плотности вещества А
Относительная плотность — величина безразмерная
Формула достаточно простая, и из нее вытекает другая формула —
Формула молярной массы вещества
Mr1 = D•Mr2
В условии задачи может быть полная формулировка — «относительная плотность (паров)…», а может быть просто «плотность вещества по…»
Давайте решим нашу задачу:
Дана плотность паров вещества по воздуху, значит, нам подходит формула молярной массы вещества —
Mr (вещества)=Mr(воздуха)•D=29 г\моль • D
Mr(вещества)=29 г\моль • 1.448 = 42 г\моль
Нам дан углеводород — СхHy, значит, мы можем найти Mr(Cx и Mr(Hy). Обратите внимание, именно молярные массы, т.к.у нас несколько атомов углерода и водорода.
Для этого надо молярную массу вещества умножить на процентное содержание элемента:
Mr(Cx)=Mr(вещества)•ω
Mr(Cx)= 42 г\моль · 0.8571=36 г\моль
x=Mr(Cx)\Ar(C)=36 г\моль ÷ 12 г\моль =3.
Точно так же находим все данные для водорода:
Mr(Hy)=Mr(вещества)•ω
Mr(Hy)= 42 г\моль · 0.1429=6 г\моль
x=Mr(Hy)\Ar(H)=6 г\моль ÷ 1 г\моль =6.
Искомое вещество — C3H6 — пропен.
Еще раз повторим определение —
Относительная плотность газа – это сравнение молярной или относительной молекулярной массы одного газа с аналогичным показателем другого газа.
Дана относительная плотность по аргону.
Mr (вещества)=Ar(Ar)•D
Mr (CxHy)=40 г\моль ·1.05=42 г\моль
Запишем уравнение горения:
СхHy + O2 = xCO2 + y\2H2O
Найдем количество углекислого газа и воды:
n(CO2)=V\22,4 л\моль = 33.6\22.4=1.5
Соотношение х : y\2 как 1.5 : 1.5, т.е. y=2x, что соответствует общей формуле алкенов: CnH2n
Выражаем в общем виде молярную массу: Mr=Mr(C) + Mr(H)
Наше вещество — C3H6 — пропен
Еще на эту тему:
Обсуждение: «Относительная плотность по… задачи»
Поясните, пожалуйста, как решать задачу : Укажите относительную плотность по кислороду паров дибромпроизводного алкана, молекула которого содержит 5 атомов углерода.
Спасибо.
Так. давайте по-порядку:
1) у нас дибромпроизводное алкана, содержащего 5 атомов С, т.е. его формула будет С5H10Br2
2) Mr( С5H10Br2 )= 230 г\моль
3) указать надо плотность паров по кислороду, т.е. нам нужна Mr (O2). Mr(O2)=32 г\моль
и, наконец,
4) D = Mr (( С5H10Br2 ) \ Mr(O2) = 230\32 = 7,1875
Спасибо, Лолита. Была у меня загвоздка с 4-м пунктом. Делила наоборот.
Спасибо Вам большое за помощь и прекрасные и доступные объяснения (уже не в первый раз 🙂 ).
Ой как приятно! И вам спасибо за добрый отзыв! Кстати, у вас осталось 2 тематических комментария — и вы получите подарочек от сайта! 🙂
Здравствуйте! Бьюсь над такой задачей. Если можете — помогите. Относительные плотности по неону паров высшего хлорида и бромида одного и того же элемента равны соответственно 8,5 и 17,4. Установите элемент. Буду признательна!
Добрый день! Все решается по формулам:
Mr(ЭxCly) = Mr(Ne) * D(Ne) = 8.5 * 20 г/моль = 170 г/моль;
M(ЭxBry) = Mr(Ne) * D(Ne) = = 17.4 * 20 г/моль = 348 г/моль;
Методом подбора по таблице Менделеева
Если хлора 1 атом, то Ar(Э) = 170-35.5 =134.5 г\моль
нет такого элемента
Если хлора 2 атома, то Ar(Э) = 170-71 =99г\моль
Возможно, это Те
Проверим по брому: Ar(Э) =348-160 = 188
не подходит
Значит, элемент трехвалентный — считаем, там тоже не подходит.
Остается валентность 4:
Ar(Эх) = 28 г\моль — получаем либо кремний: SiCl4 \SiBr4, либо галогеналкен: C2Cl4 \С2Br4
Оксид трехвалентного металла массой 12г восстановили смесью водородом с оксидом углерода. В результате реакции образовалось 5,4г воды и 413,2г диоксида углерода. Определите металл.
Э2О3 + 2H2 + CO = 2Э + 2H2O + CO2
n(H2O)=m\Mr = 0.3 моль
n(Э2О3) = 0.15 моль
Mr=m\n=12\0.15 = 80 г\моль
Ar(Me)=(80-48)\2 = 16 — такого металла нет
Пробуем по CO2:
n(CO2)=m\Mr=413.2\44 = 9.4 моль
n(оксида)=n(CO2)
Mr=m\n = … не получается
Проверьте условие задачи. Что-то там не то с числами…
CxHy+O2 = xCO2 + y/2H2O
Что означает уравнение реакции? сколько атомов вступило в реакцию, столько же и образовалось, Значит, если в веществе х атомов С (Сх), то и CO2 будет х молекул.
Если водорода вступило y атомов, то образуется y\2 молекул воды.
Проще на примере:
допустим, сожгли этан:C2H6
вот уравнение:
С2Н6 + O2 = 2CO2 + 3H2O
Понятно?
Здравствуйте,помогите пожалуйста с задачей:при сжигании органического в-ва массой 8.6 г получили V(СО2)=13.44 дм3 и m(H2O)=12.6г.
Относительная плотность этого в-ва по кислороду равна 2.6875.
определите молекулярную формулу в-ва.
Относительная плотность вещества по воздуху = M(вещества) \ M(воздуха) (29 г\моль)
Относительная плотность вещества по водороду = M(вещества) \ M(H2)
M(вещества)=M(N2)*D=28г\моль*1.57
M(Cx)=M(вещества)*0.818
X=M(Cx)\12 г\моль
Количество водорода = М(вещества)-М(Сх)
Ответ вам уже дан 🙂
Здраствуйте,смотрите я не могу понять как это решить((
1.Укажите относительную плотность карбона(IV) оксида с азотом
2.Укажите малярную масу газов относительная густота какого за водородом равняеться 32
3.Укажите относительную густоту пропану за C3H3воздухом
4.Укажите формулу газа который тяжелее воздуха(надеюсь вы мне ответите по тому что я в химии полный ноль()
W(H)=14,3%
Относительная плотность по водороду 21.
Найти формулу CхHy
Добрый день!
Тут все ровно по 2-м формулам:
M(CxHy)=21*2 г\моль = 42 г\моль
M(Hy)=42 г\моль* 0.143 = 6 г\моль
y = M(Hy)\Ar(H) = 6\6 = 1
значит, M(Cy)=42-6 = 36 г\моль
y = M(Cy)\Ar(C) = 36\12 = 3
C3H6
Помогите пожалуйста. Природный газ состоящий из этана, пропан, метана имеет относительную плотность по водороду 10.8. Рассчитайте массовую долю углерода в газе.
Помогите, пожалуйста, решить задачу:
Плотность смеси озона с кислородом по водороду равна 18. Найти, исходя из этого, объёмный состав смеси.
Средняя молярная масса смеси равна M(смеси) = M(H2)*D(H2) =18*2 = 36 г/моль
Пусть доля кислорода в ней будет Х, тогда доля озона будет 1 — Х
Тогда уравнение будет выглядеть так:
16Х = 12
Х = 0,75 ии 75 %
В смеси 75 % кислорода и 25 % озона
Относительные плотности по водороду оксидов элементов Х и Y равны, соответственно, 14 и 15. Определите формулы этих оксидов. Как решить, пожалуйста!
Добрый день!
M( оксида 1) = 14*2 г\моль = 28 г\моль, предположим, что в оксиде 1 атом О, тогда 12 г\моль — атомная масса элемента. Это С
M( оксида 2) = 15*2 г\моль = 30 г\моль. Если у нас 1 атома О, то 14 г\моль — приходится на элемент, но такого в Периодической системе нет. Предположим, то элемент одновалентный, т.е. оксид состоит из двух атомов элемента, по 7 г\моль — это Li
Газовую смесь, состоящую из этена и водорода и имеющую плотность по водороду 4,9 пропустили над нагретым паладиевым катализатором. При этом образовалась газовая смесь с плотностью по водороду на 20% больше исходной газовой смеси. Определите объемные доли веществ в полученной газовой смеси
Химия. 10 класс
*§ 8-1. Закон Авогадро. Относительная плотность газов. Объёмная доля газа в смеси
Закон Авогадро. Относительная плотность газов. Объёмная доля газа в смеси
Как вам известно, вещества могут находиться в твёрдом, жидком и газообразном состоянии. Молекулы жидкости и твёрдого вещества располагаются близко друг к другу. Это возможно благодаря тому, что молекулы притягиваются друг к другу. То есть существуют силы, которые удерживают молекулы жидкости или твёрдого вещества вместе. Из курса химии 8-го класса вы знаете, что эти силы называются силами межмолекулярного взаимодействия. Молекулы газов находятся на значительно большем расстоянии друг от друга, чем в случае жидкостей и твёрдых веществ. На таком расстоянии молекулы практически не взаимодействуют друг с другом. Поэтому, чтобы превратить жидкость или твёрдое вещество в газ, необходимо преодолеть силы межмолекулярного взаимодействия, отдалив молекулы друг от друга.
Переход в газообразное состояние осуществляется в результате нагревания веществ, находящихся в твёрдом или жидком состоянии (кипение жидкостей, возгонка твёрдых веществ).
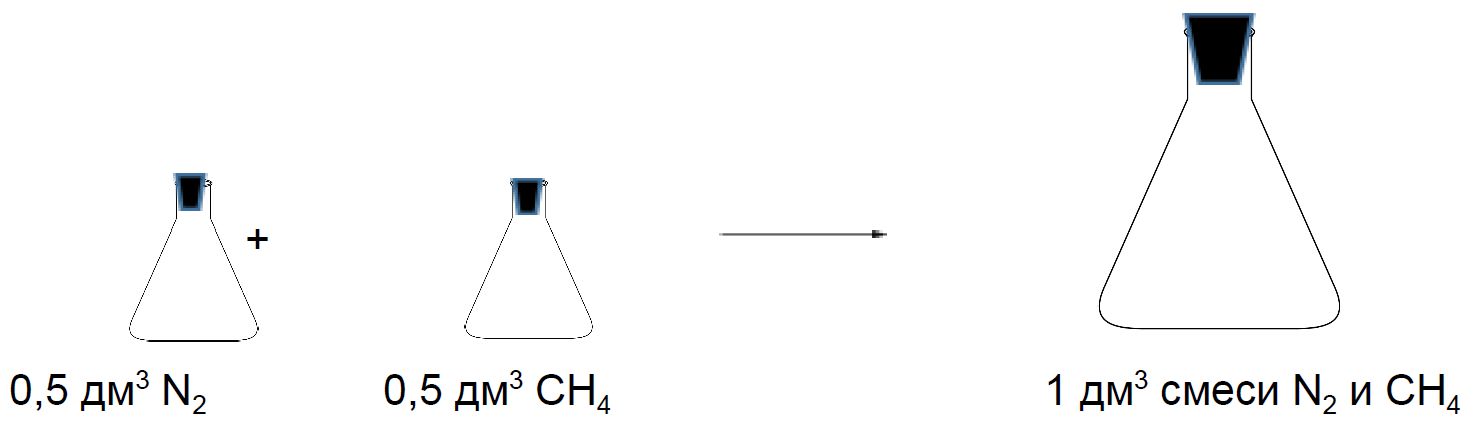
Так как расстояние между молекулами газов значительно больше размеров самих молекул, то объём, который занимает газ, — это, по существу, объём свободного пространства между хаотически движущимися молекулами газа. Величина этого пространства определяется условиями, при которых находится газ, т. е. температурой и давлением. Эта величина примерно одинакова для всех газов. При этом объёмом, занимаемым самими молекулами, можно пренебречь. Отсюда следует закон Авогадро — в равных объёмах различных газов при одинаковых условиях содержится одинаковое число молекул.
Интересно знать
Из закона Авогадро вытекают два основных следствия.
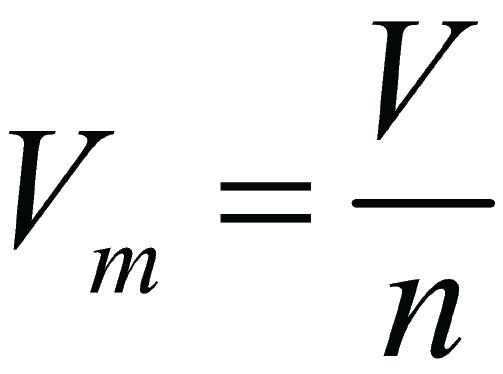
Таким образом, из закона Авогадро следует, что 22,4 дм 3 любого газа при нормальных условиях содержат 6,02 ∙ 10 23 молекул.
Второе следствие. Плотности газов относятся между собой как молярные массы газов.
Это видно из следующих соображений. Пусть имеется две порции различных газов. Рассчитаем их плотности:
газ 1: 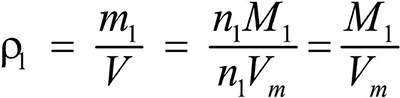
газ 2: 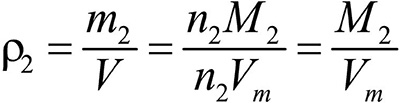
Разделив плотность первого газа на плотность второго, получим: 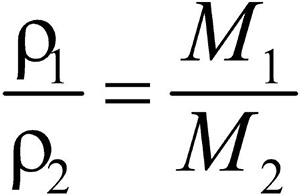
Зная D и молярную массу одного газа, легко найти молярную массу другого газа:
Пример 1. Относительная плотность газа по водороду равна 8. Определите молярную массу газа.
Пример 2. Относительная плотность некоторого газообразного углеводорода по воздуху равна 2. Определите молярную массу углеводорода.
Средняя молярная масса воздуха равна 29 г/моль ;
Следует отметить, что газы с молярной массой меньше 29 легче воздуха, больше 29 — тяжелее.
В расчётных задачах могут быть даны относительные плотности неизвестного газа по азоту, кислороду и другим газам. В этом случае для нахождения молярной массы неизвестного газа необходимо умножить относительную плотность на молярную массу соответственно азота (28 г/моль ), кислорода (32 г/моль ) и т. д.
Закон Авогадро широко применяется в химических расчётах. Поскольку для газов объёмы пропорциональны количествам (моль) веществ, то коэффициенты в уравнении реакции между газообразными веществами, отражающие количественное соотношение реагирующих веществ, пропорциональны объёмам взаимодействующих газов. Очевидно, что объёмы должны быть измерены при одинаковых условиях.
Пример 3. Какой объём кислорода потребуется для сжигания 2 дм 3 пропана? Объёмы измерены при н. у.
Уравнение реакции горения пропана:
С3Н8 + 5О2 
2 дм 3 С3Н8 — 10 дм 3 О2
Смеси газов
Состав смеси газов часто выражают в объёмных долях. Объёмная доля газа обозначается греческой буквой φ (фи) и равна отношению объёма данного газа к объёму смеси. Рассчитаем объёмную долю азота в полученной выше смеси газов:
φ = 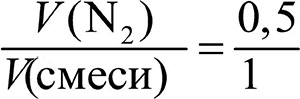
Пример 4. В результате пропускания 150 дм 3 (н. у.) воздуха через избыток известковой воды выпало 0,201 г осадка. Найдите объёмную долю (%) углекислого газа в данном образце воздуха.
Уравнение реакции взаимодействия углекислого газа с известковой водой:
СО2 + Са(ОН)2 = СаСО3 
Найдём количество (моль) карбоната кальция, выпавшего в осадок (M(CaCO3) = 100 г/моль ):
По уравнению реакции:
Рассчитаем объёмную долю углекислого газа в воздухе:
V(CO2) = 0,00201 ∙ 22,4 = 0,045 дм 3 ;
φ(СО2) = 0,045/150 = 0,0003, или 0,03 %.
Уравнение реакции взаимодействия водорода с хлором:
H2 + Cl2 
Поскольку после взаимодействия осталось 10 см 3 хлора, то 40 см 3 исходной смеси прореагировало. Хлор и водород реагируют между собой в равных объёмных отношениях. Исходя из этих соображений, в реакцию вступили по 20 см 3 хлора и водорода. Поскольку осталось 10 см 3 хлора, то в первоначальной смеси было 20 см 3 водорода и 30 см 3 хлора.
Рассчитаем объёмные доли газов в исходной смеси:
φ(Cl2) = 30/50 = 0,6, или 60 %.
Согласно закону Авогадро, в равных объёмах различных газов при одинаковых условиях содержится одинаковое количество молекул.
Один моль любого газа при нормальных условиях (температура таяния льда, атмосферное давление) занимает объём
Плотности газов, измеренные при одинаковых условиях, относятся между собой как их молярные массы. Это отношение называется относительной плотностью одного газа по другому газу.
Объёмная доля газа в смеси равна отношению объёма данного газа к общему объёму смеси.
Плотность водорода
Плотность водорода и другие его физические свойства
Его температуры плавления и кипения лежат весьма низко (см. таблицу). В воде он растворим незначительно – 2:100 по объему. Характерна для водорода растворимость в некоторых металлах.
Водород – самый легкий из всех газов, он в 14,5 раз легче воздуха; масса 1 л водорода при нормальных условиях равна 0,09 г. Молекулы водорода движутся быстрее всех остальных. Поэтому водород характеризуется наибольшей скоростью диффузии, т.е. скорее всех других газов распространяется в пространстве, проходит сквозь различные мелкие поры и т.д. Этим же обусловлена и его высокая теплопроводность. Так, при прочих равных условиях нагретый предмет охлаждается водородом в семь раз быстрее, чем воздухом.
Плотность вещества – это отношение его массы к объему:
Таблица 1. Физические свойства водорода.
Температура плавления, o С
Температура кипения, o С
Энергия ионизации атома, эВ
Сродство атома к электрону, эВ
Межъядерное расстояние в молекуле, нм
Стандартная энтальпия диссоциации молекул при 25 o С, кДж/моль
Распространенность водорода в природе
Водород является одним из наиболее распространенных элементов – его доля составляет около 1% от массы всех трех оболочек земной коры (атмосферы, гидросферы и литосферы), что при пересчете на атомные проценты дает цифру 17,0.
Основное количество этого элемента находится в связанном состоянии. Так, вода содержит около 11% (масс.), глина – около 1,5% и т.д. В виде соединений с углеродом водород входит в состав нефти, горючих природных газов и всех организмов.
Свободный водород состоит из молекул H2. Он часто содержится в вулканических газах. Частично он образуется также при разложении некоторых органических остатков. Небольшие количества его выделяются зелеными растениями. Атмосфера содержит около 0,00005% (об.) водорода.
Краткое описание химических свойств и плотность водорода
Водород проявляет сильные восстановительные свойства при повышенных температурах, реагирует с металлами, неметаллами и оксидами металлов.
Чтобы смесь, состоящая из водорода и натрия / кальция прореагировала, необходимо нагреть её до температуры 300 o С или 500 – 700 o С соответственно:
Водород при определенных условиях реагирует с солями, кислотными оксидами и другими сложными веществами. Так, реакция взаимодействия с сульфатом натрия протекает при нагревании (500 – 600 o С) и участии катализатора (Fe2O3):
В реакции с диоксидом углерода катализатором выступает оксид меди (I), а требуемая температура нагрева равна 200 o С:
Примеры решения задач
| Задание | Плотность паров простого вещества фосфора по водороду – 62. Определите формулу фосфора. |
| Решение | Отношение массы данного газа к массе другого газа, взятого в том же объеме, при той же температуре и том же давлении, называется относительной плотностью первого газа по второму. Данная величина показывает, во сколько раз первый газ тяжелее или легче второго газа. |
Молярная масса газа равна его плотности по отношению к другому газу, умноженной на молярную массу второго газа:
Тогда, молярная масса газа фосфора будет равна:
Относительная атомная масса фосфора равна 30,9738 а.е.м. Тогда, в состав молекулы фосфора входит Mgas /Ar(P) атомов фосфора:
Значит формула молекулы фосфора P4.
| Задание | Плотность газа по воздуху – 0,59. Массовая доля элемента азота в нем – 82,35%, а водорода – 17,65%. Выведите формулу газа. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
ω (Х) = n × Ar (X) / M (HX) × 100%.
Обозначим число атомов азота в молекуле через «х», число атомов водорода через «у».
Найдем соответствующие относительные атомные массы элементов азота и водорода (значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел).
Процентное содержание элементов разделим на соответствующие относительные атомные массы. Таким образом мы найдем соотношения между числом атомов в молекуле соединения:
x:y = 5,88 : 17,65= 1 : 3.
Значит простейшая формула соединения азота и водорода имеет вид NH3.
Значение молярной массы газа можно определить при помощи его плотности по воздуху:
Mgas = 29 × 0,59 = 17,11 г/моль.
Чтобы найти истинную формулу соединения азота и водорода найдем отношение полученных молярных масс:
M(NH3) = Ar(N) + 3 × Ar(H) = 14 + 3 × 1 = 14 + 3 = 17 г/моль.
Таким образом формула вещества будет иметь вид NH3. Это аммиак.
Химик.ПРО – решение задач по химии бесплатно
Определите истинную формулу углеводорода, при сжигании 4,4 грамм которого получили 13,2 грамм диоксида углерода (CO2) и 7,2 грамм воды (H2O). Относительная плотность по водороду (H2) 22.
Решение задачи
Рассчитаем молярные массы интересующих нас веществ: диоксид углерода (CO2), воды (H2O):
M (CO2) = 12 + 2 ⋅ 16 = 44 (г/моль);
M (H2O) = 2 ⋅ 1 + 16 = 18 (г/моль).
в 44 г диоксид углерода (CO2) содержится 12 г углерода (C)
в 13,2 г диоксид углерода (CO2) содержится Cх г
в 18 г воды (H2O) содержится 2 г водорода (H)
в 7,2 г воды (H2O) содержится Hу г
Следовательно, искомую формула углеводорода CхHу.
Исходя из отношения масс, найдем атомное отношение элементов. Для этого будем использовать формулу устанавливающую связь между химическим количеством вещества и массой:
Учитывая, что молярные массы углерода (C) и водорода (H) соответственно равны 12 г/моль и 1 г/моль, получаем:
Число атомов углерода (C) и водорода (H) относятся 3 : 8, следовательно простейшая формула углеводорода – C3H8.
Найдем относительную молярную массу углеводорода (C3H8), зная, что относительная плотность по водороду (H2) равна 22, по формуле:
Учитывая, что молярная масса водорода (H2) равна 2 г/моль, получаем:
M (CxHy) = 22 ∙ 2 = 44 (г/моль).
Найдем сколько раз молярная масса углеводорода (CxHy) ”вмещает” молярную массу (C3H8):
M (CxHy)/ M (CH) = 44/44 = 1.
Следовательно, молекулярная формула углеводорода C3H8 (пропан).
Ответ:
молекулярная формула углеводорода C3H8.