глутамат в мозге что это
Глутамат как модулятор иммунной системы
Глутамат является основным нейротрансмиттером возбуждения нервной системы, где он вызывает множество полезных и важных эффектов. Тем не менее, избыток глутамата, очевидный в калейдоскопе острых и хронических патологий, является абсолютно катастрофическим, поскольку он вызывает эксайтотоксичность и массивную потерю функции мозга.
Как полезные, так и вредные эффекты глутамата опосредуются большим семейством рецепторов глутамата (GluR): ионотропными рецепторами глутамата (iGluR) и метаботропными рецепторами глутамата (mGluR), экспрессируемыми большинством / всеми клетками нервной системы, и также многими ненейральными клетками в различных периферических органах и тканях.
Т-клетки экспрессируют на своей клеточной поверхности несколько типов функциональных GluR, как и некоторые другие иммунные клетки. Кроме того, глутамат сам по себе активирует нормальные Т-клетки человека, и индуцирует / повышает ключевые функции Т-клеток, в том числе: адгезию Т-клеток, хемотаксическую миграцию, секрецию цитокинов, экспрессию генов и многое другое. Глутамат также оказывает сильное действие на Т-клетки, активируемые антигеном / митогеном / цитокином. Более того, Т-клетки могут даже производить и высвобождать глутамат и воздействовать на другие клетки и самих себя через свой собственный глутамат
Рассеянный склероз и аутоиммунный энцефаломиелит
При рассеянном склерозе (MS) и аутоиммунном энцефаломиелите (EAE) наблюдаются избыточные уровни глутамата и разные аномалии в ферментах, расщепляющих глутамат, переносчиках глутамата, рецепторах глутамата и передаче сигналов глутамата.
Пагубная активация аутоиммунных Т-клеток глутаматом при РС может привести к: (1) Цитотоксичности в ЦНС: опосредованное Т-клетками уничтожение нейронов и глиальных клеток, что впоследствии приведет к увеличению внеклеточных уровней глутамата, и при этом усиливается эксайтотоксичность, опосредованная избытком глутамата, (2) высвобождение провоспалительных цитокинов, например TNFα и IFNγ, которые усиливают нейровоспаление. Наконец, если избыток глутамата, аномальная нейронная передача сигналов, активация Т-клеток, вызванная глутаматом, и высвобождение глутамата Т-клетками действительно играют ключевую роль в патогенезе рассяенного склероза, то дополнительные терапевтические эффекты включают антагонисты GluR, хотя они могут иметь различные побочные эффекты.
Удаление глутамата из мозга
Особенно привлекательной терапевтической стратегией является новый и совершенно другой терапевтический подход к минимизации избытка глутамата и эксайтотоксичности под названием «поглощение глутамата из мозга в кровь», разработанный для снижения избыточного уровня глутамата в ЦНС путем «откачки его» из мозга в кровь. Удаление глутамата достигается за счет снижения уровня глутамата в крови путем внутривенной инъекции фермента крови глутаматоксалоацетаттрансаминазы (GOT). Технология поглощения глутамата, которая все еще является экспериментальной, проверена на данный момент для других патологий головного мозга, но еще не протестирована на рассеянный склероз или EAE, может быть полезна и для MS, поскольку она может уменьшить как вредные эффекты избытка глутамата на нервные клетки, так и и активация аутоиммунных Т-клеток глутаматом в головном мозге
Антагонисты и энхансеры рецепторов глутамата
Некоторые антагонисты GluR блокируют ЕАЕ. Энхансер mGluR4 защищает от EAE через регуляторные Т-клетки (Tregs), тогда как дефицит mGluR4 усугубляет EAE. Защитный эффект mGluR4 на EAE требует тестирования энхансеров GluR4 у пациентов с рассеянным склерозом.
Пероральные терапевтические средства для лечения рассеянного склероза, а именно финголимод, диметилфумарат и их соответствующие метаболиты, финголимод-фосфат и монометилфумарат, могут защищать нейроны от острого глутаматергического эксайтотоксического повреждения. Кроме того, финголимод снижает опосредованную глутаматом внутрикортикальную возбудимость при ремиттирующем рассеянном склерозе. Глатирамера ацетат-КОПАКСОН®, иммуномодулятор для лечения рассеянного склероза, устраняет вызванные TNF-α изменения стимулирующих постсинаптических токов, опосредованных глутаматом в полосатом теле, у мышей с EAE.
Глутамат в мозге что это
Наиболее распространенный возбуждающий медиатор головного и спинного мозга — аминокислота L-глутамат. Значимый пример возбуждающих нейронов, использующих глутамат в качестве медиатора,— все нейроны, идущие от коры полушарий к белому веществу мозга, независимо от их направления в других частях коры полушарий, ствола или спинного мозга. Глутамат синтезируется из α-кетоглутарата, который, кроме того, служит субстратом для образования ГАМК.
ГАМК — самый распространенный в спинном и головном мозге тормозной медиатор, участвующий в работе приблизительно трети всех синапсов нервной системы. Миллионы ГАМКергических нейронов образуют основную часть вещества хвостатого и чечевицеобразного ядер, их также встречают в большом количестве в околоводопроводном сером веществе, гипоталамусе и гиппокампе. Кроме того, ГАМК выполняет функцию медиатора в крупных клетках Пуркинье, которые являются единственными клетками, выходящими из коры мозжечка. Аксоны клеток Пуркинье спускаются к зубчатому и другим ядрам мозжечка. ГАМК синтезируется из глутамата под действием фермента глутаматдекарбоксилазы.
Третий аминокислотный нейромедиатор — глицин. Глицин участвует в синтезе белков всех тканей организма и представляет собой простейшую аминокислоту, синтезируемую из серина в процессе катаболизма глюкозы. Этот нейромедиатор оказывает тормозное действие преимущественно в синапсах ассоциативных нейронов ствола мозга и спинного мозга.
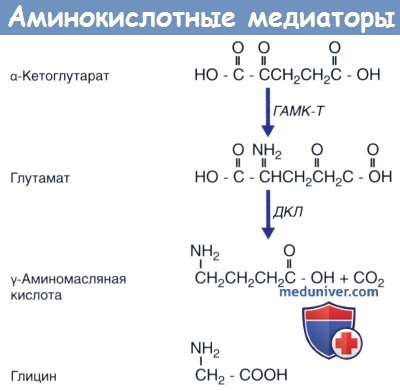
Глутамат синтезируется из а-кетоглутарата под действием фермента ГАМК-трансаминазы (ГАМК-Т);
γ-аминомасляная кислота (ГАМК) синтезируется из глутамата под действием декарбоксилазы глутаминовой кислоты (ДГК).
Глицин представляет собой простейшую аминокислоту.
а) Глутамат. Глутамат выполняет функцию нейромедиатора как в ионотропных, так и в метаботропных рецепторах. К ионотропным рецепторам относят АМРА-, каинат- и NMDA-рецепторы, которые получили свои названия благодаря активирующим их синтетическим агонистам: амино-метил-изоксазол-пропионовой кислоте, каинату и N-метил-D-аспартату, соответственно. Каинатные рецепторы редко встречаются изолированно; чаще всего они комбинируются с АМРА-рецепторами и входят в состав АМРА-каинатных (АМРА-К) рецепторов.
Характерная особенность многократно повторяющейся активации NMDA-рецепторов — долговременное потенцирование, проявляющееся возникновением ВПСП со значениями, превышающими нормальные показатели даже несколько дней спустя (см. далее — длительная депрессия).
Метаботропные глутаматные рецепторы Выделяют более 100 различных метаботропных глутаматных рецепторов. Все метаботропные рецепторы — это внутренние мембранные белки, большинство которых располагается на постсинаптических мембранах и оказывает возбуждающее действие. Некоторые метаботропные рецепторы локализуются на пресинаптической мембране и являются тормозными ауторецепторами.
б) ГАМК. ГАМК-рецепторы могут быть как ионотропными, так и метаботропными.
Действие седативных снотворных препаратов барбитуровой кислоты и бензодиазепина (например, диазепама) реализуется за счет активации ГАМКA-рецепторов. Аналогично действие этанола (потеря контроля социального поведения под влиянием действия этанола происходит вследствие растормаживания возбуждающих нейронов-мишеней, которые в обычном состоянии «сдерживаются» под действием ГАМКергических влияний). Механизм действия некоторых летучих анестетиков также заключается в связывании рецепторов, за счет чего ионные каналы остаются открытыми более долгое время.
Основной антагонист, занимающий активный центр рецептора, — конвульсант бикукуллин. Другой конвульсант — пикротоксин — связывается с субъединицами белка, в активном состоянии закрывающими ионный канал.
2. Метаботропные ГАМК-рецепторы. Метаботропные рецепторы, получившие название ГАМКВ, равномерно распределены во всех структурах мозга, их также обнаруживают в периферических вегетативных нервных сплетениях. Несмотря на то, что большое количество G-белков этих рецепторов выполняет роль вторичных посредников, значительная часть G-белков оказывает влияние на особый вид постсинаптических калиевых каналов — GIRK-каналы (G-белок-связанные калиевые каналы внутреннего выпрямления). При присоединении медиатора происходит отделение β-субъединицы, которая «выталкивает» ионы К + через GIRK-канал, что приводит к формированию ТПСП.
В некоторых случаях для лечения заболеваний, связанных с чрезмерным рефлекторным тонусом мышц (мышечная спастичность), применяют инъекции миорелаксанта баклофена (агониста ГАМКВ) в окружающее спинной мозг субарахноидальное пространство. Баклофен проникает в спинной мозг и ингибирует высвобождение глутамата из чувствительных нервных окончаний в основном за счет уменьшения поступления большого количества ионов Са 2+ в клетку, возникающего под влиянием потенциалов действия чрезмерной частоты.
3. Обратный захват глутамата и ГАМК. Обратный захват глутамата и ГАМК происходит двумя путями. В левой части каждого рисунка показано, что некоторые молекулы медиатора захватываются из синаптической щели транспортными белками мембраны и помещаются обратно в синаптические пузырьки. В правых частях рисунков изображен захват молекул медиаторов прилежащими астроцитами. Находясь в астроците, глутамат под действием глутаминсинтетазы превращается в глутамин. В процессе последующего транспорта к синаптическому уплотнению глутамат достраивается под действием глутаминазы и помещается в синаптический пузырек. ГАМК превращается в глутамат под действием ГАМК-трансаминазы. В процессе транспорта глутамат трансформируется в глутамин под действием глутаминсинтетазы.
Вернувшись в область синаптического уплотнения, глутамин под действием глутаминазы превращается в глутамат, из которого под действием глутаматдекарбоксилазы синтезируется ГАМК, молекулы которой помещаются в синаптические пузырьки.
Блокирование фермента глутаматдекарбоксилазы лежит в основе известного аутоиммунного заболевания — синдрома «скованного человека».
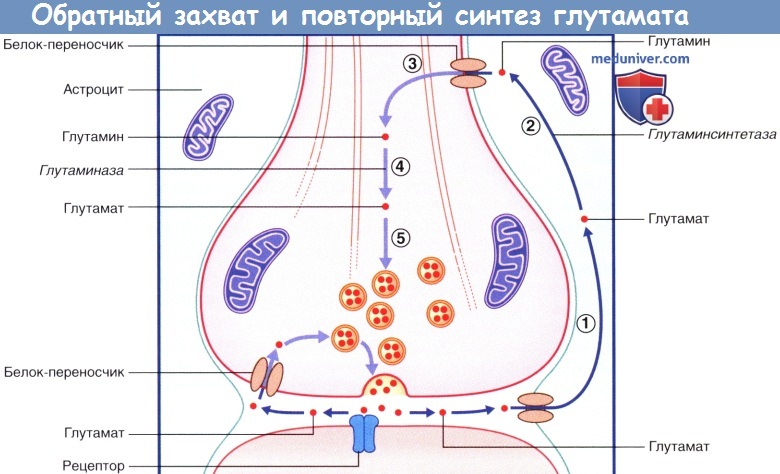
В левой части рисунка происходит обратный захват молекулы глутамата в неизменном виде.
В правой части рисунка (1) глутамат захватывается астроцитами, затем (2) под действием глутаминсинтетазы превращается в глутамин.
(3) Глутамин поступает в нервное окончание, (4) где под действием глутаминазы превращается в глутамат, который (5) возвращается в синаптические пузырьки. 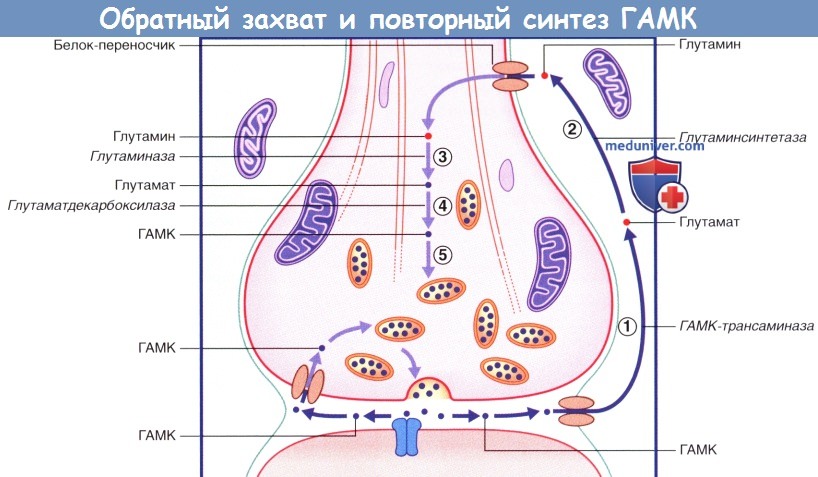
В правой части рисунка ГАМК захватывается астроцитами, затем (1) под действием ГАМК-трансаминазы превращается в глутамат, который (2) под действием глутаминсинтетазы превращается в глутамин.
(3) Глутамин поступает в нервное окончание и под действием глутаминазы образует глутамат.
(4) Глутамат под действием глутаматдекарбоксилазы превращается в ГАМК, которая (5) возвращается в синаптические пузырьки.
г) Глицин. Глицин синтезируется из серина в процессе катаболизма глюкозы. Основная функция этого нейромедиатора — обеспечение отрицательной обратной связи двигательных нейронов ствола мозга и спинного мозга. При инактивации глицина (например, при отравлении стрихнином) возникают мучительные судороги.
Обратный захват. В области синаптического уплотнения при помощи аксональных белков-переносчиков осуществляется быстрый обратный захват глицина с последующим его помещением в синаптические пузырьки.
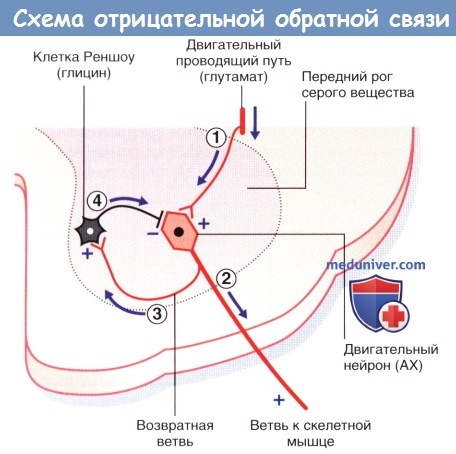
(1) Нейрон нисходящего двигательного проводящего пути оказывает возбуждающее действие на двигательный нейрон спинного мозга.
(2) Двигательный нейрон вызывает сокращение мускулатуры.
(3) Возвратная ветвь стимулирует клетку Реншоу.
(4) Клетка Реншоу оказывает ингибирующее влияние, достаточное для предупреждения чрезмерной активации двигательного нейрона.
Редактор: Искандер Милевски. Дата публикации: 12.11.2018
