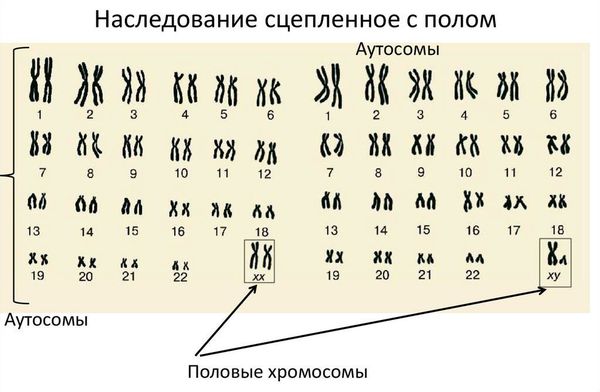
кариотип 46 xy у ребенка мальчика что это значит
Инверсия пола 46 XY
OMIM 400044
Наша команда профессионалов ответит на ваши вопросы
Инверсия пола, 46,XY
Наличие женского фенотипа при нормальном мужском кариотипе характеризует XY-инверсию пола. Наиболее частой причиной данного нарушения формирования пола является синдром Свайера – это полная или «чистая» дисгенезия гонад при кариотипе 46,XY. Частота XY-дисгенезии гонад составляет 1 на 30000 человек. Больные имеют женский фенотип без признаков двойственности полового развития: феминное телосложение, развитые по женскому типу наружные половые органы, нормально развитую или гипоплазированную матку и маточные (фаллопиевы) трубы. Однако у пациентов с синдромом Свайера практически отсутствуют женские половые железы, которые в данном случае представлены дисгенетичными гонадами, представляющими собой соединительнотканные тяжи (стреки) с небольшими включениями железистой ткани, овариально-подобной стромы без фолликулов. Как правило, диагностирование синдрома Свайера происходит у девочек в пубертатный период, когда у них не происходит нормального полового развития. Причиной обращения к врачу при этом является задержка полового развития и отсутствие начала менструаций, реже наличие злокачественных новообразований, происходящих из дисгенетичных гонад. Так как дисгенетичные гонады подвержены озлокачествлению, показано их удаление в детстве или на момент постановки диагноза XY-дисгенезии гонад. После оперативного лечения пациенткам, как правило, еще в подростковом возрасте назначается заместительная гормональная терапия, чтобы достичь нормального развития вторичных половых признаков и предотвратить развитие остеопороза. У женщин с XY-дисгенезией гонад нет собственных яйцеклеток, однако в некоторых случаях она в состоянии выносить плод, полученный в программе ЭКО при оплодотворении донорской яйцеклетки сперматозоидами супруга.
Инверсия пола, 46,XY тип 1 (OMIM 400044)
Наиболее частой из известных причин «чистой» формы дисгенезии гонад 46,XY являются микроструктурные перестройки Y-хромосомы c утратой гена SRY (Sex-determining region Y), а также точковые мутации данного гена. У 10-15% больных с синдромом Свайера обнаруживают отсутствие локуса SRY. В большинстве случаев это обусловлено утратой фрагмента дистальной части короткого плеча Y-хромосомы (Yp11.3), вследствие X-Y транслокации. Еще у 10-15% пациентов с данным синдромом выявляют мутации гена SRY.
Ген SRY локализован на коротком плече Y хромосомы и кодирует транскрипционный фактор – белок, связывающийся с генами, определяющими развитие пола плода по мужскому типу. Мутации в гене SRY приводят к синтезу функционально неполноценного белка и к нарушению дифференцировки клеток Сертоли и формирования семенных канальцев в развивающихся бипотенциальных гонадах плода, что вызывает дисгенезию гонад и развитие остальных органов половой системы по женскому типу, несмотря на наличие Y-хромосомы в кариотипе.
Инверсия пола, 46,XYтип 2 (OMIM 300018)
Данный тип XY-инверсии пола обусловлен дупликаций гена NR0B1 (DAX-1). Ген NR0B1локализован на коротком плече Х хромосомы (локус Хp21.3). Кодируемый этим геном белок DAX-1 играет важную роль в развитии и функции некоторых органов эндокринной системы, в том числе и половых желез. Еще внутриутробно он контролирует активность генов, участвующих в формировании этих тканей, а в постнатальном периоде DAX-1 регулирует выработку в них гормонов. Белок DAX-1 оказывает дозо-зависимый эффект на органы эндокринной системы. Дупликация гена NR0B1, а также делеция располагающегося рядом с геном NR0B1 локуса, негативно-регулирующего его транскрипцию приводит к XY-инверсии пола, обусловленной XY-дисгенезией гонад часто сочетающейся с нарушением функции надпочечников. Точковые мутации этого гена у пациентов с кариотипом 46,XY вызывают нарушение развития тестикулярной ткани, приводят к дефициту маскулинизации. Мутации в этом гене также вызывают Х-сцепленную гипоплазию надпочечников, как у пациентов с кариотипом 46,ХХ так и 46,XY.
Инверсия пола, 46,XY тип 3 (OMIM 612965)
Инверсия пола, 46,XY тип 4 (OMIM 154230)
Эта форма XY-инверсии пола обусловлена делецией локуса 9p24.3. У пациенток отмечают нормально развитые по женскому типу наружные половые органы, нормально развитую или гипоплазированную матку, при гистологическом исследовании гонад обнаруживают наличие незрелой тестикулярной ткани, содержащей клетки Сертолли, и отсутствие зрелых половых клеток. Инверсия пола у данных пациентов, вероятно, обусловлена потерей одной из копий дозо-чувствительного гена, локализованного в данном локусе. Генами-кандидатами являются DMRT1 и DMRT2.
Инверсия пола, 46,XY тип 5 (OMIM 613080)
Данная аутосомно-рецессивная форма инверсии 46,XY обусловлена наличием мутаций в гене CBX2, расположенного на хромосоме 17 (локус 17q25). В 2009 году Байсон-Лаубер описал случай новорожденной девочки с кариотипом 46,XY, у которой в результате секвенированияв гене CBX2 были обнаружены две мутации (P98L и R443P). В результате исследований у девочки были обнаружены нормально развитые яичники, с наличием овариальной ткани и первичных фолликулов, а также влагалище и матка. Однако возраст еще был слишком мал, чтобы оценить ее фертильность и дальнейшее половое развитие.
Инверсия пола, 46,XY тип 6 (OMIM 613762)
XY-инверсия пола связана с наличием мутации в гетерозиготном состоянии в гене MAP3K1, расположенном в локусе 5q11.2. Пациентки с данной формой дисгенезии гонад имеют высокий рост, который, вероятно, обусловлен избыточной продукцией андрогенов, тяжевидные яичники, гипоплазированную матку, иногда наблюдается клиторомегалия.
Инверсия пола, 46,XY тип 7 (OMIM 233420)
Инверсия пола обусловлена наличием у пациенток мутаций в гомозиготном или компаунд-гетерозиготном состоянии в гене DHH, расположенного в локусе 12q13.12. У нескольких пациенток было описано наличие недоразвитой матки, также присутствовали фаллопиевы трубы и наблюдали полную форму ХY-дисгенезии гонад (тяжевидные гонады, которые часто озлокачествлялись).
Инверсия пола, 46,XYтип 8 (OMIM 614279)
Данный тип XY-инверсии пола обусловлен мутациями гена AKR1C2, лежащего в локусе 10p15, отвечающего за альтернативный путь синтеза дигидротестостерона. Мутации сцепленного с ним гена AKR1C4, который сегрегирует вместе с геном AKR1C2, могут влиять на выраженность фенотипических проявлений.
В Центре Молекулярной Генетики проводится молекулярный анализ ключевых генов, контролирующих дифференцировку пола, в частности выполняется секвенирование генов SRY и NR5A1 (SF1), а также с помощью количественного метода MLPA проводится поиск делеций и дупликаций генов SRY, NR5A1 (SF1), NR0B1 (DAX-1).
Что такое синдром Морриса? Причины возникновения, диагностику и методы лечения разберем в статье доктора Литвинова В. В., репродуктолога со стажем в 38 лет.
Определение болезни. Причины заболевания
Синдром Морриса (синдром тестикулярной феминизации) — это врождённое генетическое заболевание, при котором у людей мужского пола ткани-мишени не чувствительны к мужским половым гормонам — андрогенам. Человек с синдромом Морриса генетически является мужчиной (имеет кариотип 46 XY), но выглядит как женщина.
Кариотип — это набор хромосом, который передаётся ребёнку от матери и отца. Кариотип позволяет определить характеристики индивида, включая пол. В норме у человека в генетическом наборе присутствует 46 хромосом, из них 22 пары аутосомных (не определяющих пол) и одна пара половых хромосом, которая определяет гендерную принадлежность ребёнка. Половые хромосомы женщины обозначаются как ХХ, мужчины — ХY. То есть нормальный женский кариотип — 46 XX, мужской — 46 XY.
Часто мужчины с синдромом Морриса даже не догадываются о своём биологическом поле (как и их родители) и живут как девочки/женщины. Это объясняется тем, что данная патология больше никак себя не проявляет, кроме проблем с фертильностью (способностью к зачатию) во взрослом возрасте.
Симптомы синдрома Морриса
Как правило, люди с синдромом тестикулярной феминизации имеют женский фенотип, т. е. внешне выглядят как женщины. Однако есть некоторые признаки, по которым можно определить наличие заболевания.
Патогенез синдрома Морриса
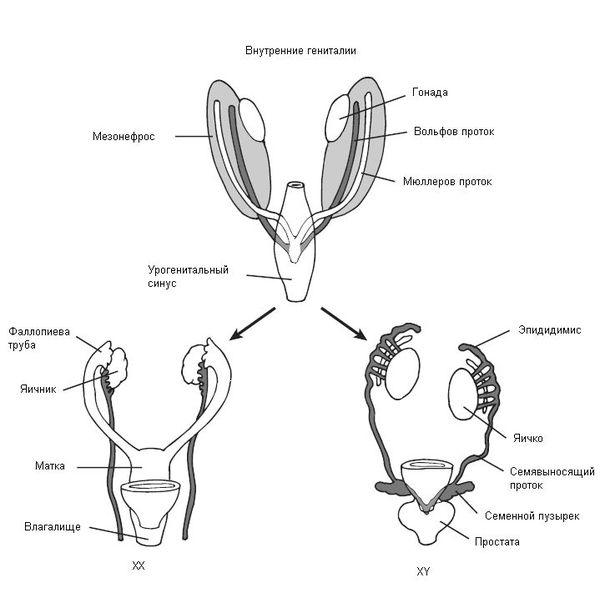
В начале эмбрионального развития у зародышей вне зависимости от хромосомного набора, образовавшегося при оплодотворении яйцеклетки сперматозоидом, половая система закладывается одинаково и предоставляет возможности для развития как женской, так и мужской половой системы. В частности, у зародыша одновременно формируются вольфов и мюллеров протоки, которые потом превращаются в семявыносящие протоки у мужчин и матку с фаллопиевыми трубами и влагалищем у женщин. Половые железы эмбриона (гонады) не дифференцированы и содержат первичные половые клетки (гаметы), которые могут превратиться как в клетки яичников (женские гонады), так и в клетки семенников (мужские гонады).
Таким образом, эмбрион до 6 недель является нейтральным по полу (имеет признаки и мужского, и женского пола). Далее процесс формирования половых признаков и в дальнейшем организма происходит под строгим контролем гормонов: у эмбриона мужского пола — под влиянием тестостерона (влагалище атрофируется), у эмбриона женского пола — под влиянием эстрадиола и прогестерона (влагалище трансформируется из «слепого мешка» и формируется шейка матки и матка). Тестостерон и эстрадиол вырабатываются как у мужчин, так и у женщин, только их соотношение разное. В норме у мальчиков соотношение мужского гормона к женскому 4\1, а в случае СТФ — 0\1. У девочек соотношение мужского гормона к женскому, прямо противоположное — 1\4.
Классификация и стадии развития синдрома Морриса
Синдром тестикулярной феминизации делят на две формы — полный и неполный. Дети с полной формой нечувствительности к мужским гормонам имеют однозначно женский внешний вид. При этом состоянии чувствительность организма к мужскому половому гормону (тестостерону) отсутствует полностью. Рождается здоровая «девочка», не имеющая, на первый взгляд, каких-либо отклонений в развитии.
Осложнения синдрома Морриса
Диагностика синдрома Морриса
Лечение синдрома Морриса
Лечение синдрома тестикулярной феминизации должно осуществляться междисциплинарной командой врачей, которая состоит из хирурга, гинеколога, генетика, эндокринолога и клинического психолога или психиатра.
Операция эффективна в 100 % случаев. Но так как удаляемые гонады мягкие и не имеют чёткой формы и структуры, возможны случаи неполного их удаления. Тогда оставшаяся ткань яичка может возобновить свою работу, что проявляется повышением тестостерона в крови и визуализацией на УЗИ гонады/гонад. В этом случае необходима повторная операция. Однако это случается очень редко.
Прогноз. Профилактика
Кариотип 46 xy у ребенка мальчика что это значит
ФГБУ Эндокринологический научный центр Минздравсоцразвития Российской Федерации
ФГБУ «Эндокринологический научный центр» МЗ РФ, Москва
ФГБУ «Эндокринологический научный центр» Минздрава РФ, Москва
ФГУ Эндокринологический научный центр Минздравсоцразвития Российской Федерации, Москва
ФГБУ «Национальный медицинский исследовательский центр эндокринологии» Минздрава России, Москва, Россия
ФГБУ «Национальный медицинский исследовательский центр эндокринологии» Минздрава России, Москва, Россия
Институт детской эндокринологии Эндокринологического научного центра, Москва
Эндокринологический научный центр, Москва
Нарушение формирования пола 46,XY, ассоциированное с мутациями в гене MAP3K1. Описание клинических случаев
Журнал: Проблемы эндокринологии. 2018;64(1): 45-49
ФГБУ Эндокринологический научный центр Минздравсоцразвития Российской Федерации
Причинами нарушения формирования пола (НФП) 46,XY могут быть мутации ряда генов, вовлеченных в процесс дифференцировки гонад. XY-инверсия пола может являться также следствием нарушений на уровне гена митоген-активированной протеинкиназы (MAPK) киназы киназы 1 (MAP3K1) и MAPK-сигнального пути. В последнее десятилетие было доказано участие MAPK-пути в инициации экспрессии гена SRY при формировании мужского гонадного пола у млекопитающих. Роль MAPK-сигнального пути в формировании пола у людей изучена недостаточно. Вероятно, MAP3K1 и MAPK-сигнальный путь являются одним из генетических путей, контролирующих нормальное развитие яичек. В настоящее время в литературе описано несколько семей и спорадических случаев НФП 46,XY вследствие мутаций в гене MAP3K1. Клиническая картина НФП у этих пациентов различна и варьирует от женского фенотипа с правильным строением наружных гениталий до мужского фенотипа с гипоспадией. Мы приводим описания редких клинических случаев нарушений формирования пола 46,XY (семейный случай НФП у единоутробных сестер и спорадический случай) с не описанными ранее мутациями в гене MAP3K1. В статье также кратко анализируется литература по данной патологии.
ФГБУ Эндокринологический научный центр Минздравсоцразвития Российской Федерации
ФГБУ «Эндокринологический научный центр» МЗ РФ, Москва
ФГБУ «Эндокринологический научный центр» Минздрава РФ, Москва
ФГУ Эндокринологический научный центр Минздравсоцразвития Российской Федерации, Москва
ФГБУ «Национальный медицинский исследовательский центр эндокринологии» Минздрава России, Москва, Россия
ФГБУ «Национальный медицинский исследовательский центр эндокринологии» Минздрава России, Москва, Россия
Институт детской эндокринологии Эндокринологического научного центра, Москва
Эндокринологический научный центр, Москва
Нарушения формирования пола (НФП) — группа врожденных патологий, сопровождающихся атипичным развитием хромосомного, гонадного и анатомического пола [1]. Формирование мужского пола определяется в первую очередь экспрессией гена SRY на Y-хромосоме, способствующего развитию недифференцированных гонад в тестикулы [2]. Наряду с геном SRY идентифицирован ряд генов и сигнальных путей, участвующих в детерминировании пола и ассоциированных с широким фенотипическим спектром НФП [3]. В недавних исследованиях были выявлены мутации в гене митоген-активированной протеинкиназы (MAPK) киназы киназы 1 (MAP3K1, также известном как MEKK1), которые были связаны с нарушением формирования пола 46, XY [4, 5]. Роль сигнального пути MAPK в определении пола у людей не изучена. Вероятно, MAP3K1 и MAPK-сигнальный путь является одним из генетических путей, контролирующих нормальное развитие яичек. В настоящее время в литературе описано несколько семейных и спорадических случаев НФП 46, XY, обусловленных мутациями в данном гене [4, 5]. Известные случаи НФП 46, XY, ассоциированные с геном MAP3K1, отличаются различной клинической картиной, варьирующей от женского фенотипа с правильным строением наружных гениталий до мужского фенотипа с микропенисом и гипоспадией различной степени.
Клинический случай № 1
Пациентка О. при рождении была зарегистрирована в женском поле и воспитывалась как девочка. По данным медицинской документации, при первичном патронаже была выявлена гипертрофия клитора, однако обследование не проводилось, к эндокринологу не обращались. У пациентки отмечался спонтанный поздний пубертат с нарушенным порядком появления вторичных половых признаков (адренархе в 14 лет, телархе в 17 лет), первичная аменорея. Впервые была обследована по месту жительства в возрасте 16 лет. Был выявлен гипергонадотропный гипогонадизм (ЛГ 23,4 мМе/мл, ФСГ 99,1 мМЕ/мл), кариотип 46, XY.
Девочка была госпитализирована в детское отделение ФГБУ ЭНЦ в возрасте 17 лет. При объективном осмотре отмечался нормальный рост (164,3 см, SDS роста +0,35), половое созревание соответствовало стадии II по Таннеру (В2Р2). Наружные половые органы были сформированы неправильно [клитор гипертрофирован (2,5—3 см) с головкой, слабо развитые кавернозные тела, меатус у основания клитора, скротолабиальный шов расщеплен, вход во влагалище сужен]. Отмечались высокий уровень гонадотропинов [ЛГ 88 Ед/л (2,6—12), ФСГ 104 Ед/л (1,9—11,7)], эстрадиола [70 пмоль/л (97—592)], тестостерона [3,11 нмоль/л (0,1—2,7)]. Показатели дигидроэпиандростендиона-сульфата (ДГЭА-С) и 17-гидроксипрогестерона (17-ОНП) находились в пределах референсных значений [7,52 мкмоль/л (0,92—7,6) и 3,6 нмоль/л (0,1—7,0) соответственно]. При МРТ органов малого таза определялись матка в виде тяжа 2,3×0,9 см и гонады (справа 2×1 см, слева 0,7×1,4 см). Был установлен диагноз: нарушение формирования пола 46, ХУ и рекомендована диагностическая лапароскопия, при которой в малом тазу были обнаружены гипоплазированная двурогая матка, две маточные трубы, дисгенетичные гонады с обеих сторон. При морфологическом исследовании операционного материала в ФГБУ ЭНЦ была верифицирована двусторонняя гонадобластома. При повторном исследовании гистологических препаратов в ФНКЦ ДГОИ им. Д. Рогачева была подтверждена двусторонняя гонадобластома с трансформацией в дисгерминому с правой стороны. Девочка была консультирована онкологом. Учитывая данные КТ органов грудной клетки (очаговых и инфильтративных изменений не выявлено), гистологический тип опухоли и стадию заболевания, химиотерапия не назначалась. Рекомендована непрерывная заместительная терапия женскими половыми гормонами. В последующем проведена феминизирующая пластика наружных гениталий.
Пациентка Б., 13,5 года, единоутробная сестра пациентки О., была обследована в связи с отсутствием спонтанного пубертата и диагностированием НФП 46, XY у старшей сестры (см. рисунок). 
При рождении отмечалось правильное строение наружных гениталий. По данным обследования, проведенного в возрасте 13 лет, был также определен кариотип 46, XY, при УЗИ органов малого таза — аплазия матки и яичников. При клиническом осмотре рост девочки составил 155,9 см (SDS роста = –0,64), половой статус соответствовал стадии I по Таннеру. Наружные половые органы были сформированы по женскому типу. Лабораторно был подтвержден гипергонадотропный гипогонадизм [ЛГ 39,9 Ед/л (2,6—12), ФСГ 137 Ед/л (1,9—11,7), эстрадиола 43,3 пмоль/л (97—592)], отмечался нормальный уровень тестостерона [0,6 нмоль/л (0,1—2,7)]. При МРТ органов малого таза была выявлена матка в виде тяжа, гонады не визуализировались. При диагностической лапароскопии в малом тазу обнаружена гипоплазированная матка, две маточные трубы, гонады в виде стреков. Морфологическое исследование операционного материала верифицировало дисгенезию гонад по овотестикулярному типу.
Обеим пациенткам было проведено молекулярно-генетическое исследование методом высокопроизводительного параллельного секвенирования с использованием разработанной в ФГБУ ЭНЦ панели олигонуклеотидов, предназначенной для анализа 45 генов, ассоциированных с различными формами нарушения формирования пола. У обеих девочек была выявлена гетерозиготная мутация p. C691R в гене MAP3K1. Данная мутация не была прежде описана. У матери пациенток молекулярно-генетическое исследование на данный момент не проведено. Однако учитывая наличие идентичной гетерозиготной мутации MAP3K1 у единоутробных сестер, зачатых от разных отцов, можно сделать вывод, что данная миссенс мутация была унаследована от матери и, вероятно, послужила причиной НФП 46, XY.
Клинический случай № 2
У пациента М. при рождении отмечалось неправильное строение наружных половых органов. При обследовании по месту жительства был определен кариотип 46, ХУ. В гормональном профиле в возрасте 8,5 мес отмечался незначительно повышенный уровень ФСГ (5,28 мМЕ/мл), низкие показатели тестостерона, ЛГ и 17-ОНП. При УЗИ яички лоцировались в мошонке (справа 0,75×0,52 см, слева 0,87×0,59 см). При К.Т. малого таза предстательная железа и семенные пузырьки не визуализировались.
Ребенок впервые был обследован в ФГБУ ЭНЦ в возрасте 11 мес. При осмотре обращало на себя внимание неправильное строение наружных гениталий [яички пальпировались в расщепленной мошонке, искривленный половой член длиной около 3 см, кавернозные тела плотные, головка полового члена сформирована, по дорсальной поверхности — рассекающая борозда полового члена; узкий урогенитальный синус, открывающийся на мошонке (мошоночная форма гипоспадии); половой член за счет искривления утоплен в мошонке]. Отмечались: незначительное повышение уровня ФСГ [3,8 Ед/л (0—2)], низкие показатели тестостерона [(0,17 нмоль/л (0,3—0,6)], ЛГ [0,2 Ед/л (0—1,5) и антимюллерова гормона [12,8 нг/мл (63—132)]. При мультистероидном анализе крови данных за нарушение стероидогенеза не получено. При пробе с хорионическим гонадотропином (4 инъекции по 1000 МЕ) отмечалось повышение уровня тестостерона до 5,7 нмоль/л, что свидетельствовало о нормальном функционировании клеток Лейдига. Ребенку был установлен диагноз: НФП 46, XY, в дальнейшем были проведены пластические операции по устранению искривления полового члена и гипоспадии. При молекулярно-генетическом исследовании (панель генов «нарушение формирования пола») выявлена гетерозиготная мутация с.2858 2872del CAАCААCААCААCАА р.944 948del в гене MAР3К1. Данная мутация также не была ранее описана. Планируется проведение молекулярно-генетического исследования гена MAР3К1 с целью поиска аналогичной делеции.
Обсуждение
MAPK активируются посредством эволюционно консервативного трехкомпонентного сигнального каскада, состоящего из митоген-активированной протеинкиназы киназы киназы-1 (MAP3K1), MAP2K и MAPK [3]. MAPK-сигнальные пути являются ключевыми путями регуляции клеточной пролиферации и дифференцировки [6, 7]. Нарушения в регуляции MAPK-каскада способствуют развитию ряда онкологических заболеваний [8]. Относительно недавно была выявлена ассоциация MAP3K1 с нарушением формирования пола 46, XY, однако роль MAPK-сигнального пути в развитии данной патологии у людей до сих пор не изучена. Экспрессия MAP3K1 наблюдается в эмбриональной гонаде мышей на 11-й день после зачатия, что соответствует стадии формирования гонад, а также на 13-й день после зачатия в канальцах яичек [4]. Роль MAPK-пути в определении пола у млекопитающих была определена посредством идентификации мутаций гена MAP3K4 у мышей, у которых инверсия пола предположительно связана с неспособностью активировать экспрессию гена SRY [9, 10]. Показано, что при отсутствии двух изоформ митоген-активированной протеинкиназы киназы киназы-1 (p38a и p38b) формируется инверсия пола XY, которая также обусловлена нарушениями на уровне экспресии SRY [11]. Таким образом, имеющиеся в литературе данные свидетельствуют об участии MAPK-пути в инициации соответствующей экспрессии SRY при формировании мужского гонадного пола у млекопитающих. У людей взаимосвязь между мутациями в гене MAP3K1 и нарушением формирования пола 46, XY была впервые прослежена при анализе сцепления генов на длинном плече 5 хромосомы у пациентов с НФП из двух семейств и в 11 спорадических случаях [4]. Было идентифицировано 6 мутаций в гене MAP3K1 и проведен их функциональный анализ. Клинические проявления в описанных случаях были различны, начиная от полностью женского фенотипа без вирилизации наружных гениталий до мужчин с микропенисом и/или с гипоспадией. Различный фенотип при одной и той же мутации отмечался и среди пациентов в пределах одной семьи. В другом исследовании у 4 пациентов с НФП 46, XY, преимущественно с мужским фенотипом и разной степенью нарушения развития наружных гениталий, были также выявлены мутации в гене MAP3K1 [5]. При сопоставлении генотипа и фенотипа при одной из идентифицированных миссенс-мутаций было установлено, что у всех пациентов с этой мутацией отмечался мужской фенотип с гипоспадией. Данная миссенс-мутация также ассоциирована с бронхиальной астмой [12]; аномалии развития наружных гениталий ранее не были описаны. Таким образом, ее значимость остается неизвестной.
Интересно, что у нокаутных по MAP3K1 мышей не наблюдается реверсии пола [13, 14]. Эти животные остаются жизнеспособными с сохранной репродуктивной функцией, но со сниженным количеством клеток Лейдига и увеличенной длиной эмбриональных гонад. Поэтому авторы предположили, что MAP3K1 не играет существенной роли при формировании тестикулов у мышей. Это может свидетельствовать о том, что сигнальные пути MAP-киназы у человека и мыши не идентичны [3]. На сегодняшний день роль MAP3K1 в определении пола у людей остается малоизученной. Фенотип полной дисгенезии гонад 46, XY аналогичен фенотипу при мутациях в гене SRY, т. е. мутации MAP3K1 могли бы влиять на ранние стадии формирования яичек.
У наших пациентов с НФП 46, XY при молекулярно-генетическом исследовании на панели, которая включала 45 генов, ассоциированных с различными формами нарушения формирования пола, мутации были найдены только в гене MAP3K1. В описанных нами случаях у пациентов с идентифицированными мутациями в гене MAР3К1 отмечалась различная клиническая картина НФП 46, XY, характеризующаяся разной степенью дифференцировки гонад и формирования наружных гениталий. В первой представленной нами семье предполагается наследование гетерозиготной мутации от матери, что характерно для семей с НФП 46, XY вследствие мутаций гена MAP3K1 [4]. Выявленные гетерозиготные мутации прежде в литературе не были описаны. С целью подтверждения их патологической значимости планируется проведение молекулярно-генетического исследования родителям пациентов.
Заключение
Причиной нарушения формирования пола 46, XY может служить патология целого ряда генов, вовлеченных в процесс дифференцировки гонад. Участие гена MAP3K1 и MAP-киназного сигнального пути в развитии НФП было установлено относительно недавно и в настоящее время недостаточно изучено. Клинические проявления у пациентов с 46, XY НФП, предположительно обусловленных мутациями в гене MAP3K1, отличаются выраженной гетерогенностью. Данных о значимой корреляции генотипических и фенотипических особенностей в литературе нет. Учитывая вероятность вовлечения MAP3K1 и MAPK-сигнального пути в процесс нормального развития яичек, необходимо дальнейшее изучение патологической значимости мутаций данного гена в развитии различной клинической картины НФП 46, XY.
Источники финансирования. Молекулярно-генетическое исследование на панель генов «нарушение формирования пола» выполнено при содействии Фонда поддержки и развития филантропии «КАФ». Авторы декларируют отсутствие иных явных и потенциальных конфликтов интересов, о которых необходимо сообщить.
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи. Получены письменные информированные согласия пациентов на публикацию представленных медицинских данных в этом журнале.